抗-PP1Pk的血清学特性探究及P 血型相关文献分析
2024-02-03李金龙叶水文孙君陈亚南向东
李金龙 叶水文 孙君 陈亚南 向东
(1.邢台市人民医院, 河北 邢台 054000; 2.南昌大学第二附属医院; 3.淄博市第一医院; 4.上海市血液中心)
P 血型系统为人类血型系统中第3 个被鉴定的类型[1]。由于多种因素,P 血型系统的命名在经历了多次修订。 2011年国际输血协会(ISBT)规范为P1Pk系统(包含P1、Pk及NOR 抗原)和Globside 系统(P 抗原)[2]。 罕见的p 表型个体由于A4GALT基因的突变而导致A4GALT 酶功能丧失,进而无法有效催化P1、Pk和P 抗原的合成。 这一表型的个体天生产生抗-PP1Pk(早期称为抗-Tja),该抗体是引发该类女性个体反复流产的主要原因[1,3]。 鸽子的蛋清中含有可中和抗-P1 的P1 物质[4]。 在本研究中,我们利用鸽子蛋清及人血浆中和抗-PP1Pk,旨在深入探讨抗-PP1Pk的血清学特性,为治疗p 表型孕妇习惯性流产寻找可能的治疗途径。现将结果报告如下。
1 材料与方法
1.1 标本来源
使用的抗-PP1Pk为AB 型人源性抗体,由上海市血液中心于2012 年2 月28 日采集。 献血者1 ~6 号血浆:随机抽取2023 年8 月9 日于上海市中心血站进行无偿献血者检测剩余血浆。 新鲜AB 血清(补体源): 2021 年9 月收集的当天20 人份AB 型无偿献血者的检测剩余血清混合。 相关血浆/清均置于-80℃保存。 补体灭活AB 血清:将新鲜AB 血清解冻后,56℃水浴30 min 灭活补体。
1.2 试剂与仪器
指示细胞使用3%抗体筛选细胞Ⅰ(O+、P2、MN)、Ⅱ(O+、P1、MM)(批号:20237033);抗-P1 试剂(IgM)(批号:20112018);抗-C3d 试剂(批号:20225201);巯基乙醇(2-Me)试剂(批号:20217703),均为上海血液生物医药有限公司产品;低离子柱凝集卡(BIO-RAD,批号:50531.75.13);ABO 正反定型及Rh 血型检测卡:(润普,批号:10230107);离心机(久保田,KA-2200 型)。
1.3 方法
1.3.1 鸽子蛋清稀释液的配制[5]并确定稀释比例
分离鸽子蛋中的蛋清与蛋黄,使用PH7.3 的1×PBS 稀释蛋清将蛋清倍比稀释(10 至1 280 倍)。 将鸽子蛋清稀释液与抗-P1 试剂以1 ∶9的比例混合(5 μL 倍比稀释的蛋清稀释液+45 μL 抗-P1 试剂),同时增加阳性对照(50 μL 抗-P1试剂)和阴性对照(5 μL 蛋清稀释液+45 μL 生理盐水)。 另外,我们进行了特异性验证(5 μL 蛋清稀释液和45 μL 抗-M试剂)以确认鸽子蛋清是否能够特异性地中和抗-P1。 鸽子蛋清在室温中和30 min 后加入抗体筛选细胞Ⅱ,分别观察试管法和抗人球蛋白卡(立即离心以及4℃反应15 min 后离心)中的结果。 因为进行了预试验,在对照孔中我们均使用50 倍稀释的鸽子蛋清。
1.3.2 不同反应体系对抗-PP1Pk效价的影响
分别使用生理盐水、新鲜AB 血清、补体灭活AB 血清倍比稀释抗-PP1Pk(1 至64 倍)。 取50 μL 倍比稀释抗-PP1Pk+50 μL 抗体筛选细胞Ⅱ(P1),立即离心以及4℃、37℃反应15 min 后离心,观察其在试管法与柱凝集卡上的结果。
1.3.3 鸽子蛋清中和抗-PP1Pk的效果验证
使用确定稀释倍数的鸽子蛋清稀释液与生理盐水倍比稀释的抗-PP1Pk血清以1:9 的比例混合,室温反应30 min。取50 μL 混合液+50 μL 抗体筛选细胞Ⅱ(P1),对照组为立即离心以及4℃、37℃反应15 min 后离心,观察其在试管法与柱凝集卡上的结果。
1.3.4 不同献血者血浆对抗-PP1Pk的中和作用
使用生理盐水将抗-PP1Pk进行1 ~64 倍倍比稀释并与献血者血浆以1 ∶1的比例混合,室温中和30 min。 取100 μL混合液+50 μL 抗体筛选细胞Ⅰ(P2)混匀后转100 μL 于柱凝集卡,立即离心观察结果。
1.3.5 抗-PP1Pk在不同介质中的激活补体情况
使用对抗-PP1Pk中和能力最强的献血者血浆对抗-PP1Pk进行倍比稀释(1 到32 倍),取50 μL 混合液+25 μL抗体筛选细胞Ⅰ(P2),至4℃反应30min。 加入25 μL 新鲜AB 血浆,混匀后37℃水浴30 min。 分别40 μL 至空白柱凝集卡(ABO 鉴定卡的后5 孔),以及加入50 μL 抗-C3d 的空白柱凝集卡,离心观察结果。 对照组使用生理盐水代替患者血浆进行倍比稀释,余条件不变。
2 结果
2.1 鸽子蛋清稀释倍数及效果确认
鸽子蛋清稀释液可以在盐水、柱凝集(直接离心)、柱凝集(4℃,15 min)3 种情况下完全中和抗-P1 的稀释倍数分别为160、160 和80。 为确保在随后的试验中能够完全中和抗体,我们最终决定采用鸽子蛋清稀释液的稀释倍数设定为50(表1)。
2.2 抗-PP1Pk血清学性质
所采用的抗-PP1Pk在盐水和柱凝集中的效价分别为4和8。 通过在不同温度和介质条件下进行试验,我们观察到抗-PP1Pk表现一定的冷抗体性质。 具体而言,在4℃条件下,其效价从4 增至8(盐水),以及8 增至16(柱凝集)。 然而,在37℃条件下,相对于室温其效价保持不变。 值得注意的是,在使用2-Me 破坏IgM 型抗体后,无论是在何种温度条件下,抗-PP1Pk的效价均呈现出2 管以上的降低,见表2,图1。
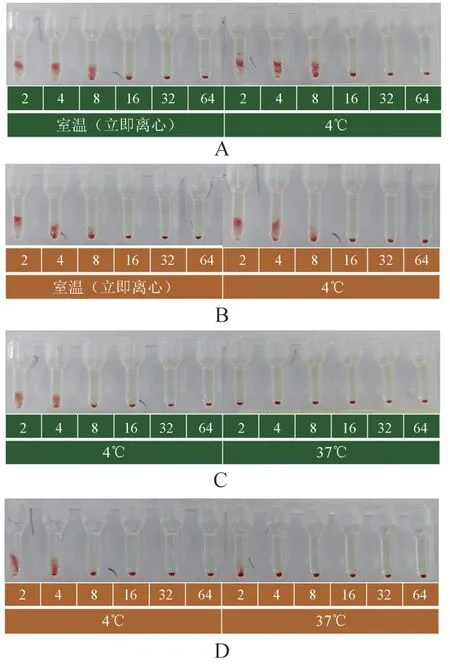
图1 鸽子蛋清对抗-PP1Pk 的中和作用Figure 1 Neutralization effect of pigeon egg white on anti-PP1Pk

表2 抗-PP1Pk血清学性质及对鸽子蛋清中和反应的效果Table2 Serological properties of anti-PP1Pk and its effect on neutralization reaction in pigeon egg white
2.3 鸽子蛋清对抗-PP1Pk的中和作用
使用50 倍稀释的鸽子蛋清中和后,抗-PP1Pk在盐水和柱凝集介质中的效价均小幅降低(不超过1 管)。 然而,对经过2-Me 处理的抗-PP1Pk血清使用鸽子蛋清进行中和,未显示出明显效果,见表2,图1。
2.4 不同体系对抗-PP1Pk效价的影响
在进行倍比稀释时,将常规AB 血清代替生理盐水,无论在不同温度条件下或不同介质中,均会让抗-PP1Pk的效价降低2 管左右。 相对于补体灭活AB 血清,使用新鲜AB血清会增加抗-PP1Pk的反应效价,其结果与使用生理盐水稀释时类似,见表3。 可能由于试验所用补体活性较低亦或是反应时长较短的原因,试验中未出现明显溶血现象。

表3 抗-PP1Pk在不同介质中的血清学性质Table 3 Serological properties of anti-PP1Pk in different media
2.5 不同献血者血浆对抗-PP1Pk的中和作用
不同献血者的血浆对抗-PP1Pk的中和效果各不相同。 有趣的是并不是P1 表型献血者的血浆更容易吸收抗-PP1Pk,见表4,图2。

图2 不同患者血浆对抗-PP1Pk 的中和作用Figure 2 Neutralizing effect of plasma from different blood donors on anti-PP1Pk

表4 不同献血者血浆对抗-PP1Pk的中和作用Table 4 Neutralizing effect of plasma from different blood donors on anti-PP1Pk
2.6 抗-PP1Pk 在不同介质中的激活补体情况
如表5、图3 所示,使用献血者血浆对抗-PP1Pk进行倍比稀释后,相对于盐水介质,其效价明显降低(2 管左右)。其中盐水2 稀释管和4 倍稀释管出现肉眼可见的溶血现象,而血浆中和组均未出现明显溶血。

图3 人血浆对抗-PP1Pk 致敏补体能力的中和作用Figure 3 Neutralization of the complement sensitizing capacity of anti-PP1Pk by human plasma

表5 抗-PP1Pk在不同介质中的激活补体情况Table 5 Activation of complement by anti-PP1Pk in different media
3 讨论
本研究通过使用鸽子蛋清中和法、2-巯基乙醇试剂破坏IgM 抗体、人血浆中和、添加补体成分等方法对抗-PP1Pk进行探究,发现抗-PP1Pk具有以下血清学特点:1)同时存在IgM 型和IgG 型,且4℃反应性均较37℃更强;2)抗-PP1Pk是由抗-P1、抗-P、抗-Pk等抗体组成的混合型抗体,本研究结果,鸽蛋清中和其中抗P1 后,总体反应活性明显下降;3)人血浆对抗-PP1Pk有较强的中和作用,可以减轻抗-PP1Pk激活补体的能力。
抗-PP1Pk为p 表型人群的天然抗体和习惯性流产密切相关[1]。 然而,由于p 血型人群的极其罕见,目前对抗-PP1Pk相关特性的研究相对较少。 本研究通过对p 表型先证者血清的深入研究,发现了抗-PP1Pk的一系列特性。 实验结果表明,在盐水法以及2-Me 处理后的柱凝集法中,抗-PP1Pk能凝集相应红细胞,证明该抗体既包含IgM 型,也包含IgG 型。 此现象在众多其他文献中也得到了印证[6-8]。 此外,该抗体表现出冷抗体性质,即使在低温(4℃)条件下,IgG 型抗体的效价也呈明显增加。 类似的现象在一些独立研究中也有所提及[9]。 P 抗原是1 种糖苷脂[1],这种现象可能与P 抗原的空间结构有关。
1975 年的1 项研究发现P2 型的鸽子饲养者血清中的抗-P1 阳性人群约34%远高于对照组的6%。 进一步的研究发现鸽子的细胞、血清、粪便中存在与人P1 抗原相似的抗原性物质[10]。 除了鸽子外,在包虫、绦虫、吸虫体内[3]以及斑鸠蛋清[11]中也发现了P1 物质。 鸽子蛋清中含有的P1 物质对抗-P1 有很强的中和作用[11]。 然而,本试验表明,在盐水中,鸽子蛋清能够部分中和抗-PP1Pk(效价降低1 管左右),但对IgG 型的抗-PP1Pk作用不明显。 这可能与鸽子蛋清只能中和抗-P1 有关,同时也从另1 个角度证明抗-PP1Pk是由抗-P1、抗-P 以及抗-PK等多种抗体组成的混合型抗体[3]。
新鲜血清中含有补体,抗-PP1Pk具有很强的激活补体的能力[1,12]。 被激活的C3b 半衰期仅60 μs 左右,只有在短时间内激活足够的C3b 才能引发溶血反应[3]。 即使补体含量不足以引发溶血,黏附在红细胞表面的C3 裂解产物C3d也会使红细胞更容易凝集,此外卡中的抗-C3d 也会与红细胞上黏附的C3d 结合从而出现凝集现象。 因此使用新鲜血清倍比稀释的抗-PP1Pk效价要明显高于普通血浆。
人血清中包含多种抗体可能会中和柱凝集卡中的试剂,在多数柱凝集介质中血清体系可导致反应结果偏低甚至出现假阴性。 然而,实验证实抗-PP1Pk在柱凝集介质以外,在盐水中也受到人血清的抑制作用。 此外,我们发现人血清对抗-PP1Pk的中和作用要强于鸽子蛋清。 后续的试验中我们使用P2 表型作为指示细胞同样显示出了人血浆的中和作用,这一现象应该是由于人血浆中含有P 抗原物质,也会与抗-PP1Pk中的抗-P 相互中和,导致反应减弱。
1927 年,Landsteiner 等[13]利用人血免疫兔子的实验手段,首次发现了P 血型系统,该系统涵盖了P+型和P-型血型。 随后于1951 年,Levine 等[14]在1 名女性胃癌患者身上观察到1 种特殊的抗体,该抗体能够使除她妹妹以外的所有人的红细胞发生凝集反应,Levine 等[14]将其命名为抗-Tja,其中“T”代表肿瘤(Tumor),而“J”取自患者名字“Jay”,并将这一新的血型系统被称为Jay 血型系统。 1955 年Sanger[15]发现多个独立的存在抗-Tja的受试者均为P-型,通过多方验证最终将Jay 血型将其并入P 系统之中称为p 型。目前,ISBT 将P 血型系统分为P1Pk系统以及GLOB 系统。其中,P1Pk系统涵盖了P1、Pk以及NOR 3 个抗原。 而GLOB系统仅包含P 抗原[2]。 P 血型主要包含P1、P2、Pk()以及p 等血型。
P1 型人群占比约75%,非洲和南美洲人群的比例高于白种人和亚洲人[1]。 P2 型仅仅意味着P1 抗原阴性,不存在单独的P2 抗原。 P1 抗原是由A4GALT基因编码的A4GALT 酶催化而来,由于A4GALT基因突变P2 型人群该基因的转录水平仅为P1 型人群的1/30。 P2 人群中常存在冷性抗-P1,但一般情况下这种抗体并不引发溶血反应[3]。P1 抗原的表达强度在个体间存在显著差异,并且这种差异可以通过遗传[3],因此在抗体鉴定时P1 阳性的指示细胞不一定出现凝集,鉴定抗-P1 时最好采用阴性排除法。 P1 抗原的发育表现出明显的阶段特异性,在胎儿时期表达强烈,随着胎龄的增加,其表达水平逐渐下降。 出生时,P1 抗原阴性,直至7 岁以上时才会完全形成[1]。
Pk是1 种高频抗原,同样由A4GALT 酶催化而来。 P 抗原是由B3GALNT1 基因编码的B3GALNT1 酶催化Pk抗原形成[1]。 由于所编码的基因不同Pk与P 属于不同的血型系统。 在P1 和P2 红细胞上Pk表达很弱,但P 抗原表达很强[1]。 当B3GALNT1 基因突变时Pk抗原无法转化为P 抗原,从而出现了Pk强表达而P 不表达的情况,即Pk型。 Pk型人群天然产生抗-P[1]。 1 项研究显示, Pk型人群的单个核细胞由于Pk抗原的强烈表达增强了对HIV 的免疫,相比之下,由于p 型人群不表达Pk,他们的单个核细胞对HIV 的易感性增加了10~1 000 倍[16]。
除p 型和Pk型细胞外,其他红细胞,包括胎儿红细胞均强表达P 抗原[17],这种强表达在胎肝、胎心以及胎盘上也可以观察到[18]。 这一特点为抗-P 或抗-PP1Pk引发严重新生儿溶血病(HDN)的基础。 值得注意的是,P 抗原是细小病毒B19 的受体,P 抗原阴性人群可能天然对B19 具有免疫力[19]。 抗-P 包括IgM 及IgG,这些抗体可能导致严重的血管内溶血[20]。 此外,阵发性冷性血红蛋白尿(PCH)伴有自身抗-P[21],这种抗体可以和P1、P2 细胞反应,而不与Pk细胞反应[1]。
p 血型多见于A4GALT基因突变,导致无法产生A4GALT 酶,从而无法催化产生P1,Pk以及包括P 抗原在内的所有下游抗原。 p 血型在人群中非常罕见,在欧洲每百万人中仅有5.8 例,中国香港地区在超过100 万人的筛选中仅发现了1 例p 血型[1],上海地区2 500 名献血者中未筛选出1 例p 血型[22]。 p 血型人群天然存在抗-PP1Pk,类似于抗-A、抗-B,这些抗体同样可以引发严重的溶血反应[14],并且是导致小p 血型妇女习惯性流产的首要因素[1]。 胎盘组织表达P1、P 和Pk抗原[23],胚胎和滋养层细胞早在5 周开始表达P 抗原, P1 抗原在第19 周出现。 P1 一旦出现,就会抑制P 和Pk抗原的表达[24]。 p 血型孕妇的流产往往发生在妊娠的前3 个月,然后,若能度过这个时间的,胚胎通常能够继续发育并产下健康的婴儿,在妊娠早期去除母亲体内抗体尤为重要[25]。 有报道认为IgG 性质的抗-PP1Pk可能是引起新生儿溶血的罪魁祸首[26],其他研究指出IgG3 型的抗-PP1Pk与流产存在强烈相关性[27]。 也有研究认为抗-PP1Pk引起流产主要是因为其中的抗-Pk攻击胎盘[28-29]。 1 项系统综述对16 例p 血型孕妇的情况进行总结,结果显示患者抗体效价和HDN 的发生没有明显的相关性,IgG 和IgM 型抗体都可能对胎儿生存造成威胁[30]。 通过对母体抗体进行中和,可以显著改善妊娠期胎儿的溶血情况[25,31]。
我们通过对罕见的抗-PP1Pk进行一系列实验。 发现抗-PP1Pk是1 种IgM 和IgG 并存、冷性、可以激活补体的由抗-P1 在内多种抗体组成的混合抗体。 使用人血浆可以在体外一定程度上中和抗-PP1Pk,并抑制其补体激活能力,有望为p 表型习惯性流产患者的治疗提供可能性方案。