血小板HPA-3,HPA-15 基因分型微滴式数字PCR检测体系的构建
2024-02-03孔小娇王红梅段生宝刘铁梅
孔小娇 王红梅 段生宝 刘铁梅
(1.吉林大学中日联谊医院,吉林 长春 130033;2.中国科学院苏州生物医学工程技术研究所)
人类血小板抗原(human platelet antigen,HPA)分布在血小板膜糖蛋白上,可以通过妊娠或血小板输注等途径免疫而产生抗-HPA,从而导致多种免疫性血小板疾病,包括胎儿新生儿同种免疫性血小板减少症(fetal/neonatal alloimmune thrombocytopenia,FNAIT)、输血后紫癜(post-transfusion purpura,PTP)和血小板输注无效(platelet transfusion refractoriness, PTR)等[1-2]。迄今为止已发现HPA-1~HPA-35共计35 个系统,其中HPA-1~HPA-5及HPA-15这6 个HPA 系统为双等位基因表达,其余29 个HPA 尚未发现对偶抗原。除HPA-14bw外,HPA 编码基因具有单核苷酸多态性(SNPs)特点,相应抗原是由单个碱基突变造成单个氨基酸替换产生[3]。其中,HPA-3和HPA-15是中国汉族人群中等位基因杂合程度最高的2个系统,理论上更易引起机体产生同种异体免疫反应,对其进行准确的基因分型具有较大临床意义[4]。本研究根据HPA-3,HPA-15的SNP 特点,设计适用于ddPCR 的特异性引物和探针,旨在构建HPA-3及HPA-15微滴式数字PCR检测体系,其不依赖于标准曲线及参考品,实现对血小板HPA-3,HPA-15准确定量基因检测,并初步探讨其应用于孕妇外周血中胎儿游离核酸的HPA基因相容性检测的可行性。
1 材料与方法
1.1 实验样品
HPA-3,HPA-15基因分型参考品(编号:360061,批号:202201),来源于中国食品药品检定研究院。2022 年6 月~2023 年6 月,收集67 例临床随机EDTA 抗凝全血标本,52 例健康的孕妇(无肿瘤病史)EDTA 抗凝全血标本,均来自于吉林大学中日联谊医院。1 例健康未孕女性全血标本来自志愿者捐赠。
1.2 主要仪器与试剂
数字PCR 系统(包括:微滴生成器、微滴分析仪、QuantaSoft 分析软件)(美国Bio-Rad,QX200)、PCR 仪(德国Eppendorf,AG6331)、离心机(德国Eppendorf,AG5811)、紫外分光光度计[赛默飞世尔科技(中国), NanoDrop 2000]、实时荧光定量PCR仪(美国Applied Biosystems,7500)、血液基因组DNA 提取系统(DP349)(北京天根,批号:Y1309)、血清/血浆游离DNA 提取试剂盒(DP339)(北京天根,批号:Y1725)、DG8 Gaskets for QX200TM/QX100TM Droplet Generator(美国Bio-Rad,批号:1000124111)、ddPCR Droplet Reader Oil(美国Bio-Rad, 批号:A1561645)、Droplet Generator Oil for Probes(美国Bio-Rad,,批号:A1556750)、ddPCR Supermix for Probes(no DUTP)(美国Bio-Rad,批号:64539072)、TaqPath™ProAmp™Master Mix(美国Applied Biosystems,批号2825154)、PowerUp ™SYBR ™Green Master Mix(美国Applied Biosystems,批号2745038)、Bsh1236I(BstUI)[赛默飞世尔科技(中国),批号:91292489]、RNase-free 双蒸水(上海生工生物工程,批号:JA08KA1161)。
1.3 标本的处理、全基因组DNA及游离DNA提取
按照血液基因组提取试剂盒及游离DNA提取试剂盒说明书操作,用NanoDrop2000 检测提取全血标本中基因组DNA 的浓度及纯度,A260/A280为1.7~1.9。
1.4 特异性引物及探针的设计、合成与验证
基于Human Platelet Antigen(HPA)数据库(http://www.versiti.org/HPA)及NCBI 数据库(https://www.ncbi.nlm.nih.gov/)所提供的HPA-3、HPA-15基因突变序列信息,结合文献及ddPCR 引物探针设计原则,利用Primer Express软件3.0.1设计HPA-3和HPA-15等位基因正向和反向引物以及等位基因特异性MGB 探针。β-actin,RASSF1A 基因引物参考文献[5],交由上海生工生物工程有限公司进行合成及纯化,见表1。通过Primer-BLAST对产物大小符合要求的序列进行查找和对比,确定引物是否具有特异性。HPA-3和HPA-15的基因突变类型为点突变,其各自aa、ab、bb基因型的区别在于单个碱基的突变。选取HPA-3,HPA-15基因型为aa及bb的参考品,加入双重探针进行ddPCR实验,每组重复3次,确定探针是否具有特异性。

表1 HPA-3,HPA-15 ddPCR基因分型引物及探针Table 1 Primers and probes for ddPCR genotyping of HPA-3 and HPA-15
1.5 ddPCR方法构建及检测体系优化
ddPCR 设置退火温度分别为:56.0、57.1、58.7、60.2、61.6、63.1、64.7、65.8℃。进行2 组平行实验,评估阳性液滴及阴性液滴分离程度、荧光信号值及拷贝数检测值,确定最佳退火温度。探针终浓度为250 nM 不变,设置正反向引物终浓度分别为900、700、500、300 nM。每个梯度进行3组平行试验,确立最佳扩增体系。具体操作流程如下:配制20 μL探针法定量反应体系,加入10 μL ddPCR Supermix for Probes(no DUTP),引物浓度为300~900 nM,探针浓度为250 nM,加入目的基因,用ddH2O补足至20 μL。振荡离心15 s后,反复吹打混匀至少20次,加入DG8TMcartridge中间1排8孔内,在DG8TMcartridge 最后1 排孔中加入70 μL Droplet Generator Oil for Probes,盖上胶垫,平稳放置在微滴生成仪中,生成微滴,缓慢吸取40 μL 微滴转移至96 孔PCR板相应位置孔内,放入PCR仪,开始扩增。扩增条件为:95℃10 min、94℃30s、56~65.8℃1 min,循环40 次,98℃10 min,4℃保存小于4 h。反应完成后将其放入微滴分析仪中进行荧光信号的检测和读取。QuantaSoft分析软件自动进行分析,人工核验后保存结果。
1.6 ddPCR检测体系性能评估
1.6.1 灵敏度实验
进行ddPCR预实验确定HPA-3及HPA-15参考品的初始拷贝数浓度,用双蒸水进行10 倍比梯度稀释,定量理论浓度(copies/μL)分别为1×104、1×103、1×102、1×101、1×100、1×10-1、1×10-2、1×10-3,每个浓度重复3 次。进行回归性分析评估其检测体系灵敏度及范围。
1.6.2 重复性及稳定性实验
分别配制2种低拷贝数浓度的目的基因,每个浓度进行3组平行实验,并间隔一定时间,分3次检验,计算批内及批间标准偏差(SD)及变异系(CV),以评估检测方法的重复性及稳定性。
1.6.3 临床标本检测
收集吉林长春地区67 例临床随机EDTA 抗凝全血标本,提取其DNA,调节浓度为30 ng/μL,采用本方法检测HPA-3、HPA-15基因型,与基因测序结果进行比较,评估本方法的准确性。
1.7 ddPCR 检测体系初步应用于检测胎母HPA-3及HPA-15相容性
1.7.1 胎母HPA-3及HPA-15基因型检测
应用ddPCR 检测体系检测52 例孕妇基因型,选取母亲基因型为HPA-3或HPA-15纯合子标本,对其游离DNA进行基因检测。若母亲基因型为纯合子而游离DNA 检测为杂合子,则说明胎儿基因型为HPA-3ab 或HPA-15ab,胎母血小板抗原不相容。若基因组DNA与游离DNA检测结果相同,考虑胎母血小板相容或未提取到胎儿游离DNA,进行RASSF1A和β-actin基因检测来确定是否提取到胎儿游离DNA。步骤简述如下:酶切体系:RNasefree 双蒸水16 μL,10×Buffer R 2 μL,游离DNAug 1 ng, BstUI 5 U。扩增RASSF1A和β-actin基因反应体系:2×PowerUp™SYBR™Green 10 μL,游离DNA模板8 μL,上下游引物终浓度均为800 nM,探针终浓度为250 nM,用RNase-free 双蒸水补至20 μL。PCR条件为95℃2 min,95℃15 s,60℃1 min 共40个循环。每个反应均设3个复孔,以健康未孕女性作为对照,观察有无熔解曲线。
1.7.2 ddPCR与qPCR检测灵敏度比较
预实验确定胎儿基因型为HPA-3ab 及HPA-15ab拷贝数浓度,计算胎儿游离DNA占游离DNA的百分比,倍比稀释后分别用ddPCR和qPCR检测胎儿基因型,对比两者灵敏度。qPCR检测体系为:2×TaqPath ™ProAmp ™Master Mix 10 μL,游离DNA 2.2 μL,上下游引物终浓度700 nM,探针终浓度200 nM,RNase-free 双蒸水补至20 μL。反应条件为:60 ℃2 min,95 ℃10 min,94 ℃30 s,60 ℃1 min,共40个循环。
1.8 统计学分析
HPA-3及HPA-15拷贝数梯度稀释后实际检测值平均值与理论值log 进行回归性分析,判断其理论值和实际值之间是否存在线性关系。并采用直接计数法计算基因频HPA-3、HPA-15对偶基因不配合率(MMP),计算公式为MMP=2ab(1-ab),其中a、b 为基因频率,利用SPSS17.0 软件进行χ2检验分析其基因频率是否符合Hardy-Weinberg 平衡验证(取值P>0.05)。
2.结果
2.1 引物及探针特异性验证
通过Primer-BLAST,HPA-3及HPA-15扩增产物序列与人类Refseq representative genomes 数据库基因序列对比,结果显示均只有1个相配的扩增产物,引物具有特异性。在双重探针实验中,HPA-3aa、HPA-3bb、HPA-15aa、HPA-15bb的参考品只在单一荧光通道显示荧光信号值,符合参考品基因型,说明MGB探针对检测体系具有特异性(图1)。

图1 HPA-3,HPA-15 ddPCR探针特异性检测结果Figure 1 Specific detection results of ddPCR probes for HPA-3 and HPA-15
2.2 ddPCR的反应条件及检测体系确立
对于HPA-3,当退火温度处于61.6℃时,其FAM 荧光通道阳性微滴荧光值对比其他温度较高,相同荧光值下,61.6℃时的微滴分布对比58.7℃及60.2℃时,其“落雪”现象较不明显,故HPA-3最佳退火温度为61.6℃。HPA-15在退火温度为57.1、58.7、60.2℃时,阳性微滴荧光值信号最高,但在3种温度下,60.2℃时的FAM 通道阴性微滴更为集中,呈现为单一直线,故HPA-15的最佳退火温度为60.2℃。固定探针终浓度为250 nM,探究不同引物浓度对检测体系的影响。当HPA-3引物浓度为900 nM时,FAM及VIC通道阳性微滴荧光值最高,所能检测的拷贝数最多,阳性微滴及阴性微滴的间隙更大,能更好的判读实验结果。HPA-15引物浓度为700 nM 时,FAM 通道阳性微滴荧光值最高,与900 nM时的荧光信号值相差较大,在VIC通道尽管900 nM时荧光信号值最高,但各个浓度之间的荧光信号值相差不大,且阳性微滴与阴性微滴分离程度都较为明显。故本研究HPA-3最佳引物浓度为900 nM,HPA-15最佳引物浓度为700 nM(图2)。
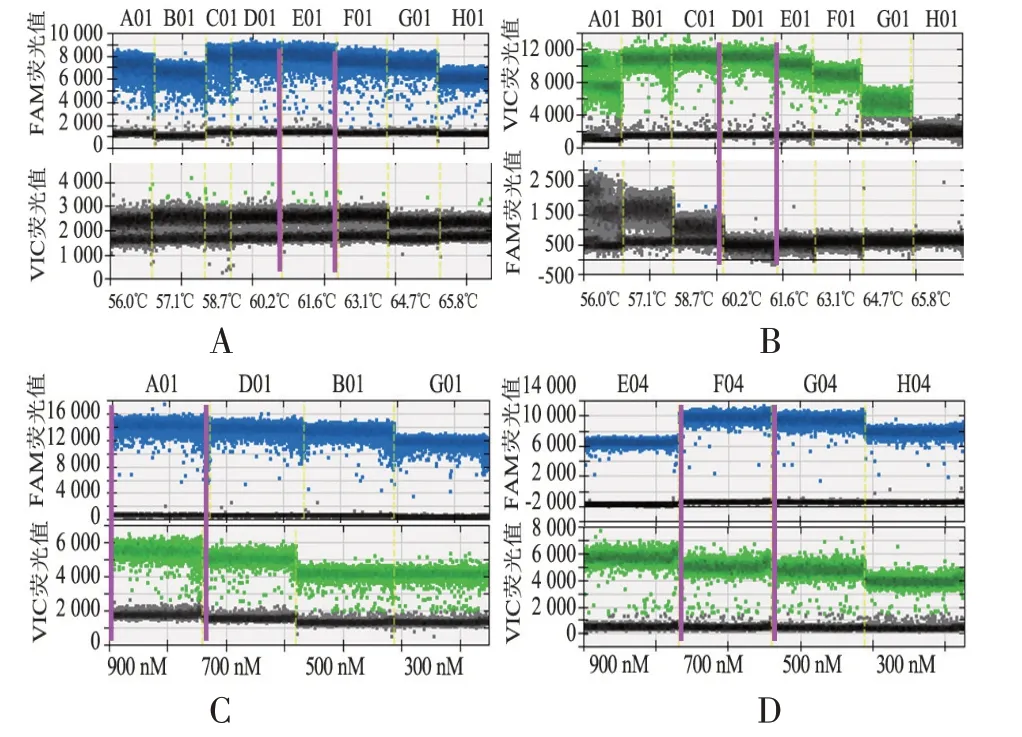
图2 HPA-3,HPA-15 ddPCR不同反应条件及检测体系结果Figure 2 Results of ddPCR under different reaction conditions and detection systems for HPA-3 and HPA-15
2.3 检测体系灵敏度验证
当HPA-3及HPA-15拷贝数浓度为1×104copies/μL,拷贝数结果显示“no call”,仪器不能检出预期拷贝数,表明浓度过高已超出检测上限。拷贝数浓度为1×10-1copies/μL 时,能够检出预期拷贝数,而低于此浓度的标本,检测结果均显示为0。因此,HPA-3及HPA-15的检测下限为1×10-1copies/μL。R2=0.999和R2=0.998,分别表明HPA-3及HPA-15理论值和检测值呈良好线性关系(图3)。
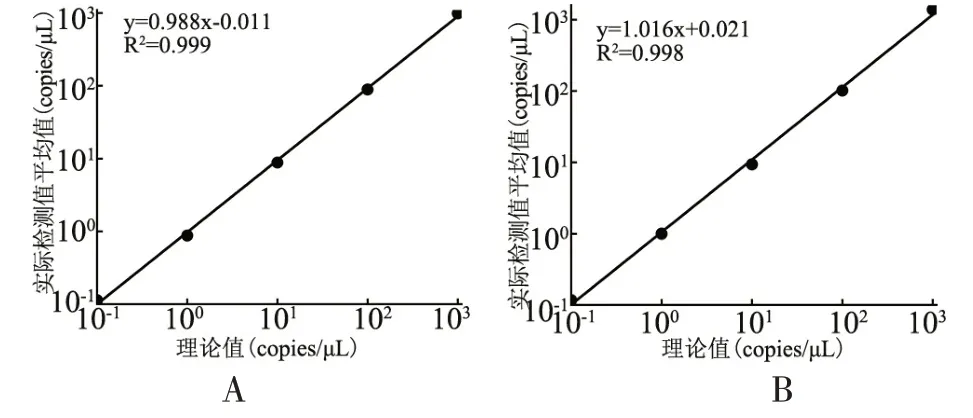
图3 HPA-3及HPA-15 ddPCR结果回归性分析Figure 3 Regression analysis of ddPCR results for HPA-3 and HPA-15
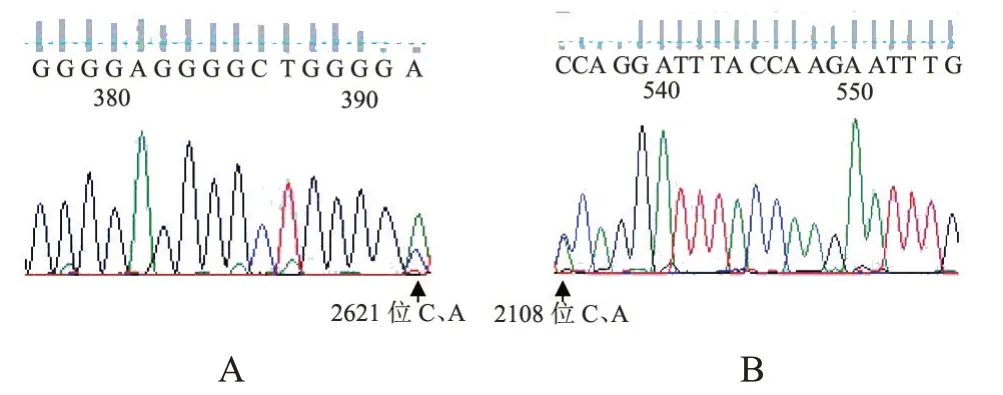
图4 HPA-3,HPA-15基因测序结果示例Figure 4 Examples of gene sequencing results for HPA-3,HPA-15
2.4 检测方法重复性及稳定性验证
配制HPA-3、HPA-15拷贝数浓度分别为1×102copies/μL、1×100copies/μL 的基因标本,做3 组平行,两个低浓度批次的标本批内变异系数分别为2.9%、4.8%、2.9%、4.8%(见表2)。每间隔7d 对HPA-3、HPA-15的2种低拷贝数浓度基因标本进行检测,共检测3 次,批间变异系数分别为2.5%、2.0%、1.7%、4.4%,表明血小板HPA-3,HPA-15ddPCR检测体系具有较好的重复性及稳定性(表3)。
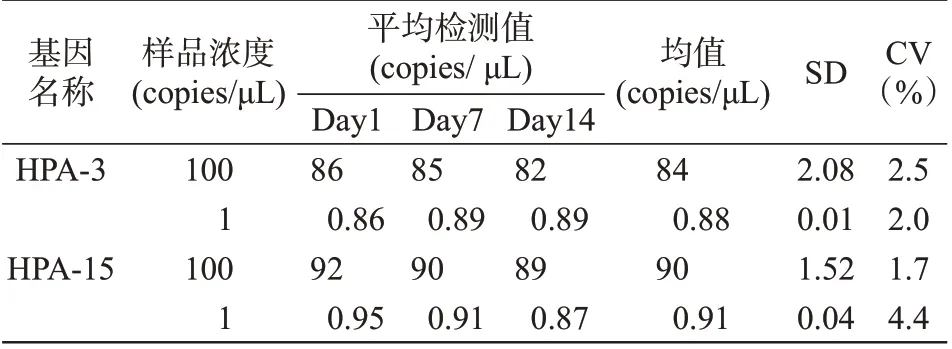
表3 HPA-3,HPA-15 ddPCR批间重复性Table 3 HPA-3,HPA-15 ddPCR inter-batch repeatability
2.5 临床标本HPA-3,HPA-15 ddPCR检测
通过对长春地区67 例临床随机标本检测,HPA-3a、HPA-3b的基因频率分别为0.537 3,0.462 7,HPA-15a、HPA-15b的基因频率分别0.522 4,0.477 6。两者基因不配合率分别为0.373 6,0.374 5,同时P>0.05,两者基因型频率及基因频率均符合Hardy-Weinberg 平衡(表4)。同时,进行基因测序比较,结果表明ddPCR 检测结果与基因测序完全一致,符合率100%,基因测序代表性结果见图4。
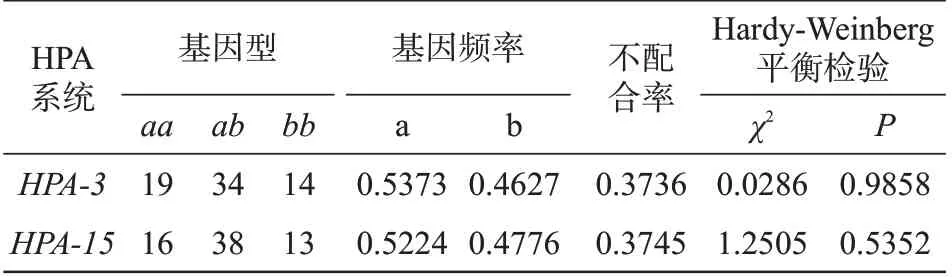
表4 长春地区67例临床标本HPA-3和HPA-15 ddPCR基因分型Table 4 ddPCR genotyping of HPA-3 and HPA-15 in 67 clinical samples from Changchun area
2.6 胎母HPA-3及HPA-15相容性检测
共检测孕妇标本52 例,其中HPA-3及HPA-15纯合子分别有10 例和12 例,纯合子孕妇标本中分别检测到HPA-3杂合子4 例,HPA-15杂合子5 例(图5)。纯合子标本未扩增出β-actin基因,有1 例HPA-3aa标本未能检测出RASSF1A基因,其余标本均检测到RASSF1A基因熔解曲线,而正常未孕标本两种基因均未扩增。说明此例标本未提取到胎儿游离DNA,具体检测结果见表5。

图5 胎母HPA-3及HPA-15相容性检测Figure 5 Fetal-maternal HPA-3 and HPA-15 compatibility test
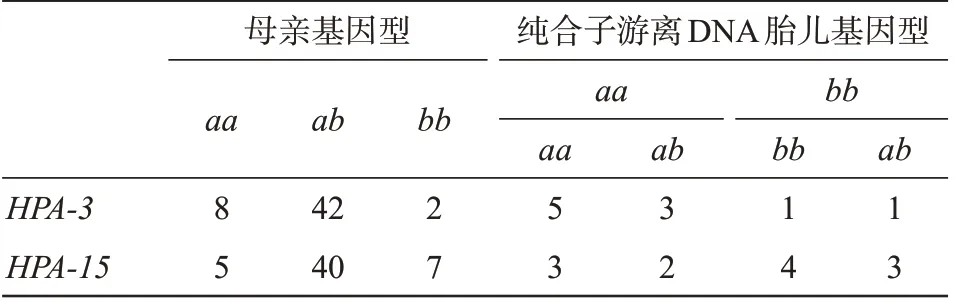
表5 52例孕妇及胎儿基因分型检测结果Table 5 Genotyping results of 52 pregnant women and fetuses
2.7 ddPCR与qPCR灵敏度比较
ddPCR 预实验确定胎儿游离DNA 占总游离DNA 的比值为20.8/400 copies/μL(5.2%),标本浓度稀释为10.4/400 copies/μL(2.6%),5.2/400(1.3%copies/μL,2.6/400 copies/μL(0.65%),1.3/400 copies/μL(0.325%)。实验结果表明在胎儿游离DNA浓度为≤0.65%,qPCR 检测不到具体基因型,而ddPCR仍可检测到相应荧光信号值,见图6。
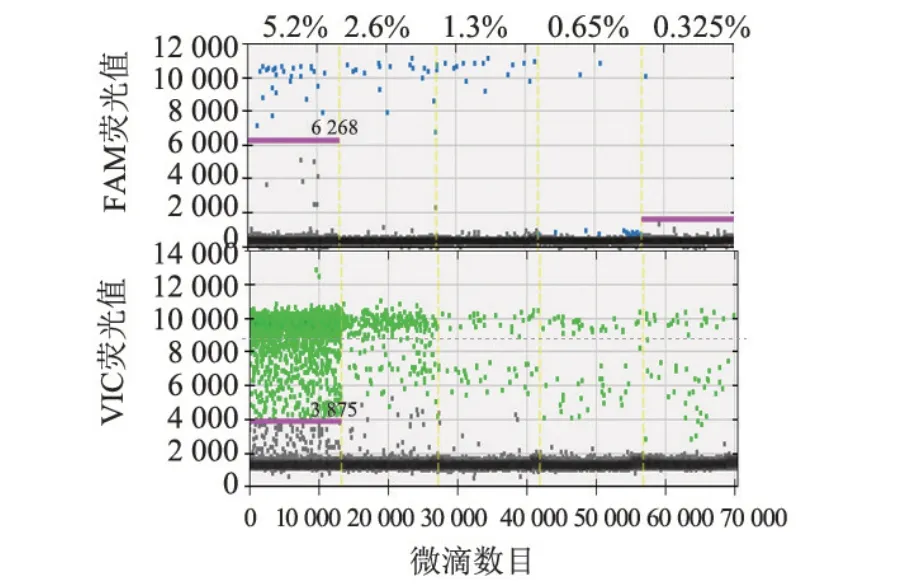
图6 ddPCR倍比稀释检测结果Figure 6 Results of ddPCR detection for 2-fold serial diluted samples
3 讨论
HPA抗原可以通过妊娠、血小板输注或器官移植引起同种异体抗体产生[6]。国外文献报道,HPA-1a和HPA-5b是参与白人血小板同种免疫疾病最重要的血小板抗原系统[7]。在中国,HPA-1bb,HPA-2bb,HPA-4bb,HPA-5bb,HPA-6bb的基因型频率几乎为零,而HPA-3,HPA-15系统中a的基因频率和b基因频率差距较小,数据统计,HPA-3a和HPA-3b的基因频率分别为0.578 8 和0.421 2,HPA-15a和HPA-15b的基因频率分别为0.534 3 和0.465 7,二者杂合程度较高,在妊娠及输血治疗时,产生血小板同种异体抗体,导致免疫性血小板疾病的几率较大[8]。
HPA-3,HPA-15自1990 年和2002 年被鉴定及阐明其等位基因以来,其多态性及临床意义就成为血小板输注的研究热点[9-10]。研究表明,临床输血前对HPA抗原进行基因配型能够有效降低出血风险,取得较理想治疗效果[11-12]。刘丙现等[13]对比了ABO 血型、HPA 基因型及固相凝集配型都相合的血小板输注有效率与仅ABO血型及固相凝集合的血小板输注有效率,后者仅为77.8%,前者可达到94.4%。因而,对HPA抗原进行基因分型能够提高血小板输注疗效,减少因配型不合产生的一系列血小板综合征,节约血小板资源。
HPA抗原检测由于缺少相应的单克隆抗体(除HPA-1a外),不能用传统血清学对HPA 进行定型。目前,实验室对HPA基因分型方法主要包括序列特异性引物聚合酶链反应(PCR-SSP),限制性片段长度多态性PCR(PCR-RFLP),序列特异性寡核苷酸探针法(PCR-SSOP),TaqMan 实时PCR 等[14-15]。其中PCR-SSP 通过对凝胶电泳条带的观察确定HPA基因型,目前应用较多,但其操作繁琐,难以自动化,依赖主观判读,错误率较高。PCR-RFLP 方法对个别基因型没有合适的酶切位点。TaqMan实时PCR方法灵敏度相对较高,但难以建立合适的细胞标准品,并极度依赖Ct 值及标准曲线,无法快速、简便的对HPA进行基因分型。
随着微流控和MEMS 技术和工艺的成熟,数字PCR 检测于1992 年首次被描述[16],它将单个PCR 管中的反应试剂划分为数万甚至数百万个微小的微滴,进行“单分子模板PCR扩增”,反应结束后根据阳性反应单元数目及泊松分布原理计算原始标本中的靶基因和拷贝数,无需要依赖标准曲线和标准品[17-18],对比传统荧光定量PCR判读更为简洁,灵敏度和精确性更高。
本研究根据HPA-3,HPA-15基因组序列SNP突变位点,设计了适用于ddPCR 检测体系的双向引物及MGB 探针,通过Blast 分析及双重探针实验,验证了引物及探针对检测体系的特异性,在确保特异性的同时对引物退火温度(Tm)做了一定的调整,primer express 显示F-HPA-3a、F-HPA-3b的Tm分别为58℃、59℃;F-HPA-15a、F-HPA-15b的Tm分别为54℃、58℃。退火温度梯度实验中,可以看到HPA-3随着温度变化阴性通道的阴性液滴始终呈现单一直线,而HPA-15阴性通道阴性液滴随着温度变化相差较大,提示引物Tm 对于不同HPA ddPCR 检测体影响不同。通过对阳性微滴及阴阳性液滴的分离程度比较,研究确定了ddPCR 检测HPA-3最佳反应条件为Tm 61.6℃,引物浓度为900 nM;HPA-15最佳反应条件为Tm 60.2℃,引物浓度为700 nM。同时实验对微滴生成油的加样量、探针终浓度及循环次数等因素在前期进行了预实验,发现对检测结果没有较大影响。通过对检测体系性能评估,该方法检测下限可达到0.1 copies/μL。对比传统荧光定量PCR,具有更高的灵敏度。当扩增模板浓度为1×103copies/μL时,其所容纳的拷贝数已超出常规检测所需,故本实验将拷贝数检测上限定为1 000 copies/μL。因此,20 μL 检测体系能够检测拷贝数范围为2~20 000 copies。同时,检测体系理论值与实际值平均值之间呈现线性关系,在拷贝数浓度为个位数的情况下,HPA-3及HPA-15的批内变异系数及批间变异系数均<5%,表明检测体系有较好的重复性及稳定性,其结果可信度较高。对吉林长春地区67例临床标本进行HPA-3及HPA-15基因分型,标本中杂合子占比较大,HPA-3a、HPA-3b的基因频率分别为0.537 3、0.462 7,HPA-15a、HPA-15b的基因频率分别为0.522 4、0.477 6,与已有的长春地区及相关文献中的报道基本相符[19-21]。该67 例临床标本分型结果与基因测序结果完全一致,表明本方法的准确率较高。
ddPCR 作为第三代PCR 技术,对反应抑制物有更高的耐受力,在产前诊断具有广泛前景[22-24]。目前胎儿的产前诊断通常使用侵入式采样方法,产生创伤的风险性较大,1997 年Lo 等[25]证实了孕妇外周血中存在胎儿游离DNA,为无创产前检测技术(non-invasive prenatal testing,NIPT)奠定基础。目前国内外已有报道通过ddPCR鉴定胎儿血型[24],但针对胎儿HPA基因分型尚未见报道。
本实验将数字PCR 检测体系与胎母血小板抗原相容性检测结合,初步验证了方法的可行性,同时引入了β-actin和RASSF1A基因作为衡量是否有效提取胎儿游离DNA 的判读,β-actin基因作为甲基化酶BstUI 酶切有效的标志。相较于传统SRY基因,不局限于男性胎儿。同时将已知拷贝数的游离DNA 标本进行倍比稀释,同qPCR 比较对游离DNA检测更为灵敏,对于孕妇妊娠早期筛查,尽早介入治疗有较大意义。当然,本实验检测样本量有限,对长春地区的HPA 基因多态性的研究,以及ddPCR 检测胎母血小板相容性方法的局限性及临床适用性后续将增加检测抗原类型及样本量进一步评估完善。
综上所述,本研究结合微滴式PCR 技术构建了血小板HPA-3,HPA-15基因分型方法,该方法特异性强,灵敏度高,重复性及稳定性较好,能够建立实验室室内及室间的标准化操作,可以推广应用于临床标本检测,能够无创产前诊断胎母HPA-3及HPA-15基因型,可为FNAIT等疾病的早期诊断,筛查以及其余HPA 抗原,输血相关性微嵌合体等检测提供参考技术。
