新型磁性生物炭活化过一硫酸盐降解双酚A
2024-02-02王善鹏崔康平聂贤宝徐正江
王善鹏, 崔康平, 刘 彤, 聂贤宝, 徐正江
(1.合肥工业大学 资源与环境工程学院,安徽 合肥 230009; 2.安徽曙光化工集团有限公司,安徽 安庆 246003)
内分泌干扰物具有引起生物内分泌紊乱的特性,近年来,内分泌干扰物对生态环境和人类健康造成的危害引起人们的广泛关注。双酚A(bisphenol,BPA)是内分泌干扰物中的一种代表性污染物,由于其在聚碳酸酯塑料和环氧树脂合成中具有重要作用[1],造成了BPA广泛存在于各种环境介质中,甚至在人体中[2]。即使在其质量浓度低至ng/L量级的情况下,BPA仍然可以引起生物体突变、产生神经毒性和生殖系统损害[3],因此,探寻有效去除各种水环境中的BPA的方法对于保护人类健康至关重要。
目前,相关研究多是利用吸附[4]、过滤[5]和化学氧化[6]等方法去除水中的BPA。相对来说,以过一硫酸盐(peroxymonosulfate,PMS)为氧化剂的高级氧化技术能够更加高效彻底地降解污染物。此外,基于PMS为氧化剂的高级氧化技术还具有pH值适用范围广、避免产生大量铁泥和稳定性强等优势[6]。PMS的激活方式有很多种,包括热活化、碱活化、紫外活化和过渡金属活化等[7],其中,过渡金属被认为是激活PMS最常用的催化剂。然而传统的过渡金属催化剂对pH值有很高的要求,并且具有较明显的二次污染问题[7]。CuFe2O4作为一个潜在的替代品,因其具有更强的稳定性和重复利用性而被广泛研究[8]。由于单纯的CuFe2O4具有很强的磁性,存在较严重的团聚现象,需要一种合适的载体来解决此问题,从而增强其催化能力。
以农业废弃物或市政污泥为原料,在缺氧条件下通过热解合成的生物炭,具有成本低、来源广泛、制备简单和稳定性高等优势,被广泛应用于各种环境污染的治理[9]。生物炭本身具有良好的吸附性能,可以通过吸附作用去除水中部分有机污染物,同时吸附作用也促进了污染物和活性物质之间的传质作用,因此生物炭常被视为优良的载体,用于和其他材料结合形成新型高效催化剂。此外,以市政污泥为生物质制备的生物炭,其本身就具有活化过硫酸盐、降解污染物的能力。文献[10]以污泥生物炭(sludge-derived biochar,SBC)为催化剂活化PMS去除水中的三氯生,结果表明,在最优条件下,SBC/PMS体系能在2 h内降解100%的三氯生,但是生物炭回收不便、重复利用性较差。本文通过溶胶-凝胶燃烧法制备磁性生物炭CuFe2O4@SBC,通过CuFe2O4的磁性赋予SBC高重复利用性,同时以SBC为载体解决CuFe2O4的团聚问题,从而通过协同作用提高复合材料的催化效果,实现了市政污泥的资源化利用。
1 试验材料与方法
1.1 试验试剂与仪器
试剂:硝酸铁(Fe (NO3)3·9H2O,≥98%)、硝酸铜(Cu (NO3)2·3H2O,≥99.99%)、过硫酸氢钾(KHSO5·0.5KHSO4·0.5K2SO4)(PMS)、双酚A(BPA)、糠醇(FFA,≥98%)、叔丁醇(TBA,≥99%)、乙醇、甲醇,均为分析纯,均购自上海阿拉丁生化科技股份有限公司。
仪器:HH-S1恒温水浴振荡器(江苏金城国胜实验仪器厂);85-2数显恒温磁力搅拌器(江苏金坛市双捷实验仪器厂);SX2-2-10箱式电阻炉(上海跃进医疗器械有限公司);FE20 pH计(梅特勒-托利多仪器(上海)有限公司)。
1.2 SBC的制备
本文中原生物质取自合肥朱砖井污水处理厂压缩污泥。将污泥自然风干48 h,再在60 ℃下烘干12 h;然后,将干燥的污泥磨成细粉末,通过100目筛网过滤,再将过筛后的细粉末放入箱式电阻炉,在300 ℃下热解2 h,热解后得到的SBC储存在样品瓶中。
1.3 CuFe2O4@SBC复合材料的制备
1) 在100 mL超纯水中加入2.42 g硝酸铜、8.08 g硝酸铁和1.2 g SBC,超声10 min使其充分混合。
2) 将混合溶液在60 ℃下恒温搅拌2 h后加入7.57 g C6H8O7·H2O,将混合物继续在60 ℃下搅拌2 h,然后放入真空干燥箱干燥12 h,使水分完全蒸发。
3) 将得到的凝胶转移到陶瓷坩埚中,放入箱式电阻炉在缺氧状态下热解2 h,将所得的黑色固体磨成粉末,用去离子水清洗数次,再将粉末放入烘箱中12 h,得到磁性生物炭CuFe2O4@SBC复合材料。
纯CuFe2O4也按照相同方法制备,但是不投加SBC。
1.4 表征
采用DX-2700 X射线衍射仪对CuFe2O4@SBC复合材料进行X射线衍射(X-ray diffraction,XRD)分析,获取其晶体结构;采用TESCAN MIRA3扫描电子显微镜(scanning electron microscope,SEM)表征其表面形貌;采用Nicolet 5700傅里叶变换红外光谱仪(美国Thermo Nicolet公司)进行傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析,测定其官能团,扫描范围为4 000~500 cm-1;采用ESCALAB 250Xi X射线光电子能谱仪(美国赛默飞世尔科技公司)进行X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)分析,获取其表面组成。
1.5 降解试验
采用批次试验测定CuFe2O4@SBC复合材料活化PMS降解BPA的性能。一般地,在25 ℃条件下,将30 mg催化剂加入含有49 mL初始浓度为0.1 mmol/L的BPA溶液的锥形瓶中,初始pH=6.4,随后加入1 mL浓度为25 mmol/L的PMS储备液,将锥形瓶置于恒温水浴振荡器中以200 r/min振荡1 h。反应期间,每隔10 min用移液枪取1 mL水样,过0.45 μm滤膜后加入含有1 mL甲醇的离心管中终止降解反应,共取6次。随后采用高效液相色谱仪检测水中剩余BPA浓度。通过调节不同的CuFe2O4@SBC投加量、PMS浓度、反应温度和初始溶液pH值,来评估该复合材料活化PMS降解BPA的性能。
在重复利用试验中,利用外加磁场将磁性生物炭CuFe2O4@SBC从反应系统中分离,并用超纯水清洗3次,收集干燥,用于下一轮降解试验。
1.6 自由基淬灭试验
为了探究CuFe2O4@SBC+PMS体系中BPA降解的主要机理,进行自由基淬灭试验来鉴定BPA降解的主要活性物种。
具体方法如下:在向反应体系中投加PMS以启动降解程序之前,预先投加一定浓度的淬灭剂,通过调整淬灭剂的种类和浓度,对比BPA降解受到的抑制程度来分析降解反应的主要活性物种。本文分别采用无水乙醇(EtOH)、叔丁醇(TBA)、糠醇(FFA)和对苯醌(BQ)作为淬灭剂,淬灭剂浓度采用2个梯度,分别为50、250 mmol/L,其他反应条件与典型的降解试验条件一致,即反应温度为25 ℃,初始pH=6.4,CuFe2O4@SBC投加量为0.6 g/L,PMS浓度为0.5 mmol/L;对照组中未添加淬灭剂。
2 试验结果与讨论
2.1 表征
2.1.1 XRD分析
SBC、CuFe2O4和CuFe2O4@SBC的XRD分析结果如图1所示。

图1 SBC、CuFe2O4和CuFe2O4@SBC的XRD分析结果
从图1可以看出:SBC的XRD图谱在21.00°、26.60°处出现2个强烈的衍射峰,这说明SBC的晶体结构属于无定型石墨[2];CuFe2O4和CuFe2O4@SBC在18.51°、30.17°、35.64°、43.04°、57.05°、62.77°处出现特征峰,分别对应尖晶石CuFe2O4(JCPDS No.25-0283)的(111)(220)(311)(400)(511)(440)晶面[11];在CuFe2O4@SBC的XRD图谱中也出现了SBC的无定型石墨特征峰,这充分证明磁性生物炭CuFe2O4@SBC已被成功合成。
2.1.2 SEM分析
本文通过溶胶-凝胶燃烧法合成的复合材料呈层状结构和块状结构共存的形态,并且复合材料表面密集分布着许多CuFe2O4颗粒,如图2所示。由图2可知,CuFe2O4成功负载在SBC上。复合材料表面粗糙并呈现出分离的带有空隙的颗粒团簇,这可能暴露出更多激活PMS的反应位点。

图2 CuFe2O4@SBC复合材料SEM图像
2.1.3 FTIR分析
纯SBC、纯CuFe2O4、反应前CuFe2O4@SBC和反应后CuFe2O4@SBC的FTIR谱图如图3所示。从图3可以看出:在约480、570 cm-1处出现2个峰,分别对应尖晶石结构中八面体配位化合物中的Cu—O键和四面体配位化合物Fe—O键的伸缩振动[12-13],这些特征峰的存在证明了Fe3+和Cu2+在尖晶石结构的四面体位和八面体位中的存在[14];1 035 cm-1处的吸收峰可能与表面官能团C—O—C有关[15],而在1 617 cm-1处的峰来自生物质中柠檬酸和芳香环的C=O和C=C键拉伸[16-17],所有样品在3 420、2 342 cm-1处明显的吸收峰分别对应O—H在H2O背景下和O=C=O在空气背景下的伸缩振动;反应前后CuFe2O4@SBC的FTIR图谱基本没有变化,说明复合材料具有很强的稳定性。

图3 SBC、CuFe2O4及反应前后CuFe2O4@SBC的FTIR谱图
2.1.4 XPS分析
为了进一步探究在CuFe2O4@SBC+PMS体系中催化机理与催化剂表面组成之间的关系,下面对比分析CuFe2O4@SBC在BPA降解前后的XPS谱图。在CuFe2O4@SBC的XPS全谱中发现C 1s、O 1s、Fe 2p和Cu 2p的存在,如图4所示。

图4 反应前后CuFe2O4@SBC的XPS全谱图
此外,复合材料反应前后Fe与Cu的原子数比均接近2∶1,见表1所列。
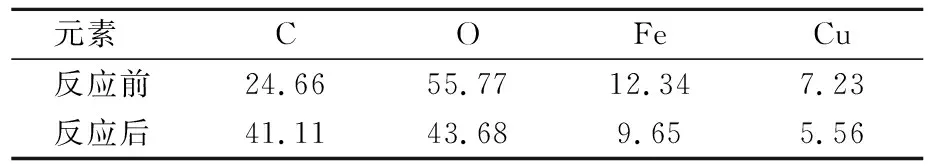
表1 CuFe2O4@SBC反应前后各元素原子数比 %
上述结果一方面证实了CuFe2O4@SBC复合材料的成功制备,另一方面说明复合材料具有优良的稳定性。
反应前、后CuFe2O4@SBC的Cu 2p、Fe 2p和C 1s XPS谱图如图5所示。

图5 反应前、后CuFe2O4@SBC的Cu 2p、Fe 2p和C 1s XPS谱图
从图5a可以看出,CuFe2O4@SBC复合材料的Cu 2p谱图出现Cu(Ⅱ)、Cu(Ⅰ)所引起的信号峰。通过对比反应前后的结合能可知,反应后Cu(Ⅱ)的结合能从反应前的934.060 eV增加到934.862 eV;对比它们各自的峰面积可知,降解后复合材料表面出现一定含量的Cu(Ⅰ),这是降解前不存在的,可能是由于CuFe2O4@SBC中的Cu(Ⅱ)参与PMS的活化,并且一部分Cu(Ⅱ)被还原为Cu(Ⅰ)。
从图5b可以看出:在复合材料Fe 2p谱图的711.51、724.64 eV处出现2个信号峰,分别对应Fe 2p3/2、Fe 2p1/2;在降解完成后,Fe(Ⅲ)和Fe(Ⅱ)的信号峰由于Fe价态的转变而向更高的结合能偏移。
上述结果表明,Fe(Ⅲ)/Fe(Ⅱ)和Cu(Ⅱ)/Cu(Ⅰ)氧化还原对参与了PMS的活化过程。
从图5c可以看出,复合材料C 1s中的信号峰可被分解为3个峰,结合能分别位于284.69、285.715、288.373 eV处,这3个峰分别对应复合材料表面的C—C、C—O和C=O,此结果与CuFe2O4@SBC复合材料的FTIR检测结果正好吻合。文献[18]研究发现,C=O可以促进PMS的自分解,产生单线态氧,从而去除水中的污染物。对比反应前后的C 1s谱图可知,反应后复合材料的C=O含量有所下降,这可能是由于在活化PMS过程中C=O参与了反应。
2.2 降解试验
2.2.1 伪一级动力学模型
为了更直观地描述降解速率,采用伪一级动力学模型对降解过程进行拟合,即
ln(c/c0)=-kt
(1)
其中:c为BPA的实时浓度;c0为BPA的初始浓度;k为伪一级动力学反应速率常数;t为反应时间。
BPA降解率η的计算公式为:
η=[(c0-c)/c]×100%
(2)
2.2.2 不同体系的降解效果
为了研究和评价CuFe2O4@SBC复合材料对BPA的降解性能,在相同条件下(反应温度25 ℃,BPA初始浓度为0.1 mmol/L,初始pH=6.4),分别使用纯SBC、纯CuFe2O4和CuFe2O4@SBC作为催化剂进行对比试验,BPA在6种体系中的降解曲线如图6所示。由图6可知:在不添加PMS的体系中,0.5 g/L的纯SBC、纯CuFe2O4和纯CuFe2O4@SBC对BPA的降解率分别为16%、5%、13%;当0.5 mmol/L PMS加入锥形瓶中时,CuFe2O4@SBC+PMS体系对BPA的降解率在60 min内可以达到97.55%;而采用相同用量的纯SBC和纯CuFe2O4替代CuFe2O4@SBC作为催化剂时,对BPA的降解率分别仅为65.72%、63.96%。

图6 BPA在6种体系中的降解曲线
上述结果表明,CuFe2O4@SBC复合材料具有更强的PMS活化能力。造成此现象的原因可能是:① 复合材料对BPA的吸附提高了活性自由基与底物之间的传质效率;② SBC作为载体使得CuFe2O4能够均匀分布在SBC表面上,很好地抑制了磁性CuFe2O4纳米粒子的团聚现象,从而提供更多的活性位点。
2.2.3 不同反应参数对降解效果的影响
CuFe2O4@SBC投加量、PMS浓度、反应温度和初始溶液pH值对于BPA降解效果的影响分别如图7~图10所示。
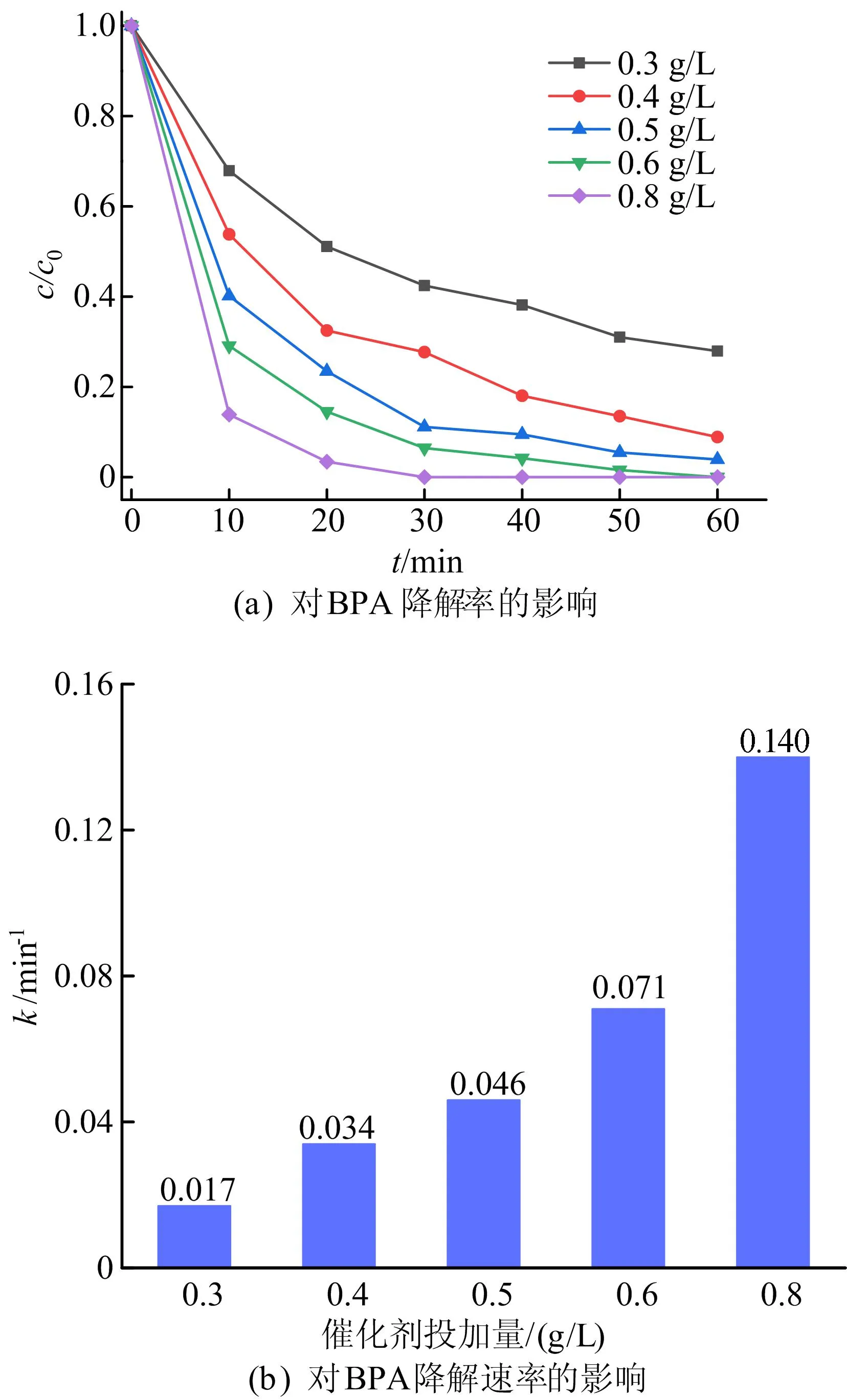
图7 CuFe2O4@SBC投加量对BPA降解效果的影响
由图7可知:随着CuFe2O4@SBC投加量从0.3 g/L增加到0.6 g/L, BPA降解率从72.08%增加到100%;同时反应速率常数k也从0.017 min-1增加到0.071 min-1;进一步将CuFe2O4@SBC投加量提高到0.8 g/L, 水中的BPA在30 min内被完全降解,而k值继续增加到0.140 min-1。上述结果表明,随着催化剂投加量增加,PMS活性位点增加,这有利于提高催化体系的催化效率和能力。考虑到经济成本和环境效益,在后续试验中催化剂的投加量均采用0.6 g/L。
由图8可知:当催化剂投加量为0.6 g/L,PMS浓度分别为0.1、0.2、0.5 mmol/L时,BPA的降解率分别为48.84%、81.24%、100%,对应的k分别为0.005、0.008、0.071 min-1;当PMS浓度进一步提高到1.0 mmol/L时,BPA降解率和k并没有明显提高,这可能是由于0.6 g/L的催化剂投加量能够提供的活性位点有限。
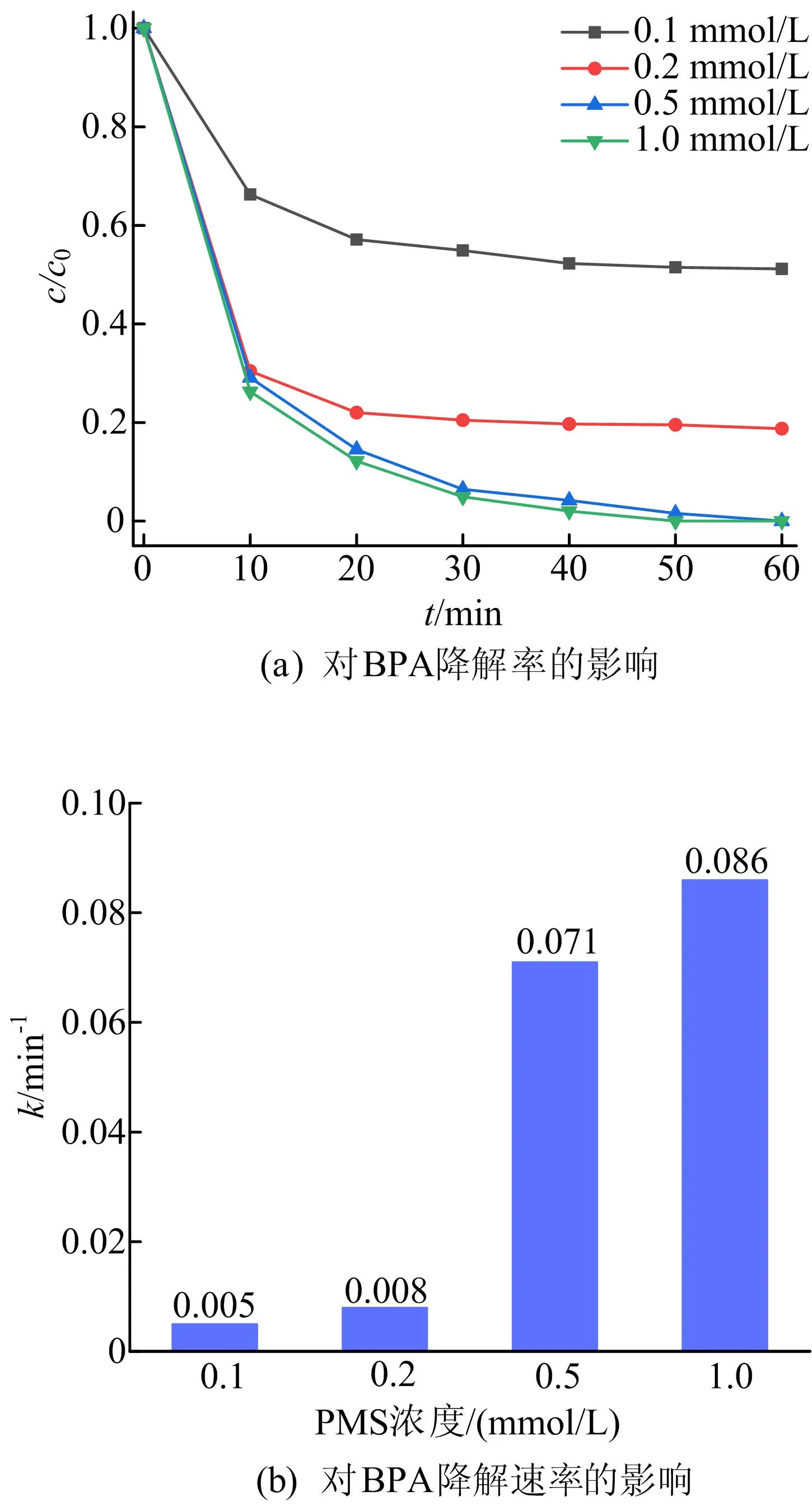
图8 PMS浓度对BPA降解效果的影响
由图9可知:当反应温度从25 ℃降至15 ℃时,60 min内BPA降解率从100%降至88.17%,k从0.071 min-1降至0.035 min-1;当温度升高到35、45 ℃时,BPA降解率能够在20 min内达到100%,k值分别达到0.156、0.178 min-1。上述结果表明,CuFe2O4@SBC+PMS体系对BPA的降解率随着反应温度提高而增加。这种现象出现的原因有2个:① 温度升高会给反应体系提供更多的能量,相当于添加了热活化途径来促进PMS的激活;② 反应温度提高会增强分子间的有效碰撞,从而增加污染物的降解率。值得注意的是,高温会带来额外能量的消耗,不利于处理系统及环境的可持续发展。

图9 温度对BPA降解效果的影响
由图10可知:当初始pH值分别为5、7、9时,对应的BPA降解效率相近;当pH=3时,BPA在60 min内降解率降低到82.33%,降解速率最低;当pH=11时,BPA降解率在30 min内达到100%,降解速率最高。pH=3时BPA降解速率较低可能是由于PMS在酸性条件下的稳定性较高[19];并且在酸性条件下,PMS的第二酸解离常数为9.4,因此H2SO5取代HSO5-成为主导物质,从而抑制硫酸根自由基的产生[20]。在碱性条件下,由于金属—OH—HSO5-配合物的形成,HSO5-的S—O键被削弱,从而促进了HSO5-的分解[21]。此外,PMS还能够被碱激活,产生硫酸盐自由基和羟基自由基来降解BPA[7]。
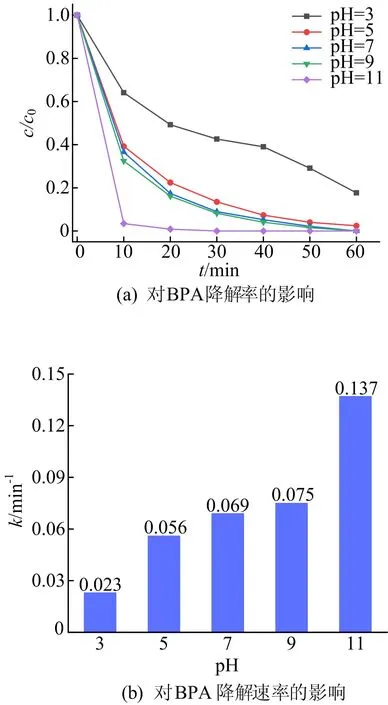
图10 pH值对BPA降解效果的影响
2.2.4 可重复利用性试验
评价一种催化剂是否能够大规模应用于实际废水处理中的一个关键因素,是其是否具有优良的重复使用性和稳定性。本文以60 min作为1个反应周期,对磁性生物炭CuFe2O4@SBC进行3个周期的催化PMS降解BPA测试,结果如图11所示。由图11可知,第1轮、第2轮和第3轮的BPA降解率分别为100%、96%、91%。此结果表明,该催化剂在重复利用性测试中保持了良好的催化活性,在实际废水处理中具有较好的应用前景。
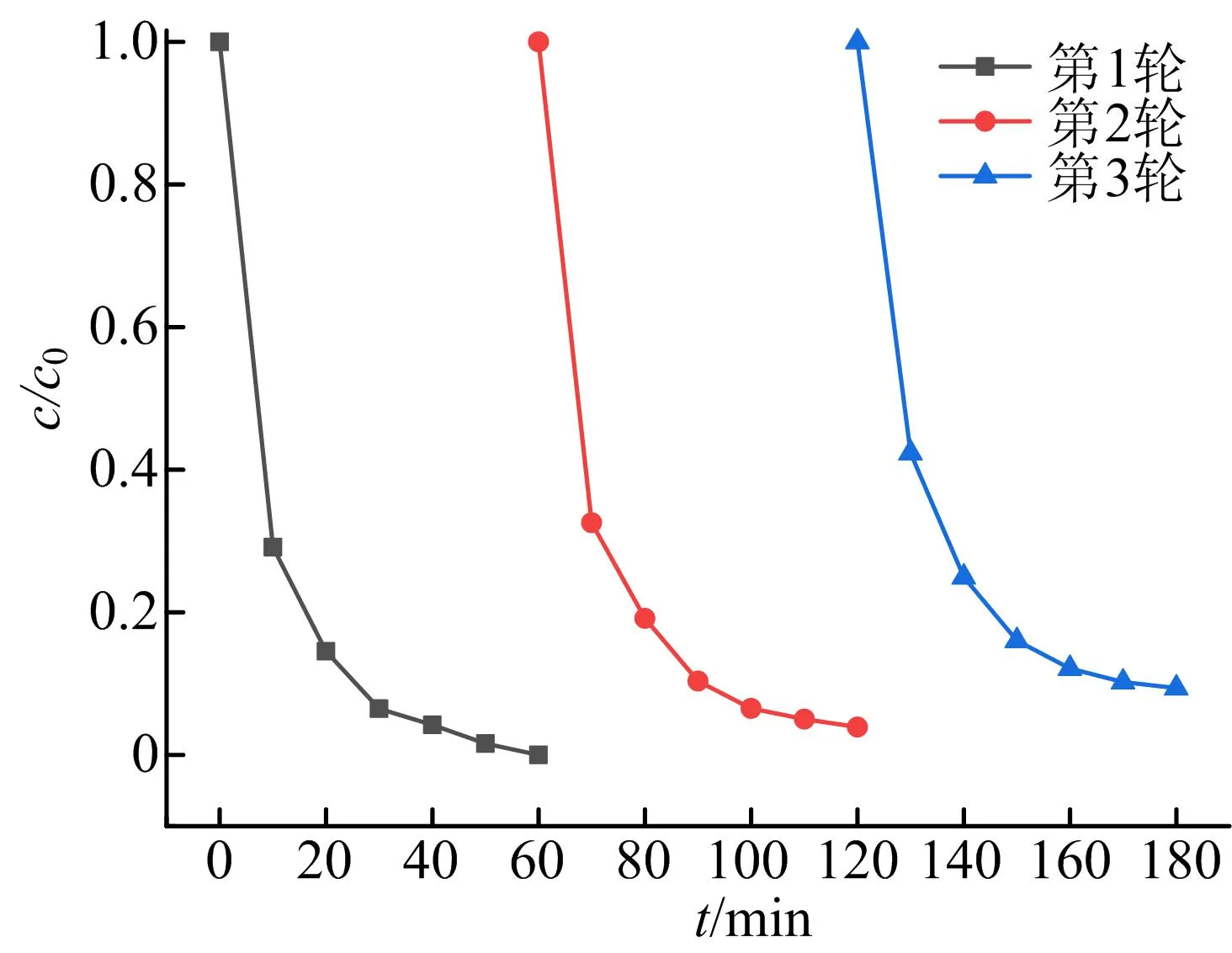
图11 CuFe2O4@SBC重复利用性试验曲线
2.2.5 自由基淬灭试验
由于EtOH对·OH和SO4-·都有较高的反应速率,经常被用于同时淬灭水中的·OH和SO4-·,而TBA经常用于单独淬灭水中的·OH,不淬灭SO4-·[22]。考虑到FFA和BQ分别与1O2、O2-·具有高反应速率,FFA和BQ分别被用作1O2、O2-·的淬灭剂[23]。4种淬灭剂对CuFe2O4@SBC+PMS体系降解BPA的影响如图12所示。

图12 淬灭剂对CuFe2O4@SBC+PMS体系降解BPA的影响
由图12可知,当体系中存在淬灭剂时,BPA的降解受到一定的抑制。
从图12a可以看出:随着反应体系中cEtOH∶cPMS从100∶1增加到500∶1,EtOH对BPA降解的抑制作用增强,60 min内BPA降解率从87%降至74%;当反应体系中cTBA∶cPMS从100∶1增加到500∶1时,60 min内BPA降解率从91%降至84%。通过比较EtOH和TBA对BPA降解抑制作用的差异可以发现,同样浓度的EtOH和TBA都能产生抑制作用,但是前者的抑制作用大于后者,因此可以推测·OH和SO4-·都对BPA的降解作出贡献,但是前者的作用相对更大。此外,当反应体系中cEtOH∶cPMS达到500∶1时,BPA的降解率仍然能在60 min达到74%,这说明CuFe2O4@SBC+PMS体系中的主导活性物种既不是·OH也不是SO4-·,还需要进一步探究。从图12b可以看出:当FFA加入反应体系后,BPA的降解几乎被完全抑制;而当cBQ从0增加到0.5、5.0 mmol/L时,BPA降解率分别降低到86%、52%。
上述结果表明,在CuFe2O4@SBC活化PMS降解BPA的体系中,1O2是最大贡献者,同时,·OH、SO4-·和O2-·的参与也对BPA的降解发挥重要作用。
3 结 论
本文以市政污泥为生物质原料,利用溶胶-凝胶燃烧法制备磁性生物炭CuFe2O4@SBC复合材料,并通过XRD分析证明了复合材料的成功制备。通过分析SEM图像和FTIR谱图发现,CuFe2O4均匀地负载在SBC表面,并且复合材料含有丰富的含氧官能团,这有助于提高其对PMS的活化效果。XPS谱图分析结果表明,Fe(Ⅲ)/Fe(Ⅱ)和Cu(Ⅱ)/Cu(Ⅰ)氧化还原对可能在PMS活化中起到非常关键的作用。
通过降解试验发现,与纯CuFe2O4和纯SBC相比,CuFe2O4@SBC复合材料具有更高的催化活性和稳定性,且在第3轮循环试验中在60 min内对BPA的降解率仍能达到91%。降解动力学结果表明,随着CuFe2O4@SBC投加量、PMS浓度和反应温度的增加,BPA的降解率和降解速率都有所增加。通过淬灭试验发现,1O2是CuFe2O4@SBC活化PMS降解BPA的主要活性物种,同时·OH、SO4-·和O2-·也参与了BPA的降解。此外,还发现CuFe2O4@SBC+PMS体系具有较宽的pH值适用范围,能够在pH值为3~11范围内有效降解BPA。因此,CuFe2O4@SBC复合材料在实际的废水处理中具有较好的应用前景。
