微生物菌剂与氮肥配施对紫花苜蓿生长及土壤性质的影响
2024-02-01李青璞白建海付卫刚
李青璞,白建海,姚 拓*,雷 杨,周 泽,张 琛,付卫刚
(1. 甘肃农业大学草业学院/草业生态系统教育部重点实验室,甘肃 兰州 730070;2. 甘肃欣海牧草饲料科技有限公司,甘肃 兰州 730070)
紫花苜蓿(MedicagosativaL.)作为重要的豆科牧草,不仅具有广泛适应性、极高的饲用及经济价值[1],而且由于其独特的氮利用方式,能够固氮改土,也发挥出了较高的生态价值。此外与禾谷类牧草相比,紫花苜蓿的蛋白质含量较高。因此种植紫花苜蓿人工草地是解决畜牧业发展中蛋白饲料资源短缺的重要途径和有效方法。我国苜蓿种植区域主要集中在北方地区,如甘肃、宁夏、内蒙古等地是我国苜蓿牧草的主产区[2]。甘肃河西地区作为我国西北地区紫花苜蓿优势主产区,但因其地处内陆,常年降雨稀少,制约了牧草生产和发展,同时该地区土壤养分匮乏,部分地区的种植户和种植企业为了提高紫花苜蓿牧草产量,施用了大量化肥[3]。有研究表明,施肥可提高苜蓿粗蛋白含量,降低中性和酸性洗涤纤维含量,提高相对饲喂价值[4],但持续施用化肥并不能带来持续增产,相反会造成资源浪费,土壤质量降低等问题[5]。因此,这种经验施肥不仅提高了生产成本也浪费了肥料,而利用微生物菌剂与化肥搭配施用可以减少化肥用量,节约成本。
近年来,微生物菌剂的研究与应用有了很大的突破,其中以植物根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR)为主要成分研制的新型PGPR菌肥已成为国内外化肥替代物研究的热点之一[6]。微生物菌剂是将有益的活性菌经过特殊的加工,制成便于使用的生物制剂或活菌制剂[7],具有改善作物营养状况、调节植物的生长,提高土壤酶活性以及提升肥料利用率等功能,是提高作物产量和品质、促进农业可持续发展的重要途径之一[8]。目前有关微生物菌剂与氮肥减量配施在设施作物领域研究较多,而对微生物菌剂与氮肥减量配施对紫花苜蓿生产和紫花苜蓿地土壤肥力的影响研究较少。基于此,本试验在甘肃河西地区进行,研究微生物菌剂与氮肥减量配施对苜蓿草地生产力及土壤肥力特征的影响,以达到减少氮肥用量的同时促进植物生长发育及提高土壤肥力特性,为河西地区牧草生产提供科学合理的施肥量。
1 材料与方法
1.1 供试材料
供试材料为‘惊盛’紫花苜蓿,由甘肃欣海牧草科技有限公司提供;供试菌株(表1)来源于甘肃农业大学草业学院草地微生物实验室。

表1 供试菌株Table 1 Strains for test
1.2 试验设计
1.2.1试验区概况 试验地位于甘肃省武威市民勤县(甘肃欣海牧草科技有限公司,103°35′E,39°08′N),属温带大陆性干旱荒漠气候,平均海拔1 400 m,年平均气温8.8℃,年平均降水量为115 mm,年蒸发量2 646 mm;该地区太阳辐射强,光照充足;无霜期较短,极端最低气温-29.5℃,极端最高气温41.7℃,昼夜温差大。土壤类型为灌漠土,土壤质地偏砂,pH值8.28,盐分含量0.41%,有机质含量0.4%,全氮含量0.52 g·kg-1,全磷含量0.44 g·kg-1。
1.2.2试验设计 氮肥减量配施试验于2022年8月第一茬紫花苜蓿收割后施入。全量氮肥施用量为150 kg·hm-2,所用氮肥为尿素(含N 46%)。采用大田小区试验,设置7个施肥水平,如表2所示,每处理3个重复,共设21个小区。试验小区面积为5 m×4 m=20(m2),为减少试验误差,各小区之间以1 m的小田埂将其隔开。其中根瘤菌剂(GAU-123)施用量为4.5 L·hm-2,促生菌剂为一株根瘤菌和两株芽孢杆菌的组合(GAU-123+Y1+Y3),施用量为根瘤菌2.25 L·hm-2、两株芽孢杆菌分别为1.125 L·hm-2,播种前按上述用量拌种。试验田于2022年5月建植,人工条播,播种量为18 kg·hm-2,播种行距为30 cm,播种深度为2 cm,田间管理除施肥外,其他灌溉、除草、病虫害防治等按照当地高产苜蓿田统一进行管理。

表2 试验处理Table 2 Test treatments
1.2.3菌剂制备 Y1、Y3采用LB液体培养基(10 g·L-1NaCl、10 g·L-1胰蛋白胨和 5 g·L-1酵母粉,将pH调节为7.0),GAU-123采用YMA液体培养基(甘露醇10 g·L-1、酵母粉3 g·L-1,Mg SO40.2 g·L-1,NaCl 0.1 g·L-1,K2HPO40.25 g·L-1,KH2PO40.25 g·L-1),进行培养。以上液体培养基均用立式压力蒸汽灭菌锅在 121℃下对培养基灭菌 20 min;冷却后,在超净工作台上加入菌液,每100 mL的LB液体培养基分别添加100 μL的母液;在28℃,150 r·min-1条件下的恒温培养摇床培养48 h后,使用紫外可见分光光度计测定菌液浓度,调节浓度一致[9-10],三种菌株均OD600 ≥0.5,通过平板涂布,计算后活菌数均约为108CFU·mL-1。
1.3 测定指标及方法
在紫花苜蓿初花期测定其株高,每个小区选取10株长势相近的植株,用卷尺测植物基部到顶端的长度,精确到0.1 cm;在紫花苜蓿初花期,每个小区分别取1 m × 1 m的样方刈割测产,留茬5 cm,刈割后立即称其鲜重,选取300 g鲜草带回实验室于烘箱内105℃杀青30 min,后调至65℃烘至恒重,计算干鲜比,换算为单位面积干草产量;将用于测定产量的草样粉碎备用。土壤样品于初花期(2022年10月9日)紫花苜蓿刈割后采集,利用铁锹挖出完整的苜蓿根,抖落根系大块土壤板结,收集附于根上0~5 mm的土壤。参考《饲料分析及饲料质量检测技术》测定粗蛋白(Crude protein,CP)、粗脂肪(Ether extract,EE)、中性洗涤纤维(Neutral detergent fiber,NDF)和酸性洗涤纤维(Acid detergent fiber,ADF)含量[11],并计算饲草相对饲喂价值(Relative feed value,RFV)[12];土壤全量养分等参照《土壤农化分析》[13]测定;采用苏州格锐思生物科技有限公司试剂盒测定土壤过氧化氢酶、土壤脲酶、土壤蔗糖酶、土壤碱性磷酸酶活性。
1.4 数据分析
采用Excel 2019对数据进行整理,利用SPSS 26.0统计软件进行方差分析,对不同施肥处理下的植株株高、生物量、土壤理化性质、土壤酶活性采用单因素方差分析(One-way ANOVA),显著水平为P<0.05,用Origin 2021绘制图表。
利用模糊数学隶属函数法计算各处理所选指标的隶属函数值,并将所选指标隶属函数值求和,再取均值,以均值大小进行排名,均值越大,排名越靠前。隶属函数计算公式[14]:
R(Xi)=(Xi-Xmin)/(Xmax-Xmin)
(1)
R(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
(2)
式中,R(Xi)表示某指标隶属函数值,Xi表示该指标的测定值;Xmax表示该指标最大值;Xmin表示该指标最小值。若测定指标与牧草的营养价值呈正相关关系,则用式(1)计算;若呈负相关关系,则用式(2)计算。
2 结果与分析
2.1 微生物菌剂与氮肥配施对紫花苜蓿株高和产量的影响
不同施肥处理下,紫花苜蓿株高和干草产量如图1所示。各个施肥处理之间紫花苜蓿株高无显著差异,株高范围在55.1~60.1 cm之间,其中C7,G7,G6处理下紫花苜蓿株高与其他处理相比较低;与CK相比,接种微生物菌剂和氮肥减量处理下的紫花苜蓿干草产量无显著差异。
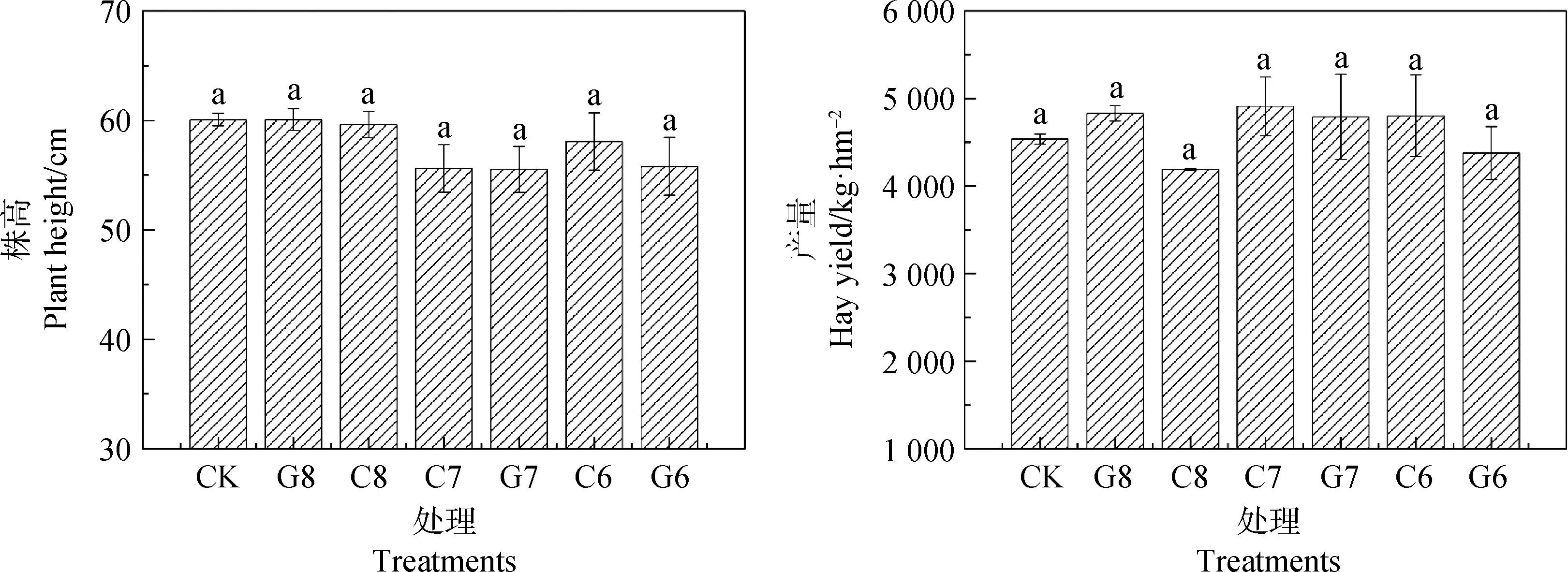
图1 不同施肥处理的紫花苜蓿产量和株高Fig.1 Yield and plant height of alfalfa under different fertilization treatments注:误差线为标准误。不同小写字母表示差异显著(P<0.05),下图同Note:The error line is standard error. Different lowercase letters indicate distinct differences,the same as below
2.2 微生物菌剂与氮肥配施对紫花苜蓿营养品质的影响
不同施肥处理下紫花苜蓿营养品质和相对饲用价值如表3所示。粗蛋白和粗脂肪含量表现为随施氮量减少而下降的趋势,其中C6,G6处理下的粗蛋白均显著低于其他处理(P<0.05),G7处理下的粗蛋白含量为17.01%,较高于其他施肥处理;G6处理下的粗脂肪含量则显著低于其他施肥处理(P<0.05),其中性洗涤纤维和酸性洗涤纤维显著高于其他施肥处理(P<0.05);通过计算相对饲用价值发现,CK,G8,C7,G7处理下的相对饲用价值显著高于C6,G6处理(P<0.05),其中CK处理的相对饲用价值最高,达到200.95,C7次之为193.54。

表3 不同施肥处理的紫花苜蓿营养品质和相对饲用价值Table 3 Nutritional quality and relative feeding value of alfalfa under different fertilization treatments
2.3 微生物菌剂与氮肥配施对土壤理化性质的影响
不同施肥处理下土壤理化性质如图2所示。不同施肥处理对土壤速效磷含量无显著影响;与CK相比,C8处理显著增加了土壤硝态氮含量,达到2.14 mg·kg-1(P<0.05),其余接种和施氮处理无显著差异,除G6处理外,其余各接种和施氮处理的土壤铵态氮含量显著高于CK(P<0.05),其中G8处理下的土壤铵态氮含量最高,达到 0.57 mg·kg-1;不同施肥处理间的土壤速效磷、有机质、含水率和pH值与CK相比无显著差异;接种促生菌与氮肥减量40%降低了土壤全氮含量;与CK相比各处理间的土壤电导率差异显著(P<0.05),其中G8,C6处理下土壤电导率低于其他处理。
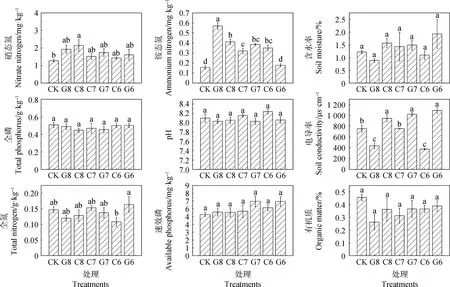
图2 不同施肥处理的土壤理化性质Fig.2 Soil physicochemical properties under different fertilization treatments
2.4 微生物菌剂与氮肥配施对土壤酶活的影响
不同施肥处理下土壤酶活性如图3所示。各施肥处理间的土壤过氧化氢酶和蔗糖酶活性无显著差异,与CK相比,各接种微生物菌剂与氮肥减量处理的土壤过氧化氢酶活性均有所升高,升高范围在5.59%~14.98%;C8,G7处理下的土壤碱性磷酸酶活性显著高于其他处理,较CK提高了19.48%和44.70%(P<0.05);各接种微生物菌剂与氮肥减量处理的土壤脲酶活性均显著低于CK,降低范围在9.76%~76.36%(P<0.05)。

图3 不同施肥处理的土壤酶活性Fig.3 Soil enzyme activities under different fertilization treatments
2.5 紫花苜蓿生长和营养品质与土壤理化性质相关性分析
如图4所示,苜蓿粗蛋白、粗脂肪与相对饲用价值极显著正相关(P<0.01),苜蓿中性洗涤纤维、酸性洗涤纤维与相对饲用价值极显著负相关(P<0.01),苜蓿粗蛋白、粗脂肪与中性洗涤纤维、酸性洗涤纤维极显著负相关(P<0.01);土壤碱性磷酸酶与土壤脲酶极显著正相关(P<0.01),土壤含水率与土壤速效磷、土壤电导率极显著正相关(P<0.01),土壤碱性磷酸酶与酸性洗涤纤维极显著负相关(P<0.01)。
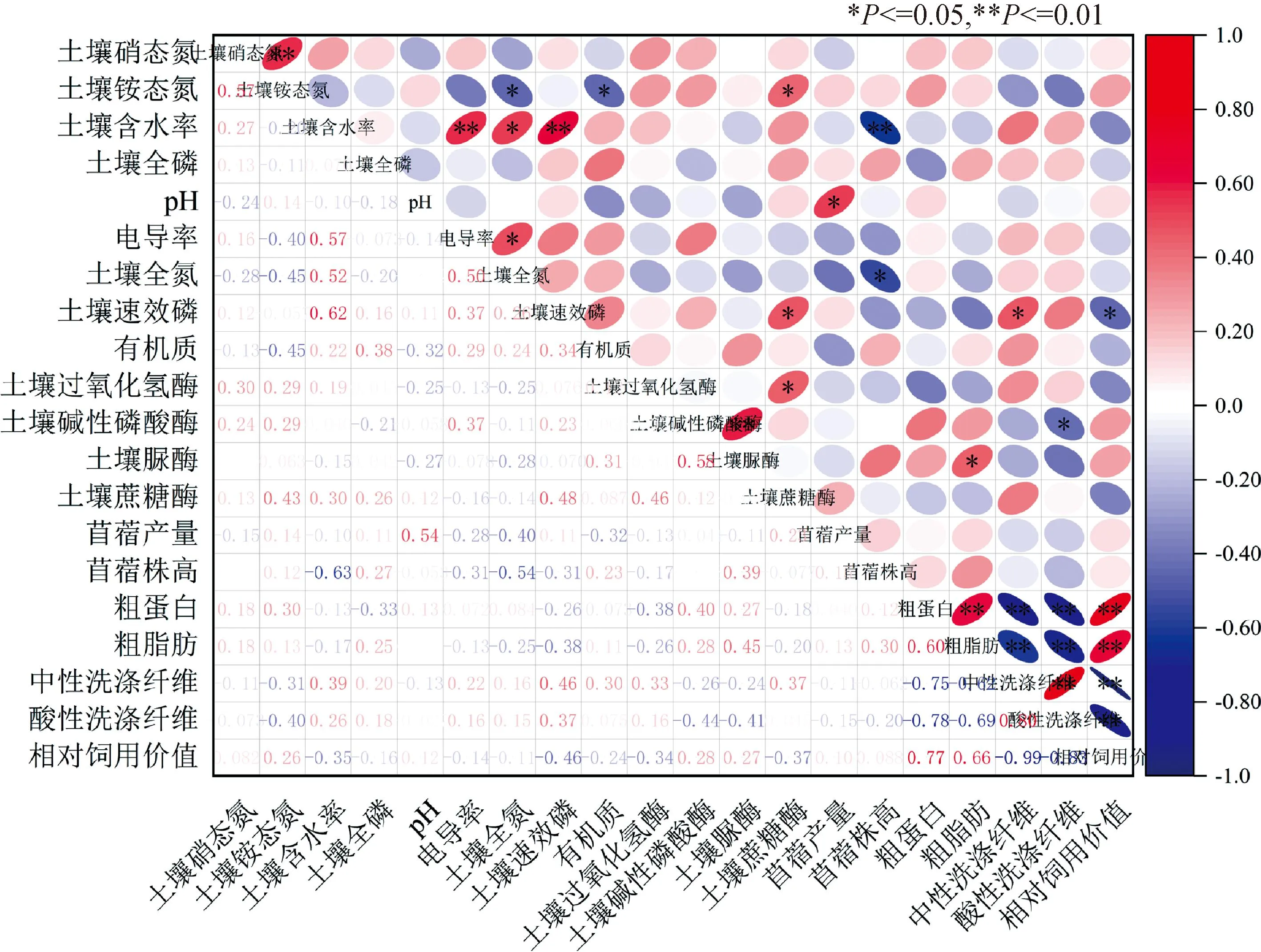
图4 各指标间的相关性分析Fig.4 Correlation analysis between indicators注:*和**分别表示在0.05和0.01水平上的差异显著Note:* and ** indicate significant differences at the 0.05 and 0.01 levels respectively
2.6 隶属函数综合分析
采用模糊数学隶属函数法对不同施肥处理的紫花苜蓿生长营养指标和土壤指标进行分析,结果表明(表4),在所有处理中,G7处理表现最好,平均隶属函数值为0.59,其次为G8处理,平均隶属函数值为0.53,C7处理平均隶属函数值小于0.42,综合表现较差。

表4 不同施肥处理的综合评价Table 4 Comprehensive evaluation under different fertilization treatments
3 讨论
3.1 微生物菌剂与氮肥配施对紫花苜蓿生长及营养品质的影响
研究表明氮肥是限制牧草生产的重要因素之一,施用氮肥可以有效提高牧草的产量[15]。目前关于苜蓿在种植过程中是否需要添加额外的氮肥以及氮肥施用量的大小来提高紫花苜蓿的干草产量这一关键问题上仍存在不同观点,部分观点认为苜蓿可以与根瘤菌共生固氮以满足苜蓿生长的需要,因此,氮肥的添加并不会对苜蓿的生长有促进作用[16],另一部分观点认为在苜蓿生长初期及衰老期苜蓿根瘤菌固氮酶活性较弱,添加外源氮可以提高苜蓿的干物质产量[17]。由微生物菌剂制作成的菌肥来替代部分化肥是实现化肥减量的重要技术途径之一,近年来在农业中的应用也备受重视[18]。本研究中,接种微生物菌剂与氮肥减量处理下的紫花苜蓿株高和产量与CK相比无显著差异,说明接种微生物菌剂替代部分氮肥未降低紫花苜蓿产量。因此在首年建植的苜蓿田中可以有效减少氮肥施用量从而增加经济效益。施用微生物菌剂可以改善土壤结构,促进植株根系生长,从而促进植株地上部的生长能力,同时减少化肥使用量。韩华雯等[19]研究发现,复合菌种接种剂+半量磷肥处理的苜蓿生长效果最佳,其苜蓿株高和产量分别较对照增加9.00%和11.98%;刘青海[20]的研究表明,混合接种菌剂处理促生效果更好,其中Jm92+Lx22+S11+G处理下的地上植物量较对照提高121.21%,极大的提高了苜蓿地上生物量。
牧草的粗蛋白、粗脂肪含量、NDF和ADF含量是评价优质饲草的重要指标,而这与科学合理的施肥息息相关。研究表明,施用氮肥显著提高了牧草的粗蛋白含量[21],有效降低紫花苜蓿的NDF和ADF含量,改善牧草品质[22],利用复合菌剂处理替代半量化肥,紫花苜蓿的干草产量、粗蛋白和粗脂肪含量分别较CK提高10.6%,16.4%和 4.2%[23]。本研究中,当接种微生物菌剂与氮肥减量20%和30%时,未降低紫花苜蓿的粗蛋白、粗脂肪、中性洗涤纤维、酸性洗涤纤维含量和相对饲用价值,接种微生物菌剂与氮肥减量40%时,其上述营养指标均显著降低,说明接种微生物菌剂可以替代20%~30%的氮肥施用量而不降低紫花苜蓿的营养品质。王瑞峰等[24]通过添加根瘤菌和不同施氮量发现,中等施肥水平及接种根瘤菌可显著提高苜蓿地上生物量,且接种根瘤菌可降低苜蓿茎叶中纤维素的含量。
3.2 微生物菌剂与氮肥配施对土壤理化性质与土壤酶活性的影响
土壤理化性质是影响土壤肥力的重要因素,同时综合反映了土壤质量水平[25],也可表征土壤生产能力的大小。土壤可被植物吸收利用的无机氮素包括硝态氮和铵态氮两种形式,因此常被作为土壤氮素供应水平的重要指标[26]。本研究结果显示,与CK相比接种微生物菌剂与氮肥减量处理未降低土壤中铵态氮和硝态氮含量,且在C8处理下的硝态氮含量显著高于CK,铵态氮含量除G6处理外,其他处理均高于CK,且不同施肥处理的土壤速效磷含量无显著差异。这表明接种微生物菌剂对提高土壤中有效性氮含量有一定作用。有研究表明施44 kg·hm-2氮肥能增加0~15 cm土层的全氮含量,而对15 cm以下土层的全氮含量没有影响,且每茬刈割后施氮肥不会造成苜蓿地下硝态氮的积累[27]。土壤有机质的数量和质量决定了土壤质量的好坏除为植物提供不同养分外,还可以反映土壤的肥力[28]。本研究中,与CK相比,接种微生物菌剂与氮肥减量处理的土壤有机质含量差异不显著,表明氮肥减量未降低土壤有机质含量,这可能是由于施用微生物菌剂后增加了土壤中有益微生物的数量,提高了土壤质量。土壤养分的有效性受土壤pH值的干扰,且植物根系对养分的吸收也会受此影响,相关研究表明,土壤中氮的施入会加速土壤的酸化,因为土壤中的淋溶、硝化作用以及植物对阴阳离子的吸收不均衡都有可能造成土壤酸化[29-30]。此外,施用生物菌肥也可能导致土壤pH值下降,土壤中的微生物菌群在分解有机物的过程中产生的酸类物质和呼吸放出的二氧化碳与水形成的碳酸在土壤中积累可能会造成土壤pH值降低[31]。
土壤酶活性被认为是土壤肥力的一种传感器,它们直接参与土壤中物质的转化以及养分的释放和固定,并且与土壤养分的供应密切相关,土壤酶活性水平反映了土壤中的微生物活性和生化反应,通常被用作反映微生物活性和土壤肥力的指标。本研究表明,紫花苜蓿根际土壤脲酶和碱性磷酸酶活性具有相关性,主要是因为土壤碱性磷酸酶和脲酶是土壤中的重要成分,其活性与土壤磷和氮的代谢密切相关[32],氮肥减量处理下的土壤脲酶活性低于CK,而C8,G7处理下的土壤碱性磷酸酶活性高于CK,这可能是由于微生物对施氮反应不同所致,氮的添加可以通过抑制终产物或微生物同化形成的产物增加土壤中产脲酶微生物的数量[33],施氮增强了土壤脲酶活性,同时减少土壤中氮限制,从而增加微生物数量来改善紫花苜蓿地下部生长状况,促进紫花苜蓿生长[34]。Chibeba等[35]通过慢生根瘤菌单接种和根瘤菌与固氮螺旋菌共接种试验,发现共接种并没有增加籽粒产量,因此需要进一步研究有效的共接种菌种来探究多功能菌种共接种在生产上的限制因素;黄秋良等[36]研究了褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌不同接种量组合对芳樟生长的影响,发现不同接种量会影响接种效果;赵宇宾等[37]研究发现,胶质芽孢杆菌与阿氏芽孢杆菌分别接种都具有良好的促生效果,但混合接种却没有取得更高的共生固氮效率。本研究中促生菌和根瘤菌共接种且减氮30%的处理效果并没有高于单接根瘤菌且减氮30%处理,可能是由于菌剂配比,菌间代谢物的互相影响所致,此外土壤作为一个复杂的生态体系,微生物功效的发挥也取决于它的数量、与土著微生物的竞争力以及土壤有机质等含量的高低[38],且豆科植物根系中可以分离出根瘤菌,因此添加根瘤菌剂可能在豆科植物根系定殖较为容易。
4 结论
与施用全量氮肥相比,接种微生物菌剂与氮肥减量20%~30%处理未降低紫花苜蓿的株高、干草产量和营养品质,且通过对不同施肥处理的紫花苜蓿生长、营养和土壤指标的综合分析,综合表现最好的为G7(即接种根瘤菌与氮肥减量30%)处理,有利于减少河西地区氮肥施用量,为河西地区紫花苜蓿的科学施肥提供依据。
