Cp2-EPS对盐胁迫下紫花苜蓿苗期形态及光合特性的影响
2024-02-01陈海雁谢金晶张振粉
陈海雁,黄 荣,赵 亮,杨 杰,谢金晶,张振粉
(甘肃农业大学草业学院草业生态系统教育部重点实验室,甘肃 兰州 730070)
土壤盐渍化已成为影响资源和环境生态问题的主要因素之一,据报道,全球接近20%的耕地和50%的灌溉地受到盐分影响[1]。同时,人类活动所带来的全球变暖以及人类反复循环的灌溉加上高水平的施肥进一步加剧了土壤盐渍化,尤其是在干旱和半干旱地区[2-3]。而盐胁迫是造成植物生长和生产力下降的有害非生物环境因子之一,高浓度的盐(尤其是NaCl)可诱导氧化胁迫、渗透胁迫和离子毒性等,进而影响植物的正常生长,降低作物的产量和品质[4-6]。因此,应对盐胁迫是当前农业生产的重要任务之一。
胞外多糖(Exopolysaccharides,EPS)是一些特殊微生物在生长代谢过程中分泌到细胞外的水溶性高分子聚合物[7],因其具有丰富的物理、化学性质和生物活性,如稳定性、生物降解性、无毒、抗氧化活性和离子螯合等,在环境和农业的可持续发展中显示出良好的应用潜力[8-9]。已有研究证实微生物EPS通过螯合土壤中的Na+、激活植物生理代谢机制、维持微生物与植物的共生关系、提高土壤肥力等途径,促进植物生长并抵御各种逆境胁迫(盐和干旱等)[10-13]。例如,圆褐固氮菌(Azotobacterchroococcum)C5和C9产生的EPS通过增加K+/Na+比以及脯氨酸含量促进盐胁迫下玉米(Zeamays)的生长[14];铜绿假单胞菌(Pseudomonasaeruginosa)PF23产生的EPS作为渗透保护剂保护向日葵(Helianthusannuus)免受过量的盐胁迫伤害[15];杜氏盐藻(Dunaliellasalina)产生的EPS通过增加抗氧化酶活性来提高番茄(Lycopersiconesculentum)的耐盐性[16]。此外,与动植物多糖相比,微生物多糖培养周期短、成本低和产量大[17],因此,微生物EPS是一种具备良好潜能的新型生物源大分子物质。桃色欧文氏菌(Erwiniapersicina)Cp2菌株能在金氏B培养基上产生大量黏液状EPS,且广泛存在于自然环境中。前期我们的研究发现该菌所产生的EPS能够促进紫花苜蓿种子的萌发,但目前关于其对紫花苜蓿苗期抗盐性的影响尚未可知。
紫花苜蓿(Medicagosativa)是我国重要的豆科牧草之一,它的优质高产以及可持续发展直接关系到家畜产业的高质量发展,而土壤盐渍化是影响苜蓿产量的限制性因素之一[18-19]。研究表明,不同的盐胁迫浓度处理下,紫花苜蓿苗期的生长速度和地上生物量均显著下降,且下降速度与盐浓度成正比[20]。此外,盐胁迫还会导致苜蓿幼苗光合效率差,严重影响其后期的群体大小和产量形成[21]。所以,提高紫花苜蓿在苗期的耐盐性对其后期栽培的产量和质量具有极其重要的意义。目前,对于紫花苜蓿抗盐性的研究多集中在外源添加植物生长调节剂(如褪黑素、赤霉素和甜菜碱[21-23])以及接种根际促生菌(如枯草芽孢杆菌(Bacillussubtilis)和根瘤菌(Rhizobium)[24-25])等方面,而添加微生物的次生代谢物质(如EPS)提高苜蓿抗盐性的研究较少。基于此,本试验在前人研究的基础上,探究桃色欧文氏菌Cp2产生的EPS对紫花苜蓿苗期耐盐性的调控作用,以期为开发一种新型微生物源制剂并促进紫花苜蓿在盐碱地的生长提供一定的实践基础。
1 材料与方法
1.1 试验材料
供试紫花苜蓿品种:紫花苜蓿‘巨能551’,由甘肃农业大学牧草种质资源实验室提供。
供试胞外多糖:提取自桃色欧文氏菌Cp2,由甘肃农业大学牧草病理学实验室提供。
1.2 试验设计
1.2.1盐浓度筛选 选取籽粒健康饱满、大小基本一致苜蓿种子数粒,于75%的酒精中浸泡1 min后转入1%的次氯酸钠(NaClO)溶液中浸泡5 min,之后用蒸馏水反复冲洗4~5次。种子消毒后置于铺两层滤纸的培养皿中,20℃恒温条件下暗培养4 d,挑选已发芽且长势一致的紫花苜蓿转移至装有等量已高温灭菌细沙(121℃、高温灭菌21 min)的育苗杯(直径9 cm、高13 cm)中,然后将育苗杯摆放在水培盒中,置于光照培养室(每天光照16 h,昼夜温度分别为23℃,20℃,相对湿度为55%)中培养。培养至出现真叶后,用Hoagland营养液浇灌(每3 d更换一次营养液)进行强化。每杯保留长势一致的幼苗6株,3周后进行盐胁迫处理。共设置6个处理0,50,100,150,200和250 mmol·L-1NaCl,用Hoagland营养液配置不同浓度的NaCl。每个处理6个重复,盐处理2周后,根据株高和根长,确定后期盐胁迫处理浓度。
1.2.2盐和Cp2-EPS复合处理 试验共设置6个处理:0 mmol·L-1NaCl(CK);100 mmol·L-1NaCl(T0);100 mmol·L-1NaCl+0.5 g·L-1Cp2-EPS(T1);100 mmol·L-1NaCl+1.0 g·L-1Cp2-EPS(T2);100 mmol·L-1NaCl+1.5 g·L-1Cp2-EPS(T3);100 mmol·L-1NaCl +2.0 g·L-1Cp2-EPS(T4)。幼苗前期培养条件同上,待其生长三周后分别用不同浓度的EPS溶液浇灌幼苗根际,对照浇灌等量的营养液。除CK外,其他处理均用含100 mmol·L-1NaCl的Hoagland营养液配置,每个处理6个重复,盐处理2周后,分别取样测定各项指标。
1.3 相关指标测定
1.3.1生长指标的测定 株高和根长:每处理随机选取6株幼苗,用直尺进行测量。
茎粗:每处理随机选取6株幼苗,用游标卡尺进行测量。
鲜重和干重:每处理随机选取6株幼苗,将其地上和地下部分开,用蒸馏水冲洗干净,擦干水分,分别称取地上鲜重和地下鲜重,然后于105℃杀青15 min,70℃烘干72 h,分别称取地上干重和地下干重。
根系形态指标:从各处理中随机选取幼苗6株,保留根系通过根系扫描仪(Epson Expression)获取图像,然后用Win-RHIZO根系分析软件(Regent Istruments Canada Ine)进行分析。
1.3.2光合指标的测定 用95%乙醇浸提法[26]测定叶绿素含量。称取0.1 g新鲜叶片,放入10 mL离心管中,加入5 mL95%乙醇,黑暗下浸提48 h至叶片呈白色,于665,649和470 nm下测定OD值。
使用便携式光合仪(GFS-3000,Heinz Walz GmbH,Effeltrich,Germany)在上午9∶00—11∶00之间测量植物同一部位叶片的净光合速率(Pn),气孔导度(Gs),胞间CO2(Ci)和蒸腾速率(Tr)。
1.3.3叶片相对含水量和相对电导率的测定 叶片相对含水量采用烘干法[27]测定。称取新鲜叶片m1,然后将其浸入蒸馏水24 h后吸干表面水分,再次称重,记为m2。随后将叶片置于70℃烘箱中烘干,称取干重m3。
(1)
叶片相对电导率采用电导仪法[28]测定。准确称取0.1 g新鲜叶片,置于含有10 mL去离子水的玻璃试管中,于室温下浸泡20 h后用电导仪测定电导率R1,然后沸水浴加热30 min后冷却至室温并摇匀,再次测定电导率R2,同时测定去离子水的电导率R0。
(2)
1.3.4耐盐性综合评价 利用主成分分析将Cp2-EPS处理对盐胁迫下紫花苜蓿苗期生长的18个指标进行降维后,用隶属函数法[29-30]进行Cp2-EPS处理对紫花苜蓿耐盐性的综合评价。
各处理综合指标隶属函数值:
(3)
Xj表示第j个综合指标;Xjmin表示第j个综合指标最小值;Xjmax表示第j个综合指标最大值。
各处理综合指标权重:
(4)
wj表示第j个综合指标在所有综合指标中重要程度即权重;Pj为第j个综合指标贡献率。
各处理耐盐性综合评价:
(5)
D值为各处理的耐盐性综合评价值。
1.4 数据分析
用Microsoft Excel 2019和SPSS 26.0软件对数据进行整理分析并作图,使用Duncan法对差异显著性进行多重比较(P<0.05)。使用SPSS 26.0进行主成分分析。
2 结果分析
2.1 盐胁迫处理对苗期紫花苜蓿生长的影响
由图1可知,50 mmol·L-1NaCl浓度处理下,紫花苜蓿的株高和根长与对照相比差异不显著,而100~250 mmol·L-1NaCl浓度处理下,苜蓿的株高和根长均较对照显著降低(P<0.05),说明100 mmol·L-1以上浓度的盐会显著影响苜蓿幼苗的生长发育,因此选用100 mmol·L-1NaCl胁迫浓度进行后期试验。
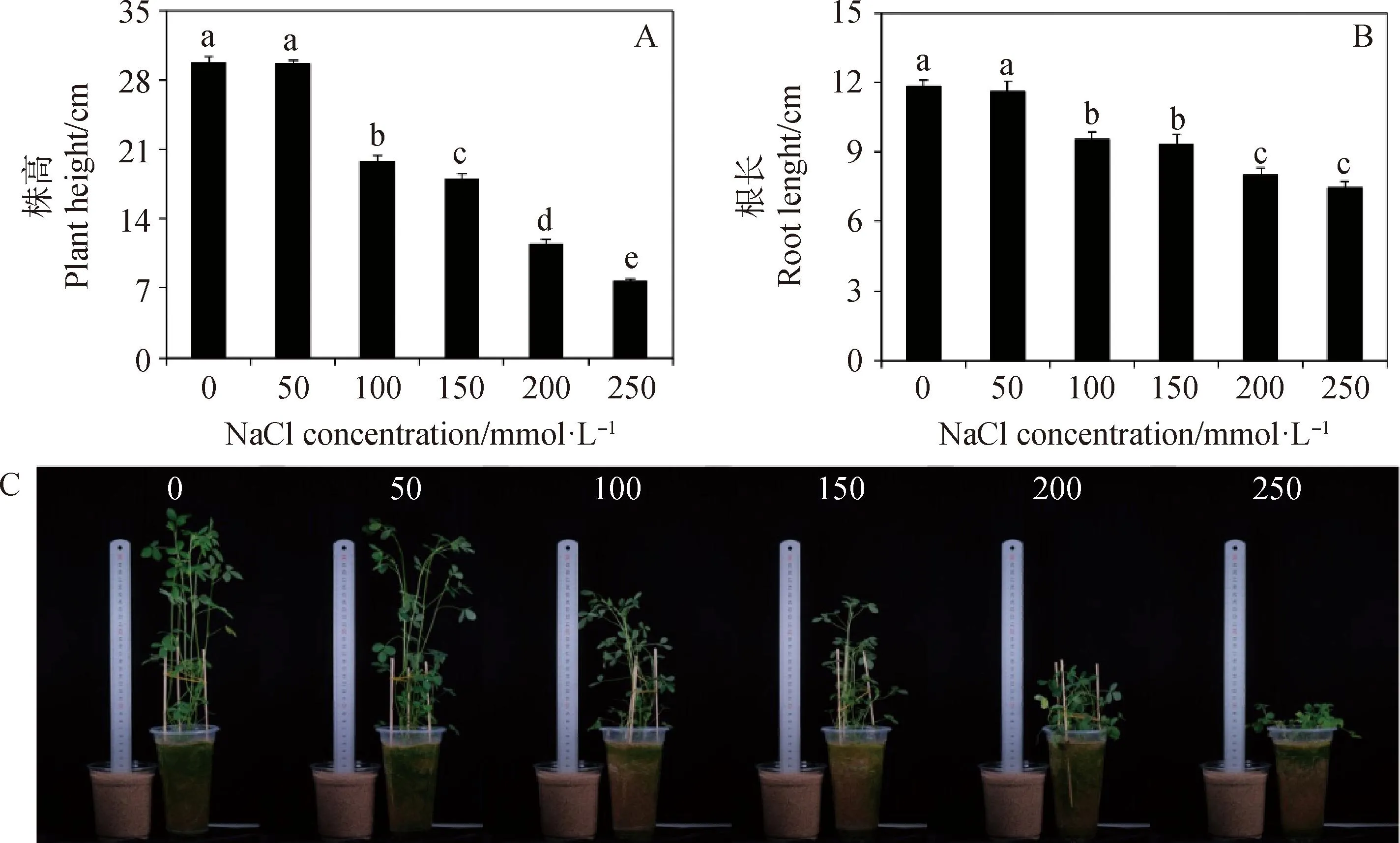
图1 盐胁迫处理下苜蓿幼苗的株高、根长和生长表型Fig.1 Plant height,root length and growth phenotype of alfalfa seedlings under salt stress注:不同小写字母表示处理间差异显著(P<0.05),下同Note:Different lowercase letters indicate significant differences (P<0.05),the same as below
2.2 Cp2-EPS处理下苗期紫花苜蓿的生长表型
如图2所示,与CK相比,T0处理显著抑制紫花苜蓿幼苗的生长(P<0.05),其株高、茎粗和根长分别降低了44.90%,45.04%和22.43%。NaCl处理下,随着EPS浓度的增大,紫花苜蓿的株高、茎粗和根长均呈先上升后下降的趋势。与T0相比,T1~T3处理苜蓿的株高和茎粗均显著增加(P<0.05),株高分别增加了20.87%,49.95%和39.01%;茎粗分别增加了20.81%,27.60%和22.29%,且均在T2处理下达到最大值;而T4处理的株高较T0显著降低了11.34%(P<0.05),茎粗较T0差异不显著(图2A,2B)。T2~T4处理下根长显著增加(P<0.05),分别增加了36.00%,41.64%和19.82%,且在T3处理下达到最大值;T1处理的根长较T0差异不显著(图2C)。

图2 Cp2-EPS处理下苜蓿幼苗的株高、茎粗、根长和生长表型Fig.2 Plant height,stem diameter,root length and growth phenotype of alfalfa seedlings under Cp2-EPS treatment注:CK表示蒸馏水对照;T0表示100 mmol·L-1NaCl胁迫;T1,T2,T3,T4表示在100 mmol·L-1NaCl溶液中分别添加0.5,1.0,1.5,2.0 g·L-1Cp2-EPS处理Note:CK indicates distilled water control;T0 stands for 100 mmol·L-1NaCl coercion;T1,T2,T3,T4 mean at 100 mmol·L-1NaCl solution added 0.5,1.0,1.5,2.0 g·L-1Cp2-EPS treatment
2.3 Cp2-EPS处理下苗期紫花苜蓿的根系形态
如表1所示,与CK相比,T0显著降低了紫花苜蓿的总根表面积、总根体积和根尖数(P<0.05),分别减小了48.58%,48.37%和36.16%,平均根直径较CK增大了10.96%。NaCl胁迫处理下,随着EPS浓度的增大,紫花苜蓿的总根表面积、总根体积和根尖数均呈先增后减的趋势,平均根直径呈先减后增的趋势。与T0相比,T3处理下紫花苜蓿平均根直径最小,较T0降低了8.96%;T2处理下总根表面积和总根体积均达到最大值,分别较T0增加了66.99%和57.43%(P<0.05)。T1处理下的根尖数最大,较T0增加了79.79%(P<0.05)。
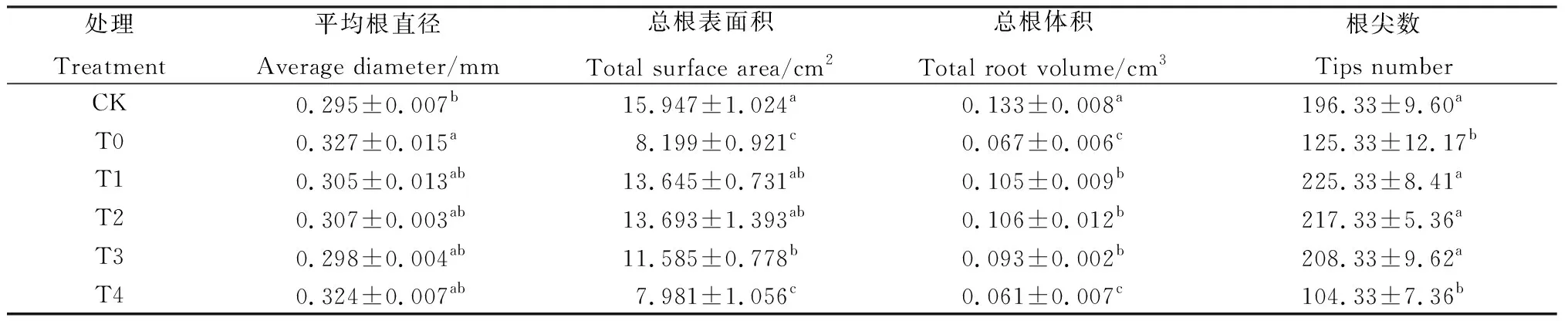
表1 Cp2-EPS处理下苜蓿幼苗的平均根直径、总根表面积、总根体积和根尖数Table 1 Average root diameter,root surface area,root volume,and tips number of alfalfa seedlings under Cp2-EPS treatment
2.4 Cp2-EPS处理下苗期紫花苜蓿的鲜重和干重
如图3所示,与CK相比,T0显著降低了紫花苜蓿幼苗的鲜重和干重(P<0.05),其地上鲜重(图3A)、地下鲜重(图3B)、地上干重(图3C)和地下干重(图3D)分别降低了62.00%,41.86%,57.02%和37.76%。NaCl处理下,随着EPS浓度的增大,紫花苜蓿的地上鲜干重和地下鲜干重均呈先上升后下降的趋势。与T0相比,T1~T3处理下地上鲜干重均显著增加(P<0.05),地上鲜重分别增加了42.27%,68.44%和48.37%,地上干重分别增加了21.39%,72.41%和55.30%,且均在T2处理下达到最大值。地下鲜干重在T1~T3处理下均显著增加(P<0.05),地下鲜重分别增加了50.80%,64.73%和63.27%,地下干重分别增加了34.91%,53.20%和56.55%,且分别在T2和T3处理下达到最大值;而T4处理下的地上鲜干重和地下鲜干重均较T0差异不显著。

图3 Cp2-EPS处理下苜蓿幼苗的鲜重和干重Fig.3 Fresh and dry weight of alfalfa seedlings under Cp2-EPS treatment
2.5 Cp2-EPS处理下苗期紫花苜蓿的叶绿素含量
如图4所示,与CK相比,T0使紫花苜蓿叶片叶绿素a(图4A)、叶绿素b(图4B)和总叶绿素含量(图4C)显著降低(P<0.05),分别降低了8.12%,28.23%和15.59%。与T0相比,T1~T3处理均能不同程度地缓解盐胁迫对紫花苜蓿幼苗叶绿素含量的抑制(P<0.05),其中叶绿素a含量分别增加了5.21%,12.53%和10.98%;叶绿素b含量分别增加了14.84%,28.34%和19.42%;总叶绿素含量分别增加了8.25%,17.53%和13.65%;且均以T2处理效果最佳,其次是T3处理。T4处理下的叶绿素a、总叶绿素含量均较T0显著降低(P<0.05),分别降低了7.27%和5.57%。

图4 Cp2-EPS处理下苜蓿幼苗的叶绿素含量Fig.4 Chlorophyll content of alfalfa seedlings under Cp2-EPS treatment
2.6 Cp2-EPS处理下苗期紫花苜蓿的光合指标
如图5所示,与CK相比,T0处理下紫花苜蓿叶片的净光合速率Pn(图5A)、蒸腾速率Tr(图5B)和气孔导度Gs(图5C)均显著降低(P<0.05),分别降低了34.53%,17.36%和12.94%;而胞间CO2浓度Ci显著增加(P<0.05),增加了19.92%(图5D)。与T0相比,T1~T3处理均能不同程度地缓解盐胁迫对紫花苜蓿幼苗Pn,Tr和Gs的抑制(P<0.05),其中Pn和Gs均在T2处理下达到最大值,分别增加了49.53%和12.73%;Tr在T3处理下达到最大值,增大了20.22%;Ci在T2处理下最小,较T0减小了9.65%。而T4处理下的Pn,Tr和Gs均较T0显著降低(P<0.05),Ci较T0显著增加(P<0.05)。
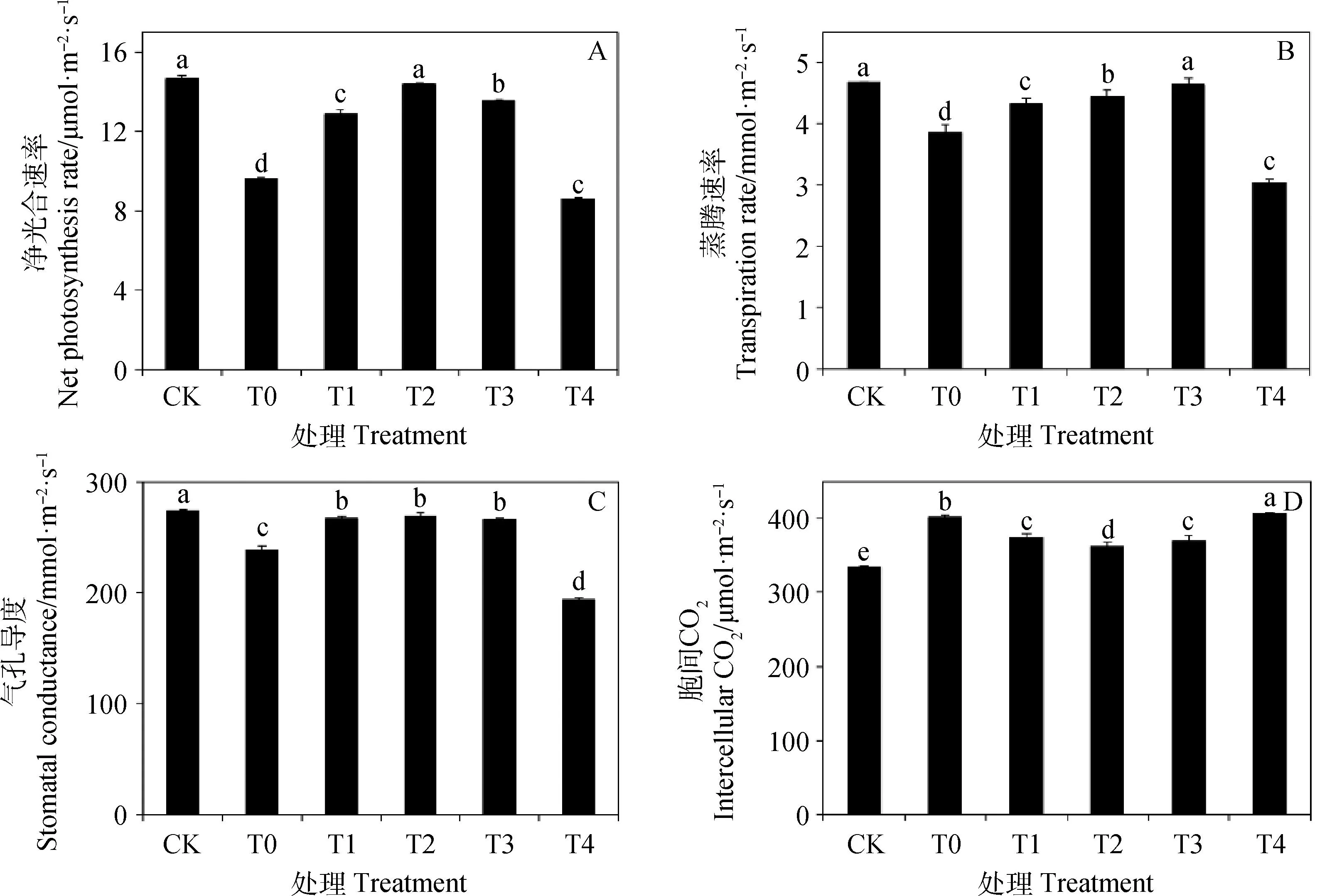
图5 Cp2-EPS处理下苜蓿幼苗的净光合速率、蒸腾速率、气孔导度和胞间CO2浓度Fig.5 Net photosynthetic rate,transpiration rate,stomatal conductance and intercellular CO2 concentration of alfalfa seedlings under Cp2-EPS treatment
2.7 Cp2-EPS处理下苗期紫花苜蓿的相对含水量和相对电导率
如图6A所示,与CK相比,T0处理导致紫花苜蓿叶片的相对含水量显著降低(P<0.05),降低了33.92%。与T0相比,T1~T3处理下苜蓿叶片的相对含水量均显著升高(P<0.05),其中T2处理下的相对含水量最高,较T0增大了22.35%,其次是T3处理,与T2处理差异不显著,且均达到了CK的水平;而T4处理下的相对含水量较T0降低。

图6 Cp2-EPS处理下苜蓿幼苗的相对含水量和相对电导率Fig.6 Relative water content and relative conductivity of alfalfa seedlings under Cp2-EPS treatment
如图6B所示,与CK相比,T0处理导致紫花苜蓿叶片的相对电导率显著升高(P<0.05),是CK的3.41倍。与T0相比,T1~T3处理下苜蓿叶片的相对电导率均显著降低(P<0.05),分别降低了34.52%,52.74%和48.80%,其中T2处理下的相对电导率最低,其次是T3处理,且均达到了CK的水平;而T4处理下的相对电导率较T0升高。
2.8 综合评价
采用主成分分析法,将NaCl胁迫下紫花苜蓿苗期生长的18个指标分为了2个主成分(表2)。其中第1主成分特征值为15.614,贡献率为86.742%,第2主成分特征值为1.114,贡献率为6.190%,二者累计贡献率达到了92.932%。
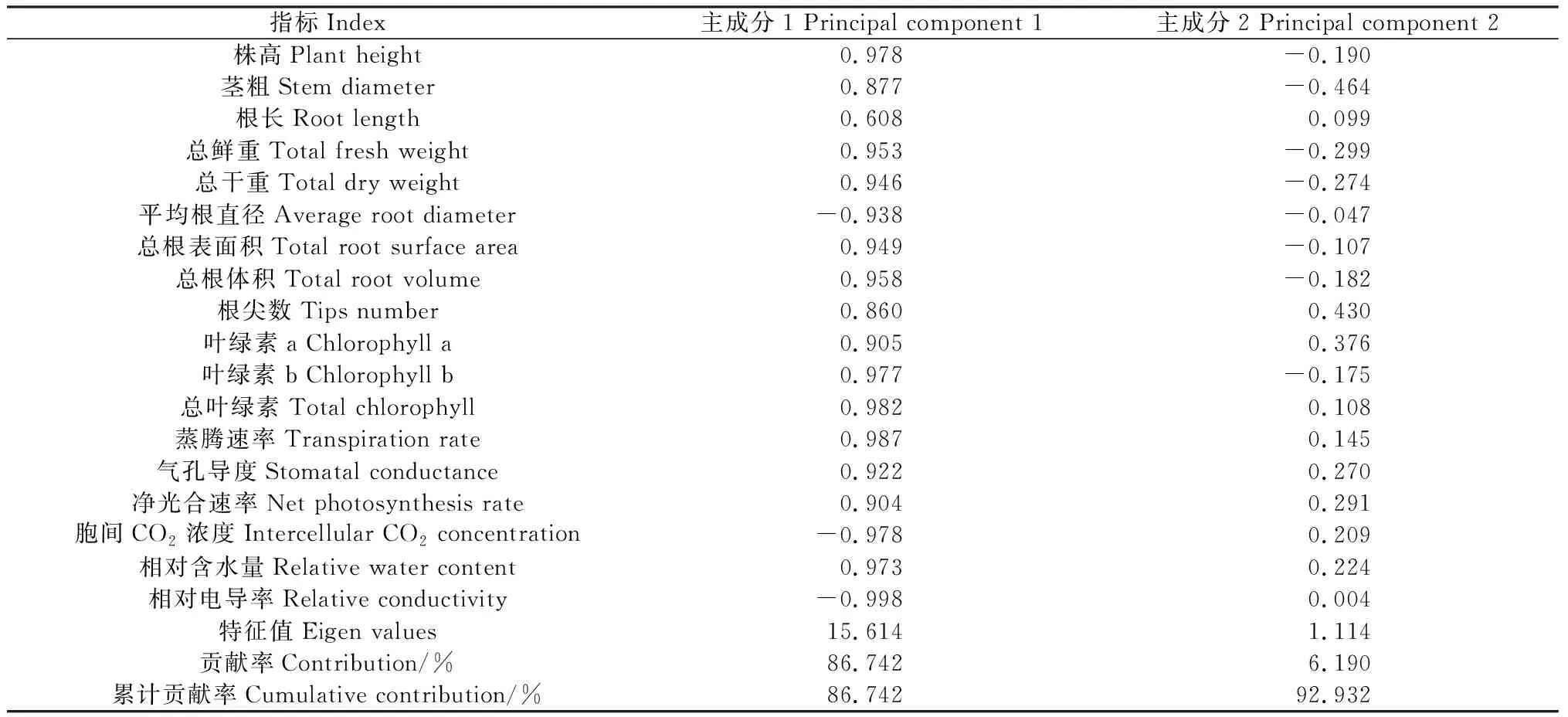
表2 各综合指标系数及贡献率Table 2 Coefficient and contribution rate of each comprehensive index
根据公式(3)得到2个主成分的各处理隶属函数值;结合2个主成分的贡献率,由公式(4)得到2个主成分的权重;然后利用公式(5)得到各处理的综合评价值。隶属函数综合评价值越大,说明Cp2-EPS缓解苜蓿幼苗盐胁迫的效应越强。结果显示,T1~T3处理均能在不同程度上缓解紫花苜蓿受到的盐胁迫,且T2(1.0 g·L-1Cp2-EPS)处理对100 mmol·L-1NaCl胁迫下紫花苜蓿种子萌发和幼苗生长的缓解效果最佳。综合评价结果为:CK>T2>T3>T1>T0>T4(表3)。

表3 各处理综合指标值、权重、隶属函数值、D值及综合评价Table 3 The comprehensive indicator values,index weight,membership function value,D values and comprehensive evaluation of each treatment
3 讨论
苗期是紫花苜蓿整个生长周期中的关键阶段,遭受盐胁迫后会导致幼苗长势弱,根系变少变短,进而影响其后期的生长发育及产量和品质[31]。生长量是植物对盐胁迫响应的综合体现,也是对盐胁迫的综合反应[32]。而根系作为植物最先感受到盐胁迫信号的器官,是提高植物耐盐性的关键,根系的发育对于植物从土壤中获取水分和营养并由此增加蒸腾过程中损失的水分的补充率是极其重要的[33-34]。本研究中,盐胁迫显著抑制苜蓿植株的高度、茎粗、地上鲜干重、地下鲜干重和根系的发育。目前,已有不少研究证实微生物EPS在植物耐盐性形成过程中发挥着重要作用[10-11,35]。本试验结果显示,添加0.5~1.5 g·L-1Cp2-EPS后有效缓解盐胁迫导致的紫花苜蓿生长能力受阻,而这种生长促进作用可能是由于EPS作为一种天然抗氧化剂具有清除植物中盐诱导的活性氧(ROS)的能力[17],Alami等[11]在向日葵、Atouei等[36]在小麦(Triticumaestivum)和Awad等[37]在玉米幼苗中也有类似的研究结果。Chen等[38]的研究还发现EPS可以刺激番茄体内的几种植物激素信号传导途径,如生长素、脱落酸等,从而促进番茄在盐胁迫环境中生长。此外,添加0.5~1.5 g·L-1Cp2-EPS后的幼苗根系生长明显较好并且侧根明显增加,从而能够更好地获取水和营养,这可能是EPS作为生物膜附着在根系表面形成物理屏障,帮助根系抵御盐分的伤害[39],Liu等[40]的研究结果与此一致。同时,我们还发现高浓度(2.0 g·L-1)Cp2-EPS会抑制苜蓿幼苗的根系和地上部的生长。艾力江·麦麦提等[41]也发现过高浓度(20 mmol·L-1)的海藻糖反而会加重盐胁迫对甜瓜(Cucumismelo)幼苗的伤害,与本试验结果类似。
叶绿素是光合作用所必需的,而光合能力降低是植物在盐胁迫下生长抑制的主要原因[42]。在本研究中,盐胁迫显著降低了紫花苜蓿的叶绿素含量,而经过0.5~1.5 g·L-1Cp2-EPS处理后,苜蓿的叶绿素含量显著升高,表明适宜浓度的Cp2-EPS能缓解盐胁迫导致的叶绿素降解,原因可能是EPS维持了盐胁迫下细胞的氧化还原平衡,从而减弱了盐分对叶绿素合成的干扰[43],这与张成冉等[44]利用糖(葡萄糖、壳聚糖和海藻糖)减轻盐胁迫对玉米幼苗叶绿素含量抑制的结果一致。此外,净光合速率的降低还与细胞内CO2的可用性降低有关,而光合CO2的固定受气孔限制和非气孔限制因素的调节,盐胁迫期间植物采用气孔关闭的适应性措施,使蒸腾期间的水分损失最小化[45-46]。本研究中,盐胁迫下苜蓿叶片中净光合速率的减少与苜蓿胞间CO2含量的增加有关。当经过0.5~1.5 g·L-1Cp2-EPS处理后,苜蓿叶片的净光合速率、蒸腾速率和气孔导度均显著高于盐处理,而胞间CO2浓度显著低于盐处理。这说明适量施用Cp2-EPS可以有效改善气孔的功能,使植物在盐胁迫下重新打开气孔,有助于增强盐胁迫下植物的光合作用。
叶片相对含水量的高低能够反映植物抵御盐胁迫引起的生理干旱水平[21]。相对电导率能够鲜明的反映出植物叶片细胞膜的损伤程度,其值较低时表明植物细胞膜因盐胁迫引起的损伤越低,抵抗盐胁迫的能力越强[47]。本研究中,盐胁迫使紫花苜蓿叶片相对含水量显著降低,相对电导率显著升高,可能是盐胁迫诱导植物体内的渗透胁迫,导致叶片中的含水量降低,对细胞膜和细胞器具有破坏性影响[48]。有研究指出微生物EPS是清除自由基并保护植物免受ROS引起的脂质过氧化的有效抗氧化剂[17]。本研究中,添加0.5~1.5 g·L-1Cp2-EPS后,幼苗则显示出较高水平的相对含水量和较低水平的相对电导率,这与尹雅洁等[49]在水稻(Oryzasativa)上的研究结果类似。此外,本研究还发现,添加高浓度(2.0 g·L-1)Cp2-EPS会降低相对含水量并提高相对电导率,加剧对叶片细胞膜的损害,原因可能是苜蓿幼苗受到盐分与高浓度Cp2-EPS的双重胁迫,但具体原因还待进一步研究。
综上所述,在盐胁迫条件下,适宜浓度的Cp2-EPS可以通过增加幼苗的株高、根长、相对含水量以及叶绿素含量等来调节紫花苜蓿的生长状况,并通过降低叶片相对电导率进而降低膜脂过氧化水平来增强苜蓿的耐盐性。
4 结论
100 mmol·L-1NaCl胁迫严重抑制了紫花苜蓿苗期的生长,添加0.5~1.5 g·L-1Cp2-EPS均能在一定程度上缓解该胁迫对紫花苜蓿的毒害作用,促进紫花苜蓿幼苗地上及地下部的生长,并提高紫花苜蓿的光合作用,而高浓度(2.0 g·L-1)的Cp2-EPS反而会加重盐胁迫对苜蓿的伤害。最后,经隶属函数综合分析后显示,1.0 g·L-1Cp2-EPS对该盐胁迫浓度下紫花苜蓿的缓解效果最好。
