根灌外源褪黑素对干旱胁迫下紫花苜蓿生理特性的影响研究
2024-02-01麻冬梅刘晓霞马巧利侯汶君李嘉文苏立娜杭嘉慧
张 玲,麻冬梅*,刘晓霞,马巧利,侯汶君,李嘉文,苏立娜,杭嘉慧
(1.宁夏大学西北土地退化与生态系统恢复省部共建国家重点实验室培育基地/西北退化生态系统恢复与重建教育部重点实验室,宁夏大学生态环境学院,宁夏 银川 750021; 2.宁夏大学林业与草业学院,宁夏 银川 750021)
紫花苜蓿(MedicagosativaL.)是享有“牧草之王”美誉的豆科多年生草本植物,因其固氮能力强,蛋白质含量高、产量高,营养物质丰富,成为我国栽培面积最大的饲草作物之一[1]。截至2019年,我国紫花苜蓿商品草种植面积已达4.4×109m2,但随着畜牧业快速发展和工厂化养殖快速推广,我国优质饲草需求仍有40%~60%的缺口,紫花苜蓿所具有的生态和经济价值使其成为饲料行业的主力军[2-4]。干旱是抑制植物生长最严重的非生物胁迫之一,干旱发生后,细胞器产生大量活性氧(Reactive oxygen species,ROS),生成大量过氧化物,膜脂过氧化加剧,影响细胞的正常代谢,抑制植物光合作用[5]。对植物的品质和产量产生影响的同时,也会限制植物的地理分布[6]。干旱破坏ROS产生和清除间的平衡,产生大量H2O2,过量活性氧积累对细胞膜造成损伤—破坏核酸、氧化蛋白质、引起脂质过氧化,H2O2是极具细胞毒性的活性氧之一,大量积累严重影响正常代谢[7-8]。因此,确定应对干旱胁迫的战略,对全球农业的可持续发展具有重要意义。紫花苜蓿虽然可以抵挡一定程度的干旱,但是随着全球气候变化加剧,畜牧业发展牧草需求量增加,如何维持干旱胁迫下紫花苜蓿的生长和产量,保障其高效发挥生态效益已经成为亟待解决的关键问题。
褪黑素(Melatonin,MT)是一种调节昼夜节律、调控植物生长的吲哚胺植物激素[9]。它首先在动物体内被发现,自1995年以来,在多种植物的根、叶、种子和果实中检测到褪黑激素的存在[10-11],2018年研究人员在拟南芥(Arabidopsisthaliana)中发现第一个植物褪黑激素受体—CAND2/PMTR1[12]。大量研究表明褪黑素对不良环境下作物耐受性提高有正向作用[13],其中包括清除活性氧、增加渗透调节物质、降低盐胁迫对叶绿素的破坏,调控抗逆基因的表达,从而提高植物抗逆性[14-15]。褪黑素可以缓解各种类型的非生物胁迫,如盐碱、干旱、极端温度和重金属等[16-18],并在植物中作为渗透调节物质,维持细胞质稳态和调节生长[19]。桃苗(Prunuspersica)经褪黑素预处理后气孔开度减小,褪黑素增强干旱胁迫下桃苗根系活力,提高叶片相对含水量和相对叶绿素含量,并提高DREB1A,DREB2A,LEA和PIP1等逆境响应基因的表达量[20]。外源褪黑素提高盐胁迫下烟草(NicotianatabacumL.)叶片含水率、过氧化物酶活性,降低H2O2和丙二醛含量[21]。先前的研究主要集中在干旱对植物种子萌发或幼苗生长的影响,而关于外源褪黑素对干旱胁迫下紫花苜蓿的调节作用研究较少。本研究以紫花苜蓿品种‘中苜3号’为材料,采用盆栽根灌褪黑素的方法,分析褪黑素对干旱胁迫下紫花苜蓿生长及生理方面的影响,探讨褪黑素缓解紫花苜蓿干旱胁迫可能的生理机制,以期利用褪黑素为紫花苜蓿抵御干旱提供理论依据。
1 材料与方法
1.1 植物材料与干旱处理
本盆栽试验于2022年4月在宁夏大学生态环境学院气候室进行,试验材料为‘中苜3号’紫花苜蓿。每个花盆装有500 g过筛的壤土,土壤选用宁夏本地土壤混合基质土,每盆播种八粒种子,紫花苜蓿幼苗生长至12 cm高时,保留长势一致幼苗每盆六株,进行连续三天根灌100 mL不同浓度褪黑素,对照组(CK)及干旱组(D)根灌等量水,在第3次根灌褪黑素的次日,除对照组正常浇水外,其余处理均进行自然渐进式干旱,控制浇水,达到中度干旱(土壤相对含水量在40%~45%)程度,通过称重法每两天补充蒸发散失的蒸馏水。试验共设7个处理:① CK;②干旱(D);③干旱+30 μmol·L-1MT(D30MT);④干旱+60 μmol·L-1MT(D60MT);⑤干旱+90 μmol·L-1MT(D90MT);⑥干旱+120 μmol·L-1MT(D120MT);⑦干旱+150 μmol·L-1MT(D150MT),每个处理3个重复。干旱处理14天后,于早上9∶00随机选取不同处理下紫花苜蓿幼苗12株,叶绿素含量测定自茎顶部数第2片叶,生理指标测定自茎顶部数第2~4片叶(叶片取下后立即置于-80℃冰箱保存),试验设置3次重复。
1.2 生长指标测定
随机选取不同处理下紫花苜蓿幼苗12株,株高(茎基部到主茎顶部距离)使用卷尺测量,茎粗(子叶下部)以游标卡尺测量(直径)。
1.3 相对电导率、丙二醛、H2O2含量的测定
根据改良的Cen等[22]方法测量相对电导率(Relative electrical conductivity,REC),称取0.2 g叶片置于装有20 mL去离子水的玻璃管中,室温静置12 h,测量电导率E1后,100℃煮沸30 min,待溶液冷却测量电导率E2。
REC=(E1/E2)×100%
丙二醛含量根据Zhang等[23]的方法采用硫代巴比妥酸法测定,分别测量在532,600,450 nm波长下的吸光度值;Zhang等人建议,在415 nm处用分光光度法测定紫花苜蓿叶片中H2O2浓度。
1.4 渗透调节物质含量的测定
蒽酮比色法测定可溶性糖(Soluble sugar,SS)含量;茚三酮比色法测定脯氨酸含量;可溶性蛋白含量测定根据考马斯亮蓝法[24]。
1.5 叶片相对叶绿素含量、相对含水量的测定
相对叶绿素含量使用便携式叶绿素仪测定。叶片相对含水量(Relative water content,RWC)使用以下公式计算,称取约0.1 g叶片记为鲜重,置于蒸馏水中浸泡24 h,至达到恒定重量,擦干叶片水分称量饱和重,然后于80℃烘箱中干燥至恒重,记为干重。
1.6 抗氧化酶活性测定
取紫花苜蓿叶样品0.5 g在液氮中研磨,加入预冷磷酸缓冲溶液(pH = 7.9)7.2 mL,在4℃下孵育15 min。孵育完成后将溶液在4℃下12 000 g·min-1离心15 min;上清液用于测定抗氧化酶活性。参考高俊凤等的方法进行超氧化物歧化酶(Superoxidase dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)活性的测定[24]。
1.7 总RNA提取及基因表达分析
称取0.1 g冷冻叶片加入液氮预冷的研钵中研磨成粉末,总RNA提取根据TIANGEN总RNA提取试剂盒(RNAprep Pure Plant Plus Kit)进行,使用超微量紫外分光光度计和0.5%琼脂糖凝胶检测RNA纯度及浓度,按照Vazyme反转录试剂盒HiScript All-in-one RT SuperMix Perfect for qPCR将检测合格RNA反转录合成cDNA。MsCu/Zn-SOD,MsPOD,MsCAT,MsAPX引物根据Niu等[25]的研究设计。qRT-PCR的反应条件为:95℃,30 s,95℃,5 s,60℃,20 s,72℃,30 s,循环40次。内参基因选择紫花苜蓿肌动蛋白基因Actin。每个样品设置3次重复,基因相对表达水平根据2-ΔΔCt法计算,引物信息在表1列出。

表1 引物设计Table 1 qRT-PCR analysis primers
1.8 数据处理
运用Microsoft Office excel 2021对数据进行整理,使用SPSS 25.0数据处理系统进行单因素方差分析和Duncan(P<0.05)多重比较,采用Origin 2022软件绘图。
2 结果与分析
2.1 外源褪黑素对干旱胁迫下紫花苜蓿株高和茎粗的影响
如图1所示,干旱胁迫下紫花苜蓿幼苗生长受到抑制,尤其是对株高、茎粗影响较大。与对照CK相比,干旱胁迫(D,中度干旱,土壤相对含水量为40%~45%)处理组的幼苗株高、茎粗分别显著降低了55%,34%(图2)(P<0.05)。对褪黑素缓解干旱效应的探究试验中发现,与不添加褪黑素的干旱D处理组相比,添加60,90和120 μmol·L-1褪黑素可显著改善干旱胁迫的紫花苜蓿幼苗的生长性状(P<0.05)。与干旱胁迫(D,中度干旱,土壤相对含水量为40%~45%)相比,D90MT处理的苜蓿幼苗的株高和茎粗分别显著增加了75%和41%,效果最显著(P<0.05)。因此高浓度褪黑素对干旱胁迫下植物生长的缓解作用较小。可见施加合适浓度的外源褪黑素能够有效减轻干旱对植物造成的负面影响,其中90 μmol·L-1缓解效果最为明显。

图1 不同处理下紫花苜蓿幼苗生长状况Fig.1 Growth of alfalfa seedlings under different treatments注:CK,正常浇水处理;D,干旱胁迫处理;D30MT,干旱胁迫处理+30 μmol·L-1 MT; D60MT,干旱胁迫处理+60 μmol·L-1 MT;D90MT,干旱胁迫处理+90 μmol·L-1 MT;D120MT,干旱胁迫处理+120 μmol·L-1 MT;D150MT,干旱胁迫处理+150 μmol·L-1;MT,褪黑素,下同Note:CK,the well-watered treatment;D,the drought stress treatment;D30MT,the drought stress treatment+30 μmol·L-1 MT;D60MT,the drought stress treatment+60 μmol·L-1 MT;D90MT,the drought stress treatment+90 μmol·L-1 MT;D120MT,the drought stress treatment+120 μmol·L-1 MT;D150MT,the drought stress treatment+150 μmol·L-1 MT;MT,Melatonin. The same as below

图2 外源褪黑素对干旱胁迫下紫花苜蓿株高和茎粗的影响Fig.2 Effects of exogenous melatonin on the plant height and stem diameter of alfalfa seedlings under drought stress注:A,株高;B,茎粗。数据柱形标注不同小写字母表示差异显著(P<0.05)。下同Note:Panel A:Plant height;Panel B:Stem diameter. Value columns with different lowercase letters mean a significant difference (P<0.05) between different treatments. The same as below
2.2 外源褪黑素对干旱胁迫下紫花苜蓿叶片膜透性的影响
植物由于长期缺水造成细胞膜受损。如图3所示,与CK相比,干旱处理造成紫花苜蓿幼苗叶片相对电导率(REC)、MDA及H2O2含量显著上升,分别增加了96%,194%和94%(P<0.05)。经褪黑素预处理后植株减少了REC,MDA及H2O2的产生。与D处理相比,60,90,120 μmol·L-1MT均显著降低了各指标的水平(P<0.05),其中,D90MT处理降低REC、MDA效果更明显,与D处理相比,分别减少了31%和49%,干旱与90 μmol·L-1褪黑素复合处理紫花苜蓿幼苗MDA含量与对照组无显著差异。与D相比,120 μmol·L-1MT预处理紫花苜蓿幼苗经受干旱后H2O2含量最低,显著降低了41%(P<0.05)。
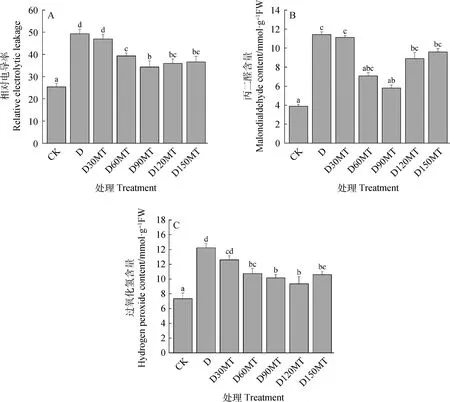
图3 外源褪黑素对干旱胁迫下紫花苜蓿叶片膜脂过氧化产物的影响Fig.3 Effects of exogenous melatonin on the products of membrane lipid peroxidation of leaves of alfalfa seedlings under drought stress注:A,相对电导率;B,丙二醛含量;C,过氧化氢含量Note:Panel A,Relative electrolytic leakage;Panel B,Malondialdehyde content;Panel C,Hydrogen peroxide content
2.3 外源褪黑素对干旱胁迫下紫花苜蓿渗透调节物质含量的影响
如图4所示,与对照组CK相比,干旱胁迫下脯氨酸、可溶性糖和可溶性蛋白含量分别显著上升了194%,119%和67%(P<0.05);干旱胁迫下紫花苜蓿幼苗施加褪黑素处理显著降低了脯氨酸的水平,其中以D90MT,D120MT处理的Pro含量最低,分别减少了51%和53%(P<0.05)。中高浓度褪黑素对降低可溶性糖和可溶性蛋白含量有显著作用,90 μmol·L-1MT处理紫花苜蓿幼苗可溶性糖含量最接近对照组,与D处理相比减少了46%(P<0.05)。低浓度(30 μmol·L-1)褪黑素对干旱胁迫下叶片可溶性蛋白含量影响不明显,60,90,120,150 μmol·L-1MT相比于D处理分别减少了24%,25%,20%,15%。
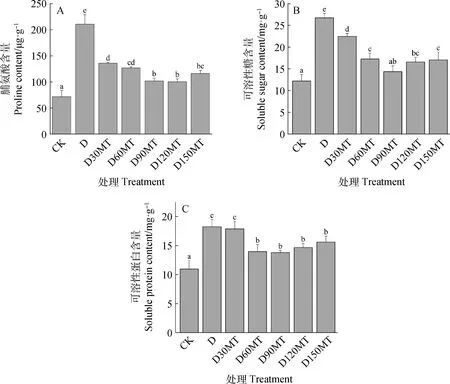
图4 外源褪黑素对干旱胁迫下紫花苜蓿渗透调节物质含量的影响Fig.4 Effects of exogenous melatonin on the content of osmotic regulatory substances of the leaves of alfalfa seedlings under drought stress注:A,脯氨酸含量;B,可溶性糖含量:C,可溶性蛋白含量Note:Panel A,Proline content;Panel B,Soluble sugar content;Panel C,Soluble protein content
2.4 外源褪黑素对干旱胁迫下紫花苜蓿叶片RWC和相对叶绿素含量的影响
叶片水分状态受相对含水量(RWC)影响。如图5A所示,与CK相比,干旱胁迫下RWC减少了49%。60,90,120,150 μmol·L-1MT处理均可显著提升叶片相对含水量(P<0.05),90 μmol·L-1MT是最有益的处理,它导致干旱胁迫下紫花苜蓿幼苗的RWC较D处理增加了89%,且与对照组无显著差异。干旱导致叶片缺水、发黄枯落,相对叶绿素含量显著降低(P<0.05)。通过添加外源褪黑素,显著增加了干旱胁迫下相对叶绿素含量(P<0.05)。D90MT,D120MT处理显著提高了叶片相对叶绿素含量,与D处理相比,分别增加了50%,29%(图5B)(P<0.05)。
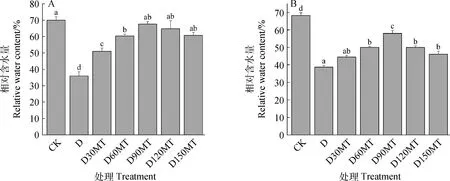
图5 外源褪黑素对干旱胁迫下紫花苜蓿叶片RWC和相对叶绿素含量的影响Fig.5 Effects of exogenous melatonin on RWC and relative chlorophyll content of leaves of alfalfa seedlings under drought stress注:A,相对含水量;B,相对叶绿素含量Note:Panel A,Relative water content;Panel B,Relative chlorophyll content
2.5 外源褪黑素对干旱胁迫下紫花苜蓿抗氧化酶活性的影响
逆境导致植物体内ROS积累增加,破坏了原本的ROS产生与消除之间的平衡,植物为应对这一变化,增强体内抗氧化酶(SOD,POD,CAT,APX)含量以清除ROS。如图6所示,干旱胁迫导致植物体内抗氧化酶含量显著上升,与CK相比,D处理中SOD,POD,CAT,APX活性显著增加了96%,109%,33%,23%(P<0.05),中高浓度褪黑素使抗氧化酶含量进一步提升,低浓度褪黑素可以提高抗氧化酶活性。与干旱胁迫相比,干旱与褪黑素复合处理(D90MT,D120MT,D150MT)幼苗叶片SOD活性显著增加了53%,45%,36%(图6A);POD活性显著增加了56%,44%,50%(图6B);CAT活性显著增加了46%,32%,32%(图6C);APX活性显著增加了31%,28%,31%(图6D)(P<0.05)。

图6 外源褪黑素对干旱胁迫下紫花苜蓿抗氧化酶活性的影响Fig.6 Effects of exogenous melatonin on antioxidant enzyme activities of leaves of alfalfa seedlings under drought stress注:A,超氧化物歧化酶活性;B,过氧化物酶活性;C,过氧化氢酶活性;D,抗坏血酸过氧化物酶活性Note:Panel A,Superoxide dismutase activity;Panel B,Peroxidase activity;Panel C,Catalase activity;Panel D,Ascorbate peroxidase activity
2.6 外源褪黑素对干旱胁迫下紫花苜蓿幼苗抗氧化酶基因表达的影响
抗氧化酶合成基因在不同处理下呈现先升高后降低的趋势,植物为了抵御和适应干旱胁迫造成的伤害,启动干旱应答机制,激活抗氧化酶基因的表达。如图7所示,与对照组相比,干旱显著促进了编码抗氧化酶基因的表达(P<0.05),褪黑素进一步提高了其表达,尤其是在90 μmol·L-1和120 μmol·L-1褪黑素处理时有最高表达。与干旱胁迫相比,120 μmol·L-1褪黑素处理紫花苜蓿幼苗MsCu/Zn-SOD表达上调25%(图7A),MsCAT上调19%(图7C),MsAPX上调36%(图7D),90 μmol·L-1褪黑素处理紫花苜蓿幼苗MsPOD表达上调37%(图7B)。

图7 外源褪黑素对干旱胁迫下紫花苜蓿抗氧化酶合成基因表达的影响Fig.7 Effects of exogenous melatonin on gene expression of antioxidant enzymes in the leaves of alfalfa seedlings under drought stress注:A,MsCu/Zn-SOD表达水平;B,MsPOD表达水平;C,MsCAT表达水平;D,MsAPX表达水平Note:Panel A,MsCu/Zn-SOD expression level;Panel B,MsPOD expression level;Panel C,MsCAT expression level;Panel D,MsAPX expression level
3 讨论
植物在应对干旱胁迫环境时,会发生一系列生理及形态的变化来维持自身的生存生长,如叶片卷曲、刺化,根系变长和气孔关闭[26]。有研究发现施加褪黑素、2,4-表油菜素内酯、NO,IAA和独脚金内酯等外源添加剂,可以达到对逆境胁迫下紫花苜蓿的生长和生理等方面的正向调控作用,有利于紫花苜蓿抵抗逆境胁迫[27-31]。本试验中,干旱处理下紫花苜蓿幼苗植株矮小,叶片萎蔫、枯黄(图1),叶片相对含水量和叶绿素含量显著下降,干旱处理组紫花苜蓿幼苗株高、茎粗显著低于CK,而根灌外源褪黑素可以显著提高株高茎粗(图2),叶片相对含水量上升且与对照组无显著差异,叶绿素含量在褪黑素缓解下含量显著提高(P<0.05)。这与He等[32]在2022的研究结论外源褪黑素能够增加干旱胁迫下甜菜(BetavulgarisL.)地上、地下部分鲜重干重及株高的结果一致,即添加适宜浓度的褪黑素能够有效改善干旱导致的植物生长受阻,促进植株吸水和叶绿素合成。李荣等[33]的研究也证明外源褪黑素增加了盐胁迫下黄瓜(CucumissativusL.)幼苗的株高和茎粗。
干旱等非生物胁迫造成植物渗透失衡,抑制植物吸水,植物通过自身渗透调节,即增加渗透胁迫物质含量,降低渗透势以维持细胞膨压和保水。可溶性糖、可溶性蛋白和脯氨酸在干旱胁迫下是重要的渗透调节物质。本研究中,干旱胁迫下紫花苜蓿幼苗可溶性糖、可溶性蛋白和脯氨酸含量显著上升,以抵御渗透失衡,添加外源褪黑素后,其含量逐渐降低,但显著高于对照组,这是因为褪黑素在增强植物渗透调节物质积累的同时,提高了植物叶片相对含水量,缓解渗透胁迫,增强幼苗抗旱性。前人的研究中也有类似的报道,这与Ahmad等[34]研究得出外源褪黑素可显著降低盐胁迫下玉米(ZeamaysL.)叶片脯氨酸、可溶性糖含量的结果一致。根灌外源褪黑素对干旱胁迫下紫花苜蓿的影响大多集中于对叶片的研究,根系是感知水分最敏感的器官,对根系进行生理分子方面的研究鲜见报道有待进一步研究。
持续干旱胁迫造成细胞ROS的产生和消除不平衡,导致细胞膜结构被破坏,对植物造成氧化损伤[35]。褪黑素诱导抗氧化酶活性,有助于维持ROS的平衡[36]。在干旱胁迫下,褪黑素处理的紫花苜蓿中抗氧化酶SOD,POD,CAT和APX的活性较高,中高浓度MT的作用效果更明显(图6)。对茶树(CamelliasinensisL.)[37]和甜高粱(Sorghumbicolor)幼苗[38]的研究表明,MT通过增强抗氧化酶活性,从而提高了对干旱胁迫的抵抗力。干旱导致植株叶片细胞膜过氧化,膜透性增大,电解质和小分子物质外渗造成电导率升高,MDA作为膜脂过氧化的终产物,其含量能够反应膜受损伤程度[39]。本研究发现干旱处理导致紫花苜蓿幼苗叶片H2O2、相对电导率、MDA含量增加;MT复合处理降低了H2O2,REC,MDA的含量(图3),有效抑制了干旱胁迫下紫花苜蓿幼苗叶片中ROS的增加。本研究结果与褪黑素对猕猴桃(Actinidiachinensis)[40]和玉米[34]的影响相似。这表明MT诱导紫花苜蓿叶片中抗氧化酶活性的增加,以去除过量的ROS并保护植物免受氧化应激。此外,我们的试验发现褪黑素增加了干旱胁迫下MsCu/Zn-SOD,MsPOD,MsCAT和MsAPX基因的表达量,这与Niu等[25]的研究结果一致,褪黑素抑制了因NaCl胁迫引起的细胞膜缺陷、脂质过氧化和活性氧(ROS)积累,MT上调抗氧化酶的基因表达和活性,以清除NaCl处理植物中过量的ROS。
4 结论
综上所述,干旱阻碍紫花苜蓿正常生长,植物为抵御干旱损伤启动自身防御机制,使抗氧化酶活性、渗透调节物质含量增加;外源褪黑素通过提高植物的抗氧化能力和渗透调节能力缓解由干旱引起的损伤,添加不同浓度(30,60,90,120,150 μmol·L-1)的褪黑素具有不同的缓解程度,其中90 μmol·L-1褪黑素溶液处理最佳,并可使丙二醛含量、可溶性糖含量、相对含水量缓解到对照水平,对植物生长生理及抗氧化酶基因表达等各方面具有明显作用,显著提高植物的抗旱性。田间生产应用时,在遇到水分胁迫的年际,可以通过根灌90 μmol·L-1褪黑素缓解牧草等植物的干旱生理胁迫,本研究对了解褪黑素对紫花苜蓿响应干旱胁迫的机制和田间应用具有一定理论意义。
