基于“时空特点”探讨电针预处理对脑缺血大鼠钠钙交换体1的影响
2024-02-01宁文华张宝瑜张丽丽樊小农张亚男
宁文华,李 礼,3△,张宝瑜,杨 沙,张丽丽,樊小农,沈 燕,4,张亚男,王 舒
1.天津中医药大学第一附属医院,天津 300381;2.国家中医针灸临床医学研究中心,天津 300381;3.天津市针灸学重点实验室,天津 300381;4.国家中医药管理局脑病针刺疗法重点研究室,天津 300381;5.天津市中医药研究院附属医院,天津 300120
脑卒中是世界第二大致死因素、第三大致残因素,缺血性脑卒中占80%[1]。重组组织纤溶酶原激活剂仍是唯一批准用于治疗缺血性脑卒中的药物,但在临床实践中却因其治疗时间窗窄(4.5 h内)、严格的禁忌症以及治疗过程中可能存在的并发症(颅内出血等)而无法使更多人受益[2-3];动物模型中显效的卒中神经保护药物,在进行临床转化过程中却均以失败告终[4]。因此,继续探索治疗缺血性脑卒中的有效措施是神经科学领域关注的重点课题。寻找预防脑卒中首次发生的最佳方案是卒中研究任务的重中之重[5]。课题组前期已证实[6],缺血前重复刺激大鼠“百会”、双侧“内关”和“三阴交”可以抑制神经细胞凋亡,发挥脑保护作用,然而其具体作用机制尚未完全阐明。
Ca2+超载是缺血性神经元死亡的主要因素[7],降低细胞内Ca2+浓度可以发挥神经保护作用[8]。钠钙交换体(Na+/Ca2+exchanger,NCX)作为分布于细胞质膜上的双向膜离子转运体,由于其高转运能力是神经元Ca2+外排的主要途径。NCX1是NCX中最重要的亚型,通过调控NCX1表达及活性,在缺血性脑卒中的治疗中具有关键作用[9],可作为卒中干预的潜在靶标[10]。本实验在前期明确电针预处理脑保护效应的基础上,选择细胞质膜Ca2+外排关键通道NCX1为切入点,进一步观察电针预处理对脑缺血不同时间点、不同缺血区域NCX1表达的影响,探讨电针预处理脑保护的可能机制。
1 材料与方法
1.1 实验动物及分组
清洁级SD(Sprague-Dawley)大鼠,5~6周龄,雄性,体质量230~250 g,均购自于北京维通利华实验动物技术有限公司。实验动物饲养于中国科学院放射医学研究所,符合(Specefic Pathogen Free,SPF)级标准,饲养温度(22±2)℃,相对湿度(55±15)%,12 h/12 h明暗交替,自由饮水及进食。实验大鼠随机分为假手术组、模型组与电针组,每组再分0、1、2和24 h亚组,每亚组各7只。假手术组、模型组0 h于手术后立即断头取脑,电针组0 h于末次干预后立即取材,其余1、2和24 h时间点均于造模结束后开始计时。所进行动物实验经天津中医药大学实验动物伦理委员会批准(审批号:TCM-LAEC2019019)。
1.2 仪器和试剂
1.2.1 仪器 韩氏神经穴位刺激仪(南京济生);激光多普勒血流仪DRT4(美国惠普公司);大鼠脑槽(深圳瑞沃德);针灸针(北京汉医);线栓(深圳瑞沃德);异氟烷(深圳瑞沃德);超声波细胞粉碎机(宁波新芝);小型台式高速冷冻离心机(美国ThermoFisher);电泳仪(美国Bio-Rad);多功能成像仪(德国耶拿);多功能脱色摇床(美国ThermoFisher);生物组织脱水机(浙江金华科迪);生物组织包埋机(浙江金华科迪);切片机(德国Leica)。
1.2.2 试剂 高效RIPA裂解液(北京索莱宝);BCA蛋白定量试剂盒(武汉博士德);SDS-PAGE凝胶制备试剂盒(武汉博士);彩虹广谱蛋白Marker(北京索莱宝);20TBST缓冲液(北京索莱宝);5%脱脂牛奶(美国BD);兔抗NCX1单克隆抗体(美国Abcam);小鼠抗NCX1单克隆抗体(美国Abcam);小鼠抗β-actin抗体(北京中杉金桥);HRP标记山羊抗兔IgG抗体(北京全式金);HRP标记山羊抗小鼠IgG抗体(北京全式金);PVDF膜(美国Millipore);ECL化学发光液(美国Millipore);无水乙醇(天津化学试剂厂);二甲苯(天津化学试剂厂);柠檬酸钠抗原修复液(北京索莱宝);鼠组化二抗试剂盒(北京中杉金桥);苏木素染液(北京索莱宝);中性树胶(北京索莱宝);4%组织固定液(北京索莱宝)。
1.3 干预方法
采用自制鼠衣束缚实验大鼠,并用胶带固定于实验台上,确保大鼠腹部朝上,充分暴露针刺部位,见图1。电针预处理穴位选取大鼠“百会”、双侧“内关”“三阴交”。根据《实验针灸学》[11]大鼠穴图谱进行定位,“百会”(GV20)取大鼠顶骨正中点,沿皮向后斜刺2 mm;“内关”(PC6)取大鼠前肢内侧,腕关节上3 mm左右的尺桡骨之间,直刺2 mm;“三阴交”(SP6)取大鼠后肢内踝尖上5 mm,直刺1.5 mm。电针预处理参数为疏密波,频率2/15 Hz,强度1 mA,时间20 min。1次/d,连续5 d,于末次电针2 h后制备模型。

图1 电针干预示意图
1.4 造模方法
通过线栓法阻闭大脑中动脉,构建大鼠永久性脑缺血模型,具体操作方法:①实验大鼠于术前12 h禁食不禁水。采用异氟烷气体吸入性麻醉(4%诱导,2%维持)。待麻醉起效后于大鼠头皮正中切一2 cm开口,钝性分离皮下组织、骨膜,暴露冠状缝和矢状缝,将激光多普勒血流仪(DRT4)探头固定于冠状缝后4 mm,矢状缝向右旁开3 mm处,用以监测局部脑组织血流量的变化;②将实验大鼠以仰卧位固定于鼠板上,颈前皮肤备皮、消毒,于颈部正中行2 cm切口,钝性分离颈前组织,充分暴露颈总动脉、颈外动脉和颈内动脉;③尼龙绳结扎右侧颈总动脉、颈外动脉后,动脉夹夹闭右侧颈内动脉,用弯针于颈总动脉开一小切口;④将线栓由颈总动脉缓慢插入大脑中动脉,并通过血流仪观察血流阻闭情况,当脑血流趋于稳定后较基线值降低70%视为造模成功,见图2;⑤结扎固定线栓,逐层缝合颈前肌肉,碘伏消毒,将大鼠移至恒温箱,苏醒后移至饲养笼。
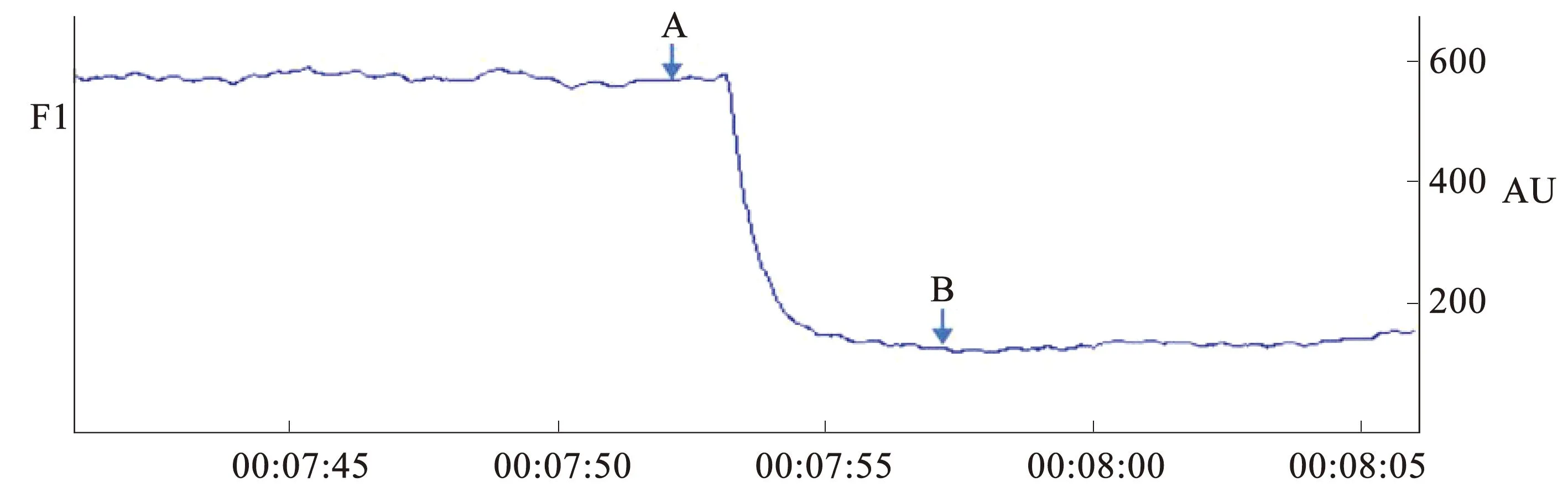
注:A点标记处为基线血流值,B点标记处为线栓阻塞后血流值。
1.5 观察指标及检测方法
1.5.1 免疫组化法观察大鼠缺血区、非缺血区皮层NCX1阳性细胞数 大鼠异氟烷吸入性麻醉后仰卧位固定于鼠板,剪开胸腔,充分暴露心脏,剪开右心耳,快速推注生理盐水,而后推注4%多聚甲醛,至四肢抽动。灌注结束后,断头取脑并置入4%多聚甲醛中固定。石蜡包埋、切片(4 μm)和脱蜡。将切片置于高压锅中用0.1%柠檬酸钠抗原修复。PBS冲洗5次,每次2 min;5%BSA封闭20 min。将稀释好的NCX1(1∶100)一抗滴加于组织上,4 ℃冰箱过夜;次日用PBS清洗切片5次,每次5 min,滴加二抗增强剂,室温孵育20 min;再用PBS清洗5次,每次5 min,加二抗(1∶100)室温孵育30 min。用PBS清洗5次,每次5 min,DAB显色,苏木素复染,脱水、透明和中性树胶封片,晾干。在显微镜下进行观察,每张切片于400倍视野下随机选择5个互不重叠视野,采用Image J软件分别计算每个视野中NCX1的阳性细胞数量,取其平均值。
1.5.2 Western blot法检测大鼠缺血区、非缺血区NCX1蛋白表达 大鼠麻醉断头取脑,提取前述位相应区域皮层脑组织,加入含PMSF蛋白酶抑制剂的RIPA裂解液,使用超声匀浆机匀浆、离心,而后吸取上清,进行蛋白定量。计算蛋白样品浓度之后,加入5蛋白上样缓冲液,跨膜蛋白变性条件为37 ℃,15 min。采用10%SDS-PAGE凝胶进行电泳,将蛋白转移至PVDF膜上,5%脱脂奶粉室温摇床封闭1 h,分别加入β-actin(1∶2 000)、NCX1(1∶2 000)一抗,4 ℃孵育过夜。次日将抗体孵育盒从冰箱取出,室温摇床复温1 h。TBST缓冲液清洗PVDF膜,3次,每次10 min。清洗结束后,加入HRP标记山羊抗兔IgG二抗(1∶5 000),室温摇床孵育1 h,之后再次置于TBST缓冲液中,洗3次,每次10 min。随后加入ECL化学发光液,使用多功能成像仪显影。用Image J软件对蛋白条带进行灰度值分析,以目的条带灰度值与内参灰度值比值,作为各样本相对表达量结果进行分析。
1.6 统计学处理

2 结果
2.1 电针预处理对MCAO大鼠缺血区皮层NCX1阳性细胞表达的影响
NCX1在细胞膜阳性表达,3组间0 h时相NCX1蛋白阳性表达比较差异无统计学意义(P>0.05);与同时相假手术组比较,模型组1 h、2 h和24 h时相NCX1蛋白阳性表达显著降低,差异具有统计学意义(P<0.01);电针组NCX1蛋白阳性表达于1 h、2 h时显著高于同时相模型组比较,差异具有统计学意义(P<0.05),24 h时与同时相模型组,差异无统计学意义(P>0.05);提示电针预处理可上调缺血区皮层1 h、2 h时相NCX1蛋白阳性表达。见图3、表1。
表1 各组大鼠不同时相缺血区皮层NCX1阳性细胞表达个数比较
2.2 电针预处理对MCAO大鼠缺血区皮层NCX1蛋白表达的影响
3组间0 h时相NCX1蛋白表达差异无统计学意义(P>0.05);模型组NCX1蛋白表达于1 h后开始降低,1 h、2 h和24 h均低于同时相假手术组,差异具有统计学意义(P<0.01);电针组NCX1蛋白表达于1 h、2 h显著高于同时相模型组,差异具有统计学意义(P<0.05或P<0.01),24 h时与同时相模型组,差异无统计学意义(P>0.05);提示电针预处理可上调缺血区皮层1 h、2 h时相NCX1蛋白表达。见图4、表2。
表2 各组大鼠缺血区皮层NCX1蛋白表达比较
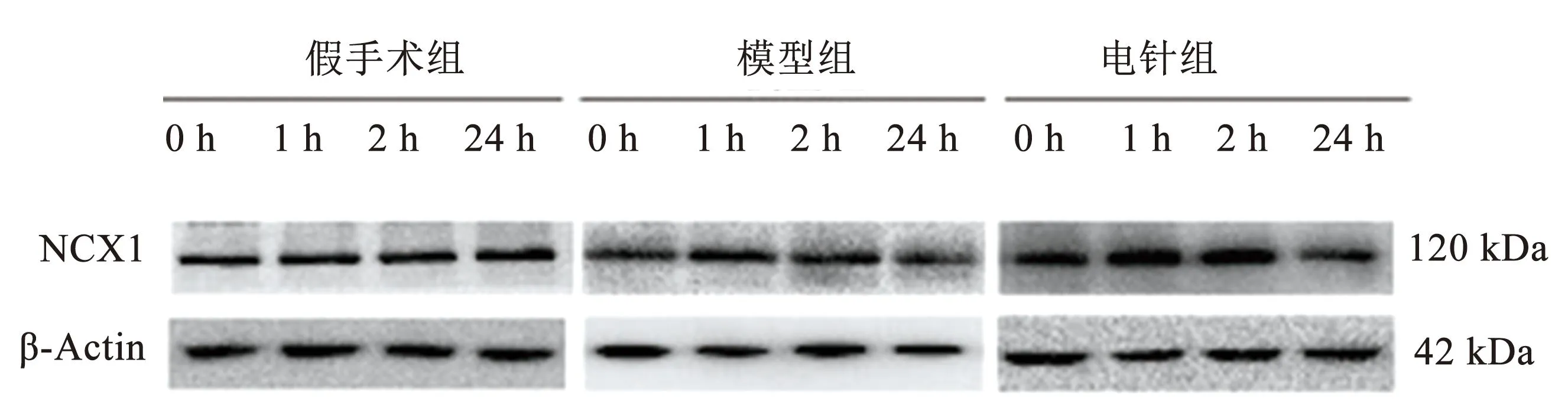
图4 各组大鼠不同时相缺血区皮层NCX1蛋白表达电泳图
2.3 电针预处理对MCAO大鼠非缺血区皮层NCX1阳性细胞表达的影响
由图5可见NCX1在细胞膜阳性表达,3组间0 h时相NCX1蛋白阳性表达比较差异无统计学意义(P>0.05);与同时相假手术组比较,模型组2 h、24 h时相NCX1蛋白阳性表达显著降低,差异具有统计学意义(P<0.05);电针组2 h、24 h时NCX1蛋白阳性表达明显高于同时相模型组,差异有统计学意义(P<0.05);提示电针预处理可上调非缺血区皮层2 h、24 h时相NCX1蛋白阳性表达。见图5、表3。
表3 各组大鼠不同时相非缺血区皮层NCX1阳性细胞表达个数比较
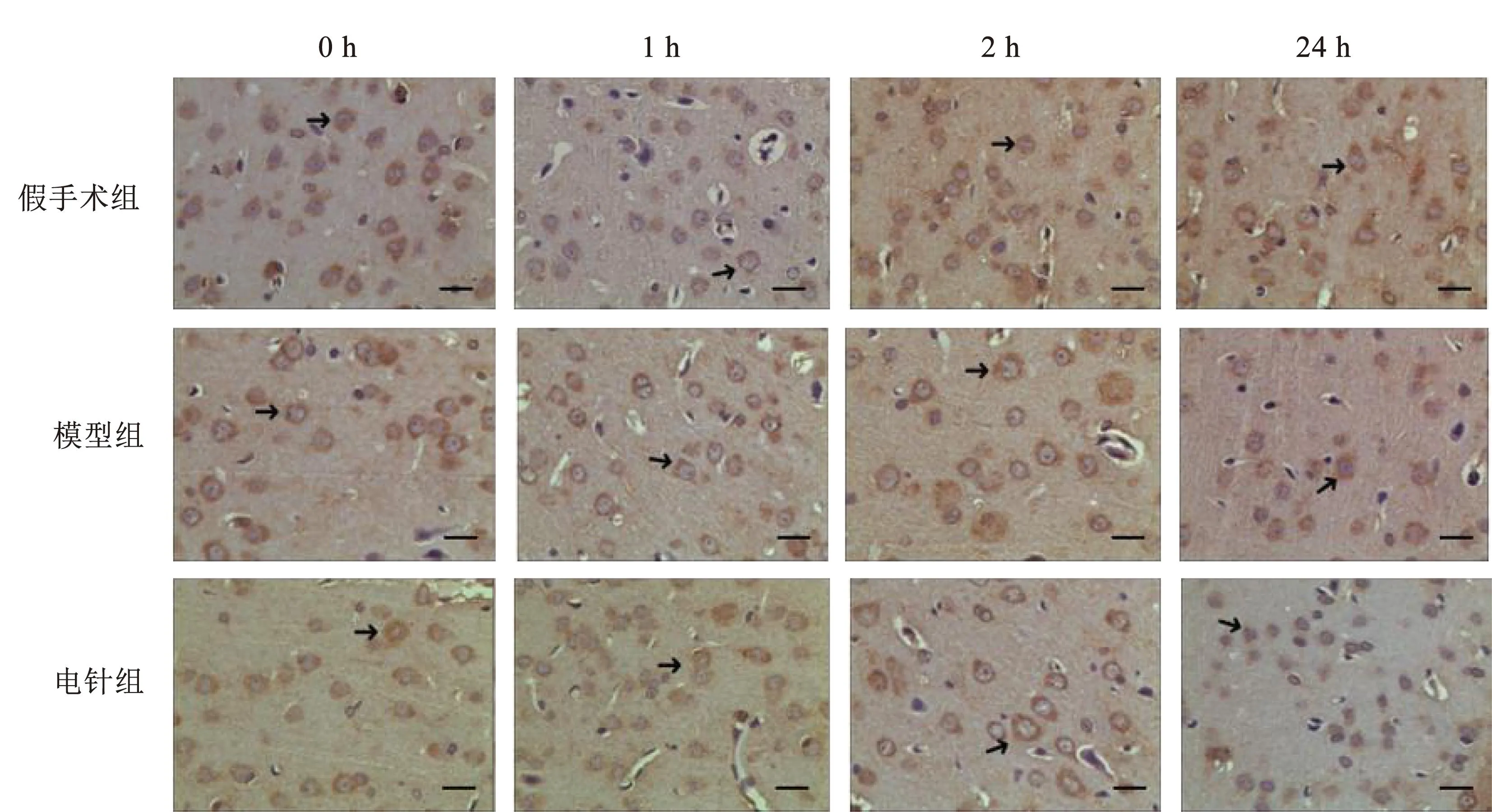
图5 各组大鼠不同时相缺血区皮层NCX1阳性细胞分布(400×)
2.4 电针预处理对MCAO大鼠非缺血区皮层NCX1蛋白表达的影响
3组间0 h时相NCX1蛋白表达比较差异无统计学意义(P>0.05);与同时相假手术组比较,模型组NCX1蛋白表达于2 h、24 h显著降低,差异具有统计学意义(P<0.01),电针组可上调2 h、24 h时NCX1蛋白表达,与同时相模型组比较,差异具有统计学意义(P<0.01);提示电针预处理可上调非缺血区皮层2 h、24 h时相NCX1蛋白表达。见图6、表4。
表4 各组大鼠非缺血区皮层NCX1蛋白表达比较

图6 各组大鼠不同时相非缺血区皮层NCX1蛋白表达电泳图
3 讨论
Ca2+水平的时空控制对于细胞结局至关重要[12]。脑缺血发生后,血流受阻,氧和葡萄糖供应不足,细胞三磷酸腺苷(Adenosine triphosphate,ATP)降低,Na+/K+ATPase难以维持正常的电化学梯度,导致神经细胞去极化,细胞内离子稳态失衡,Ca2+浓度升高[8],触发下游神经毒性级联,最终导致细胞死亡。而促进Ca2+外排有助于神经元存活并减轻脑缺血损伤[13]。NCX是细胞质膜上负责Ca2+外排的主要途径,维持Ca2+外排,以平衡细胞去极化或细胞内Ca2+释放过程中引起的Ca2+瞬变[12],通过调控其表达及活性可以改善脑缺血损伤。NCX1是NCX中最重要的亚型,与脑保护效应密切相关。本研究通过构建永久性脑缺血模型,以细胞质膜Ca2+外排关键通道NCX1为切入点,分别从时间、空间角度探讨电针预处理调控NCX1应答的作用机制。
针灸治疗缺血性脑卒中疗效确切[14],电针作为传统针灸与现代电刺激的结合,具有简便、稳定和安全等特点,在缺血性脑卒中的临床治疗中应用广泛[15]。百会穴位于巅顶,属督脉,有升补人体阳气、调神醒脑的作用,是治疗中风的常用穴位[16]。内关穴为手厥阴心包经络穴,是醒脑开窍针法的主穴。三阴交穴属于足太阴脾经,为足三阴经交会穴,具有调理肝脾肾三脏功能,可以滋补肝肾,调理气血。卒中前进行电针预处理旨在鼓舞正气以抗邪,达“正气存内,邪不可干”之效,治宜调神、滋补肝肾和调理气血。
针刺所引起机体机能活动的改变可以视作一种人体的负反馈调控现象。在正常状态下针刺预处理并不会改变机体的机能状态,针刺的负反馈是在病理损伤之后出现,并可缩短针刺效应潜伏期、促进针刺效应的发挥[17]。首先,由于尚不清楚电针预处理对NCX1蛋白表达的调节是始于缺血前的预处理还是缺血后的应激反应,因此本研究设置0 h时间点用以明确电针预处理对NCX1调节起始的时间节点,结果可以发现,在缺血区及非缺血区,电针预处理对缺血前NCX1蛋白表达影响并无统计学差异,其明显改变始于损伤之后,原因可能在于电针预处理的作用始于缺血应激后产生,表现为提高缺血后应对组织损伤的能力。但值得注意的是,各个区域0 h时相电针组NCX1蛋白表达与同时相假手术组相比,仍存在一定的降低趋势,是否可以考虑电针预处理能够在一定程度上使脑组织适应血流低灌注状态,促使细胞维持低Ca2+外排机能,从而提高脑组织易损伤阈值来诱导缺血耐受,后续可以针对此现象继续探索。
由于蛋白质合成活性的区域性差异,不同区域NCX1变化有所不同。大脑的主要动脉区域是通过侧支循环连接起来的,因此在缺血区内存在组织灌注的异质性,脑血管的闭塞会导致脑内血流量的减少,缺血组织的严重程度从血管供血区域的外围向中心部分增加。缺血区距离侧支血供最远且脑血流降低最严重,随着ATP的迅速降低,该区域组织活性受损,大量细胞丢失,快速发展为不可逆损伤[18]。事实上,缺血事件的发生并不会只影响某单一区域,对于脑整体功能网络的恢复,应关注大脑整体结构[19-20]。大脑皮层是由高度相互关联的神经细胞组成,各脑区之间依靠神经纤维联系为紧密的脑功能网络,与组织损伤相连的对侧非缺血区域,由于代谢不足、神经血管解偶联和神经传递异常同样表现出功能受损,其功能状态与脑损伤程度有关[21]。卒中脑功能的恢复在一定程度上受到未受损神经元代偿连接的影响,局灶性脑损伤后,未受损神经元连接发生变化,促使其承担缺血损伤区域的某些功能,而通过刺激对侧非缺血区功能代偿,调整脑功能网络,可有效促进卒中后脑功能重塑[22-23]。往常实验研究普遍将重心关注于缺血侧半脑,对于对侧非缺血区在整个缺血过程中的作用及是否产生变化仍有待进一步阐明。本研究基于整体出发,更系统而全面的观测缺血后大脑不同组织区域的病理变化及电针预处理作用机制。研究发现,缺血区、非缺血区皮层NCX1蛋白表达均呈现不同程度的降低,这可能是其Ca2+外排能力受损的表现,而NCX1表达发生变化,可以体现细胞控制胞内Ca2+能力的改变,其表达水平降低,影响细胞Ca2+外排效能,导致Ca2+超载甚至神经元死亡[24]。电针作用的整体性特点决定电针作用的发挥重点在于调控大脑整体应答模式。对于脑组织损伤发展迅速的严重缺血区域即缺血区,NCX1蛋白表达于缺血后1 h开始降低,2 h即达到最低值,而电针预处理的作用只维持在2 h内,2 h后其效应持续降低,至24 h时间点与同时相模型组相比无明显差异。这种现象可能是由于缺血区病理进展迅速,离子稳态快速破坏,破坏该区域NCX1蛋白合成,NCX1表达快速降低,Ca2+外排受损并在胞内堆积,而该区域组织损伤的不可逆性,可能是造成电针预处理作用短暂的主要原因。对侧非缺血区皮层NCX1蛋白表达同样发生改变,迟于缺血区域,于2 h后开始降低并持续到24 h,仍低于正常水平,可能是非缺血区失代偿的表现。电针预处理可上调非缺血区皮层NCX1表达,使之始终维持于正常水平,有助于缺血损伤后脑功能恢复。
综上所述,脑缺血后NCX1蛋白随着时间及空间的不同而呈现出不同的降低趋势,电针预处理调控不同区域NCX1蛋白表达模式,可能是其脑保护作用途径之一。
