降钙素基因相关肽在胃溃疡模型小鼠穴位敏化中的作用研究
2024-02-01杨雪郑璇袁伟吴宇蔚刁志君薛思梦乔海法
杨雪,郑璇,袁伟,,吴宇蔚,,刁志君,薛思梦,乔海法,
(1.陕西中医药大学,咸阳 712046;2.陕西省针药结合重点实验室,咸阳 712046;3.陕西省中医药管理局,咸阳 712046)
穴位,是脏腑-经络之气输布于体表的特殊部位。其可根据机体的病理状态[1],发生从“静息态”向“激活态”的可塑性转变,即穴位敏化[2-3]。研究[4]表明,降钙素基因相关肽(calcitonin gene-related peptide,CGRP)在神经源性炎症和伤害性痛觉敏化过程中发挥重要作用。CGRP 是由37 个氨基酸组成的肽类神经递质,主要表达在外周神经Aδ和C 纤维,大多数内脏感觉传入纤维以及脊髓后角的浅层[5],其可通过影响外周和中枢敏化过程来调节穴位敏化的发生[6-8]。在外周神经系统中,背根神经节(dorsal root ganglion,DRG)神经元是合成CGRP 的主要部位[9]。这些神经元可同时接收来自皮肤、肌肉等外周体表和内脏组织传递的伤害性信息,并在DRG 神经元内进行信息整合,再传递到脊髓背角和更高级中枢,实现外周信号向中枢的传递[10]。当内脏病变时,内脏感觉传导纤维将痛觉信息传递给DRG 神经元,使之兴奋性异常升高,促使外周末梢释放CGRP、P 物质和炎症因子等,介导了痛觉信号的传导敏化和体表神经源性炎性反应的发生[11],提示CGRP是参与脏腑相关体表神经源性炎性反应的主要物质。急性胃炎模型体表敏化点的CGRP 表达增加[8],CGRP 是否介导了慢性胃溃疡介导的体表穴位敏化发生却并不清楚。因此,本研究通过使用冰乙酸建立小鼠胃溃疡模型,观察胃部损伤小鼠体表穴位敏化的分布和规律,以及体表敏化点、DRG 神经元和脊髓节段CGRP 的蛋白和荧光蛋白阳性表达情况,有助于从分子生物学的角度阐明CGRP 与胃溃疡模型小鼠体表敏化的关系、效应及机制,为解释穴位敏化的生物学机制提供实验证据。
1 材料与方法
1.1 实验动物与分组
选用清洁级健康雄性C57BL/6 小鼠30 只,体质量(22±3)g,所有动物均购于西安交通大学医学实验中心,许可证号为SCXK(陕)2018-001。在陕西中医药大学针药结合创新研究中心动物房饲养。动物房温度22~24 ℃,湿度50%~60%,12 h 昼夜交替照明,小鼠自由饮食、饮水。小鼠适应性饲养1 周后,随机将小鼠分为对照组、模型组两组,每组15 只。
1.2 主要试剂与仪器
伊文思蓝(evans blue,EB)染色液、苏木素-伊红染色液(hematoxylin-eosin staining,HE)(西安灏洋生物有限公司),抗CGRP 抗体(D5R8F,美国CST 公司),β-actin(AC026,武汉爱博泰克生物科技有限公司);山羊抗兔免疫球蛋白 G(H+L),辣根过氧化物酶(EK020,西安壮志生物科技有限公司);Alexa Fluor 647 驴抗兔荧光二抗(34213ES60,上海翊圣生物科技有限公司);冰冻切片机(美国Thermo Fisher),莱卡显微镜(德国Leica),电泳仪、化学发光成像系统(美国BioRad);足底触觉测痛仪(意大利Ugo Basile),足底热痛仪(意大利Ugo Basile),电子von Frey(美国IITC)。
1.3 模型制备
小鼠术前12 h 禁食不禁水,异氟烷麻醉后于腹部切开皮肤暴露胃,以0.05 mL冰乙酸溶液于胃小弯近幽门处注射到胃壁肌层近黏膜下层,胃壁即出现圆形隆起并逐渐变为乳白色,直径约为5 mm。逐层缝合腹壁再进行碘伏消毒,构建小鼠胃溃疡模型[12]。对照组采用同法注射相同剂量生理盐水溶液。模型鉴定标准为可见小鼠精神萎靡,行动缓慢,身体蜷缩,拉柏油样便;并对小鼠胃部组织做HE 染色[13]。
1.4 胃溃疡模型小鼠体表敏化部位检测
造模前1 d将小鼠全身轻柔脱毛,造模完成后尾静脉注射0.5% EB 溶液(0.1 mL/10 g)。注射2 h 后观察小鼠体表EB 渗出点[14],并记录敏化点的数量和分布位置,在小鼠体表图中标记。
1.5 脊髓神经节段参与慢性胃溃疡引起体表痛敏行为学实验
为研究慢性胃溃疡是否可以引起脊髓节段的体表牵涉痛敏,通过体表机械压力痛[15]、足底机械痛、热痛来检测小鼠对照组和模型组的压痛阈变化[16]。机械压力痛检测时先用记号笔标记小鼠T1~T13脊髓节段,使用测痛仪按压各组小鼠脊髓节段处的敏化点;足底机械痛检测时用测痛仪在小鼠左右后足按压;热痛检测时将光源放置在小鼠左右后足下方。分别于造模后1、3、6 d 进行测试,并观察小鼠有明显躲避样行为时记录压痛阈值,每个敏化点或后足部位测3 次取平均值。
1.6 小鼠胃组织病理学观察
每组随机抽取5 只小鼠在术后6 d 取材,0.9%生理盐水和4%多聚甲醛溶液灌流。取胃组织放入4%多聚甲醛后固定 24 h,OCT 包埋组织,常规冰冻切片(厚度16 μm),HE 染色。HE 染色步骤为先将切好的组织的载玻片架子置于1 000 mL 的烧杯中,用自来水冲洗干净,滴加苏木素1 min,纯水冲洗干净,接着滴加伊红2 min,震荡后冲洗干净,75%乙醇震荡1 min,85%乙醇震荡 1 min,95%乙醇震荡 1 min,无水乙醇浸泡2×2 min,二甲苯固化3×2 min,最后中性树胶封片,在显微镜下观察胃组织形态。
1.7 蛋白质印迹(Western blot,Wb)法观察穴位敏化后脊髓、DRG 及皮肤中CGRP 蛋白相对表达量
造模后6 d,随机抽取每组5 只小鼠麻醉,背部剃毛,剪开小鼠皮肤和肌肉,暴露出胸椎段,剪除棘突和椎板,在冰上操作,迅速剥离T9~T11脊髓和DRG,并取皮肤,分别加入RIPA裂解液,用BCA法蛋白定量,20 ℃保存蛋白样本备用。选用15% SDS-PAGE 凝胶电泳分离,然后将蛋白质转移到PVDF 膜上;用5%的脱脂奶粉室温封闭2 h;一抗(CGRP1:1 000,β-actin1:1 000)4 ℃过夜孵育;二抗(1:20 000)室温孵育2 h;使用ECL 显影。采用Image J 读取灰度值进行分析测定。
1.8 免疫荧光染色法观察穴位敏化后脊髓、DRG 及皮肤中CGRP 阳性表达
造模后6 d,各组剩余5 只小鼠麻醉,0.9%生理盐水和4%多聚甲醛灌流。取脊髓T9~T11节段、DRG 及皮肤组织放入4%多聚甲醛后固定24 h,用OCT 包埋,常规冰冻切片(厚度16 μm)。驴血清封闭2 h,CGRP 抗体(1:500)4 ℃过夜,二抗(1:500)室温孵育2 h,抗荧光衰减封片剂(含DAPI)封片,荧光显微镜下拍照,Image J 进行整理和分析视野阳性细胞荧光强度。
1.9 统计学方法
采用GraphPad Prism 9 和SPSS25.0 统计软件进行分析。符合正态分布的计量资料用均数±标准差表示,比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组小鼠胃组织形态学比较
HE 染色后对照组小鼠胃组织比较完整,病理切片未见明显异常,而模型组小鼠胃组织水肿,炎性细胞增多,表面上皮分界明显加重,上皮细胞丢失。结果表明慢性胃溃疡模型小鼠造模成功。详见图1。

图1 两组小鼠胃组织形态学比较(×40)
2.2 两组小鼠体表穴位敏化结果比较
对照组小鼠体表EB 渗出点分布稀疏分散,无主要集中区域。而模型组小鼠EB 渗出点分布涉及脊髓T1~T13节段体表支配区域,其中以T9~T11节段体表支配区域中胆俞、脾俞、胃俞和脊中穴位分布最为集中。提示,小鼠体表EB 渗出点数目与胃部炎性程度成正比,且其分布规律与内脏组织损伤部位所对应的体表支配区域一致。详见图2。

图2 两组小鼠体表渗出点分布比较(n=10)
2.3 两组小鼠体表痛敏行为学实验结果比较
与对照组比较,模型组小鼠在造模后6 d的体表敏化区机械痛阈值、后足机械痛阈值和热痛阈值均显著降低(P<0.01)。提示慢性胃溃疡小鼠会出现牵涉性痛敏化现象,其脊髓T9~T11节段体表支配区域痛觉阈值降低、兴奋性增强、感受野扩大,可能与胃部损伤引起的体表神经源性炎性反应有关。详见图3。
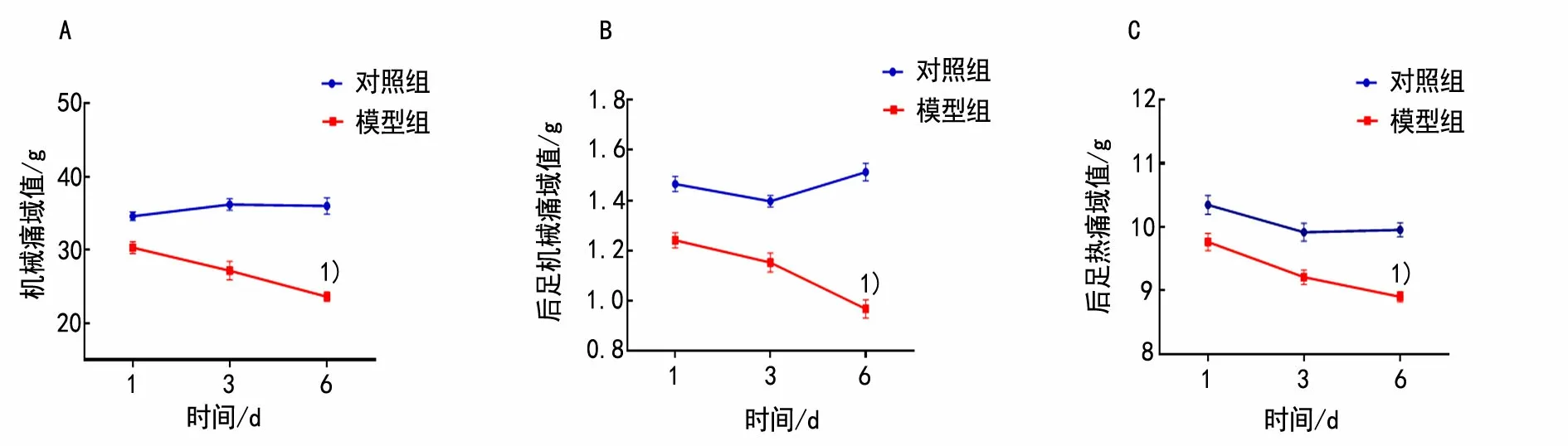
图3 两组小鼠体表痛敏行为学实验结果比较(±s,n=10)
2.4 两组小鼠脊髓中CGRP蛋白含量和CGRP荧光蛋白阳性表达比较
与对照组比较,模型组小鼠脊髓T9~T11节段中的CGRP 蛋白含量显著升高(P<0.01)。免疫荧光结果显示,与对照组比较,模型组小鼠脊髓中的CGRP 荧光蛋白阳性表达也显著高于对照组(P<0.01)。详见图4。

图4 两组小鼠脊髓中CGRP 蛋白含量和CGRP 荧光蛋白阳性表达比较(±s,n=5)
2.5 两组小鼠DRG 中CGRP 蛋白含量和CGRP 荧光阳性表达比较
Wb 结果显示,与对照组比较,模型组小鼠DRG 中的CGRP 蛋白含量显著升高(P<0.01)。免疫荧光结果显示,与对照组比较,模型组小鼠DRG中的CGRP荧光蛋白阳性表达显著高于对照组(P<0.01)。详见图5。

图5 两组小鼠DRG 中CGRP 蛋白含量和CGRP 荧光蛋白阳性表达比较(±s,n=5)
2.6 两组小鼠皮肤中CGRP蛋白含量和CGRP荧光阳性表达比较
Wb 结果显示,与对照组比较,模型组小鼠皮肤中的CGRP 蛋白含量显著升高(P<0.01)。免疫荧光结果显示,与对照组比较,模型组小鼠皮肤中的CGRP 荧光蛋白阳性表达也显著高于对照组(P<0.01)。详见图6。

图6 两组小鼠皮肤中CGRP 蛋白含量和CGRP 荧光蛋白阳性表达比较(±s,n=5)
3 讨论
胃溃疡是常见的消化系统疾病之一[17],临床多表现为节律性反复发作的胃脘部疼痛。本研究通过在小鼠胃壁注射冰乙酸,诱使其胃部组织水肿,炎性细胞增多,表面上皮分界明显加重,上皮细胞丢失,构建了符合胃溃疡典型病理特征的动物模型。研究结果表明,小鼠胃部损伤后,可诱导其内脏所对应的体表支配区域产生神经源性炎性反应,使敏化点显著增多,痛觉阈值下降,并使其脊髓T9~T11节段、DRG 神经元和体表敏化区域中的CGRP 阳性表达和蛋白水平显著升高。提示,外周和脊髓的CGRP 表达改变,可能是内脏损伤病理状态下介导穴位敏化的重要分子基础。
体表-内脏反射具有确切的节段性构筑特性[18]。当内脏病变时,体表相应部位会出现节段性的阳性反应,如结节、凹陷、瘀点、皮疹等[19-20]。在动物实验中,通过尾静脉注射EB染料,观察到内脏疾病引起EB在体表渗出[21-23],渗出点呈现神经节段分布并与穴位具有规律性联系,与敏化穴位穴区的血管通透性增加相关[24],这些结果均提示穴位与内脏疾病引起的体表敏化存在高度相关性,即穴位的敏化现象[25]。EB 渗出点的出现表明内脏病变时,穴位处体表局部血管通透性改变,导致神经源性炎性反应[6],这一反应在外周主要是由于C类多型性伤害性感受器的激活引起的,导致局部致痛物质的释放,引起周围血管扩张,进一步引起伤害性感受器敏感性增强,局部出现痛敏点或者痛敏区域。这些痛敏区域和穴位的分布密切相关[26]。同时,EB 渗出的多少可代表C 类纤维末梢的密度[27],穴位和非穴位区的EB渗出点都有C类纤维伤害性反应引起的局部炎性反应,但可能穴位处C 类纤维末梢更加集中,能够激发较多的C 类纤维机械刺激感受器或温度感受器[28],因此敏化状态下穴位较非穴区能够更好地引起机体的反应及治疗效应。动物研究表明,肠炎大鼠的EB 渗出点主要分布在T12~L2节段[29];心肌缺血大鼠的EB 渗出点出现在其左侧背部,并在脊髓T1~T5节段体表支配区域发生规律性的牵涉性的“敏化”反应[30]。急性胃黏膜损伤大鼠的EB 渗出点主要集中在背部T6~T11节段[6,31],而刺激大鼠背部相应的体表皮肤可引起同节段支配的十二指肠和肠道血管运动变化[18]。可见,体表穴位与内脏器官之间具有节段性分布的密切联系,这些敏化反应点的功能状态可能与“穴位”的形成有关。本研究结果显示,胃溃疡小鼠脊髓T9~T11节段体表支配区域出现多个EB 渗出点,而这一敏化区又包括胆俞、脾俞、胃俞、脊中穴等与治疗胃部疾病相关的功能穴位。临床研究表明,压痛反应是腧穴敏化的一种表现,如膝关节骨关节炎患者在鹤顶、梁丘及曲泉穴压痛敏感[32];胃病可在胃俞等穴位触及结节或条索状改变,按压这些穴位均可出现疼痛感[33]。在本研究中,与胃部损伤前相较,小鼠脊髓T9~T11节段体表支配区域及相应穴位敏化点的痛阈值显著降低,兴奋性水平显著升高。说明模型小鼠的胃部炎性反应,可能通过神经源性炎性反应反映在体表相应部位[34-35],并通过体表敏化点兴奋性阈值改变使穴位向激活态发生功能迁移。
大量研究[36]表明,穴位敏化可能与炎性物质的释放有关。石宏等[37]认为穴位敏化可能是由于内脏病变通过轴突反射影响体表,导致体表发生神经源性炎性反应,引起局部致炎致痛物质增高,促进血管扩张和渗出增加,进而出现痛觉敏化。CGRP 作为感觉神经末梢激活导致神经源性扩张反应的主要介质,是介导病理状态下伤害感受器敏化的关键靶分子[38-39]。当内脏组织损伤时,CGRP 会导致伤害性神经元敏化,刺激肥大细胞活化[40-41],作用于炎症细胞后释放大量炎性因子,引起神经源性炎症反应,提高致痛效应,引起血管扩张,导致血浆蛋白渗出,介导体表穴位敏化的发生。如大鼠足跖部重复微量注入CGRP 可诱发外周敏化,使大鼠伤害性机械刺激的反应阈值明显减小[42]。足底注入CGRP受体拮抗剂则可阻断外周神经损伤大鼠痛觉超敏的行为学表征,减轻辣椒素诱发的机械性诱发痛及痛觉过敏[43]。在脊髓水平鞘内注射CGRP 的拮抗剂h-CGRP8-37能够降低多因素诱发的内脏痛觉过敏[44]。因此,脊髓水平CGRP 的释放是伤害性感受信息传递和调控过程中一个重要环节[45],抑制脊髓水平CGRP 的表达或阻止其发挥作用可以降低机体的痛敏反应。本研究观察到胃溃疡小鼠脊髓T9~T11节段对应体表区域的CGRP 蛋白和荧光蛋白阳性表达升高,说明CGRP 的表达改变可能参与了胃溃疡体表穴位微理化环境的状态改变,而这可能与躯体-内脏牵涉痛的会聚易化有关。
牵涉痛的会聚易化理论认为,病变器官和出现牵涉痛的皮肤受到相同的脊神经后根传入纤维支配,从而使同时支配体表和内脏的脊髓后角会聚神经元反应阈值降低、异常放电活动增加、体表感受野扩大等现象[18]。在这一过程中,内脏组织损伤可导致神经生长因子释放并与TrkA受体结合逆行转运至DRG神经元胞体,通过胞内信号级联,使DRG中的CGRP上调,并提高脊髓后角的CGRP 水平[46-47]。因而,尽管CGRP 在DRG 中产生,但最高浓度的CGRP 却出现在脊髓后角的浅层。与此相一致的,在本研究中也观察到脊髓及DRG 中的CGPR 蛋白和阳性表达显著升高,说明了CGRP 参与调节内脏损伤动物模型的中枢敏化过程。
综上,本研究结果提示,慢性胃溃疡模型在胃部对应节段的脊髓和DRG中CGRP表达显著提升可能是导致体表敏化的重要分子基础。本研究从分子生物学角度为阐明CGRP 在胃溃疡小鼠穴位敏化中的作用提供了可靠的实验依据,丰富了“穴位敏化”理论的科学内涵。
