不同诱导剂和诱导方法对西瓜单倍体染色体加倍效果的比较研究
2024-02-01李海伦高宁宁李晓慧康利允常高正王琰王慧颖赵卫星
李海伦 高宁宁 李晓慧 康利允 常高正 王琰 王慧颖 赵卫星







摘 要:为探究不同诱导剂和诱导方法对西瓜单倍体染色体加倍的效果,以西瓜花药离体培养获得的单倍体植株为材料,利用不同质量浓度的秋水仙素和氟乐灵进行培养基加倍、浸芽加倍、滴生长点加倍3种方法研究单倍体植株诱导二倍体植株的效果。结果表明,不同加倍方法对单倍体加倍的诱导率存在很大差异。秋水仙素诱导加倍,植株的存活率均达到100%,氟乐灵诱导加倍,加倍植株的致死率最高达到100%。组培法诱导加倍时,秋水仙素和氟乐灵均在质量浓度为60 mg·L-1时,加倍诱导率最高,分别是50.00%和41.67%。浸芽法诱导加倍时,600 mg·L-1秋水仙素浸芽4 h加倍誘导率最高为75.00%;300 mg·L-1氟乐灵浸芽2 h加倍诱导率最高为50.00%。滴生长点诱导加倍时,600 mg·L-1秋水仙素诱导的加倍率最高为50.00%;500 mg·L-1氟乐灵诱导加倍率最高为27.78%。因此,秋水仙素诱导西瓜单倍体植株加倍效果优于氟乐灵,且浸芽法诱导加倍效果最佳。
关键词:西瓜;单倍体;秋水仙素;氟乐灵;染色体加倍
中图分类号:S651 文献标志码:A 文章编号:1673-2871(2024)01-025-07
Comparative study on chromosome doubling effect of watermelon haploid with different inducers and induction methods
LI Hailun, GAO Ningning, LI Xiaohui, KANG Liyun, CHANG Gaozheng, WANG Yan, WANG Huiying, ZHAO Weixing
(Institute of Horticulture, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China)
Asbtract: In order to investigate the effect of different inducers and induction methods on chromosome doubling of watermelon haploid, the haploid plants obtained from watermelon anther culture in vitro were used as materials. Different concentrations of colchicine and fluralin were used to study the effect of inducing diploid plants from haploid plants by three methods: medium doubling method, germination doubling method and droplet growing point doubling method. The results showed that the induction rate of haploid doubling by different doubling methods varied. The survival rate of plants induced by colchicine doubling reached 100%, and the mortality rate of plants induced by fluralin doubling reached 100%. When induced by tissue culture, the doubling induction rates of colchicine and trifluralin were the highest at a mass concentration of 60 mg·L-1, with 50.00% and 41.67%, respectively. When inducing doubling by soaking the buds with 600 mg·L-1 colchicine for 4 hours, the highest doubling induction rate was 75.00%; the highest doubling induction rate of 300 mg·L-1 fluralin soaking buds for 2 hours was 50.00%. When inducing doubling at the droplet growth point, the highest doubling rate induced by 600 mg·L-1 colchicine was 50.00%; the highest induction doubling rate of 500 mg·L-1 trifluralin was 27.78%. Therefore, the effect of inducing haploid watermelon plants to double with colchicine is better than that with trifluralin, and the soaking method has the best effect on inducing doubling.
Key words: Watermelon; Haploid; Colchicine; Fluralin; Chromosome doubling
西瓜是世界十大水果之一,具有甘甜多汁、清爽解渴的特点,夏季广受消费者的喜爱,使其市场需求量大大增加。西瓜栽培周期短、上市快且经济效益高,已经成为广大农民致富的重要产业[1]。目前优异西瓜品种更新滞后,加上西瓜遗传基础狭窄,常规育种周期长,现有品种已不能满足市场需求,所以扩宽西瓜遗传基础,发掘优异种质,提高西瓜品种改良效率是西瓜育种的首要任务。单倍体育种是一条缩短育种年限、加快育种进程的有效途径。花粉辐射[2]、花药培养[3-4]、大孢子培养[5-6]等都是较为常用的单倍体诱导技术。从20世纪80年代初期起,薛光荣等[7-8]、袁万良等[9]、魏瑛[10]、李娟等[11]、缑艳霞等[12]、朱迎春等[13]研究者就不断地探究西瓜花药离体培养技术,且获得了单倍体植株。单倍体植株需要通过加倍才能用于育种材料和新种质的创制,常用的诱导单倍体加倍的方法有浸芽、浸种、浸根、浸苗、滴生长点和组培法等[14-18],常采用的诱导剂有秋水仙素、氟乐灵、炔苯酰草胺和氨磺灵等,及辅助添加剂二甲基亚砜(DMSO)、吐温等,有助于提高加倍效率。高宁宁等[14]研究表明,辅助添加剂DMSO可以提高甜瓜单倍体的加倍率。适量的诱导剂配合适宜的加倍方法,将有效地提高加倍率。玉米[19]、黄瓜[20]、萝卜[21]、南瓜[22]等作物在不同诱导剂和不同方法的诱导下,均得到很好的加倍效果。目前对西瓜单倍体加倍技术的研究较少,还未见成熟的西瓜单倍体加倍技术的报道。笔者总结了前人研究成功的经验,利用秋水仙素和氟乐灵诱导剂,采用组培法、浸芽法、滴生长点法3种方法对利用西瓜花药离体培养获得的单倍体植株进行加倍,以期建立高效的西瓜单倍体加倍体系,以便快速、高效地获得纯合的自交系优异种质材料,缩短育种年限,加快西瓜优异新品种的选育进程。
1 材料与方法
1.1 材料
试验材料为小果型西瓜斯维特。试验于2022年5—9月在河南省农业科学院园艺研究所组培分子实验室进行,利用西瓜花药离体培养获得的单倍体植株进行扩繁,然后挑选长势一致的扩繁苗来研究不同诱导剂对西瓜单倍体植株加倍的效果。试验材料由河南省农业科学院园艺研究所西甜瓜研究室提供。
1.2 方法
1.2.1 西瓜单倍体植株扩繁 把西瓜花药离体培养获得的单倍体植株接入芽增殖培養基MS+0.15 mg·L-1KT+10%椰汁+30 g·L-1蔗糖+6 g·L-1琼脂(pH 5.80~5.85)中,放入每天光照时间16 h、光照度3000~4000 lx、温度在(25±2) ℃的培养间中进行增殖扩繁培养,用于快速获得大量的单倍体植株,为研究不同诱导剂对西瓜单倍体加倍的效果提供充足的试验材料。
1.2.2 培养基添加法诱导 以培养基MS+0.15 mg·L-1 KT +10%椰汁为基础培养基,在基础培养基中分别添加不同质量浓度的秋水仙素(0、40、60、80、100 mg·L-1)和不同质量浓度的氟乐灵(0、40、60、80、100 mg·L-1)配制成加倍培养基,然后将扩繁的单倍体植株接入加倍培养基中,再在上述培养条件下培养21 d,之后转接到基础培养基中做植株的倍性鉴定。试验共9个处理,每个处理接入4株西瓜单倍体植株,每个处理3次重复,并统计加倍植株存活率。加倍植株存活率/%=成活植株数/处理植株数×100。
1.2.3 浸芽法诱导 先配制不同质量浓度的秋水仙素(0、200、400、600、800 mg·L-1)和不同质量浓度的氟乐灵(0、100、300、500、700 mg·L-1),均以1.5%的DMSO(二甲基亚砜)作为助溶剂,然后过滤灭菌,再将单倍体植株分别在不同质量浓度的秋水仙素中浸泡2、4、6 h和在不同质量浓度的氟乐灵中浸泡2、3、4 h,以1.5%的DMSO浸芽6 h和4 h分别作为秋水仙素和氟乐灵浸芽的对照,浸芽结束后,用无菌水冲洗3遍,每遍1 min,最后控干水分,接入基础培养基中(MS+0.15 mg·L-1 KT +10%椰汁),在上述培养条件中培养21 d。试验共30个处理,每个处理接入4株西瓜单倍体植株,每个处理3次重复,并统计加倍植株存活率。
1.2.4 滴生长点法诱导 用1.5%的DMSO(二甲基亚砜)配制无菌的不同质量浓度的秋水仙素(200、400、600、800 mg·L-1)和不同质量浓度的氟乐灵(100、300、500、700 mg·L-1),然后分别滴加2滴到西瓜单倍体植株的生长点,在1、3、5 d各滴加1次,以滴加1.5%的DMSO作为对照,在上述培养条件中培养28 d。试验共9个处理,每个处理4株植株,每个处理3次重复,并统计加倍植株的存活率。
1.3 植株倍性鉴定
取待测植株最新长出的嫩叶约0.2 g,用细胞裂解液与细胞染色液以体积比1∶4制作细胞悬浮液,用德国PARTEC公司的CyFlowRCube8流式细胞仪上机检测植株的倍性,以斯维特种子苗为参照。统计植株的加倍率,加倍率/%=加倍植株数/处理存活植株数×100。
1.4 数据处理
采用Excel 2016进行数据统计分析,采用SPSS 21进行方差分析,采用Duncan检验法进行多重比较,采用FCS Express V3对流式细胞仪数据进行作图。
2 结果与分析
2.1 植株倍性鉴定
西瓜花药离体培养获得的单倍体植株通过秋水仙素和氟乐灵诱导加倍,将获得加倍的存活植株进行流式细胞仪倍性鉴定分析,鉴定结果如图1所示,以单倍体植株首个呈正态分布的最高峰的荧光强度100为对照,对诱导加倍存活的植株进行鉴定,共得到二倍体和混倍体2种倍性植株。
2.2 培养基添加法对染色体加倍效果的影响
将西瓜花药离体培养诱导的单倍体植株进行增殖培养,把获得的单倍体植株接种到含有不同质量浓度的秋水仙素或氟乐灵的培养基中诱导加倍,鉴定的加倍效果如表1所示。
利用秋水仙素作为诱导剂时,植株的存活率达到100%,生长良好(图2-A),随着秋水仙素质量浓度的增加,二倍体的加倍率呈倒“V”形,先增后降,混倍体的加倍率呈线性增加。当秋水仙素质量浓度为60 mg·L-1时,二倍体加倍率达到最大值50.00%;当质量浓度为100 mg·L-1时,混倍体加倍率最高达到58.33%。利用氟乐灵作为诱导剂时,植株的存活率随着氟乐灵质量浓度的增加而降低,长势较弱(图2-B),当氟乐灵质量浓度为100 mg·L-1时,植株存活率降至75.00%,二倍体和混倍体加倍率的变化趋势与秋水仙素加倍效果一致,二倍体和混倍体最高加倍率的质量浓度与秋水仙素一样,其最高加倍率分别为41.67%和44.44%。试验结果表明,秋水仙素的加倍效果优于氟乐灵,加倍植株的致死率为0,而氟乐灵加倍植株的致死率最高达到25.00%,而且二倍体最高加倍率高出氟乐灵8.33个百分点,所以质量浓度为60 mg·L-1的秋水仙素作为最佳诱导加倍浓度,同时还发现在不添加诱导剂时,二倍体的加倍率也能达到8.33%。
2.3 浸芽法对染色体加倍效果的影响
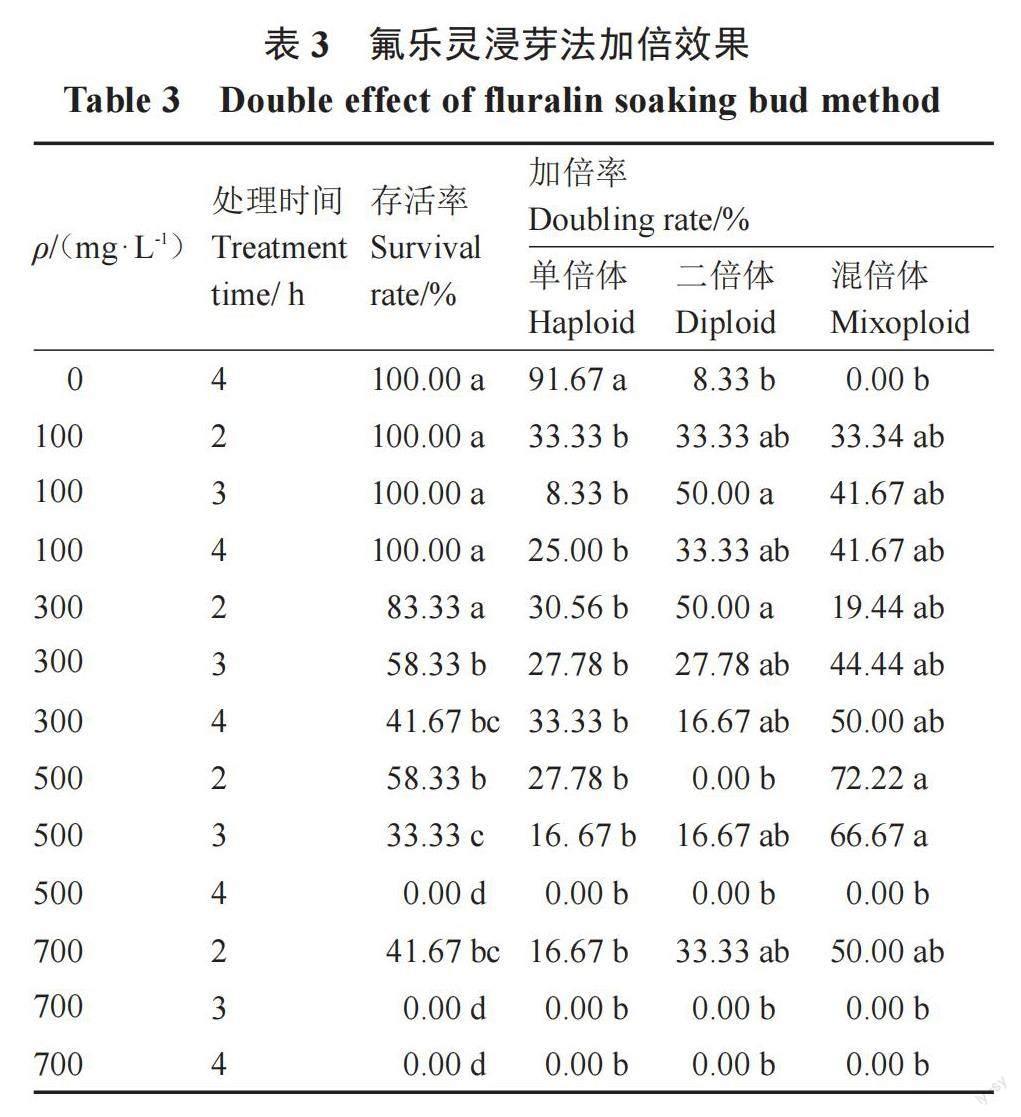
利用不同质量浓度的秋水仙素或氟乐灵对获得的西瓜单倍体芽进行浸芽处理,经流式细胞仪鉴定植株倍性的结果如表2和表3所示,植株的长势如图3所示。秋水仙素诱导二倍体的最高比例(75.00%)高于氟乐灵诱导的最高比例(50.00%)。利用秋水仙素诱导加倍,植株的存活率均达到100.00%,而氟乐灵诱导加倍时植株的致死率最高达100.00%,表明氟乐灵对植株有一定的毒害作用。
由表2可知,当秋水仙素浸芽2 h时,二倍体的加倍率随着秋水仙素质量浓度的增加呈先降低后升高的变化趋势,最高加倍率为58.33%,其中400 mg·L-1秋水仙素浸芽处理未得到二倍体,其混倍体比例高达75.00%;浸芽4 h时,600 mg·L-1秋水仙素浸芽处理二倍体加倍率最高为75.00%;浸芽6 h时,二倍体加倍率与秋水仙素质量浓度的增加呈反比,200~800 mg·L-1秋水仙素浸芽处理使二倍体加倍率由50.00%降至33.34%。
由表3可知,当氟乐灵质量浓度为100 mg·L-1时,二倍体加倍率随着浸芽时间的增加呈现出先升高后降低的变化趋势,浸芽3 h时二倍体加倍率达到最大值50.00%;当质量浓度为300 mg·L-1时,二倍体加倍率与时间的增加呈反比,浸芽2 h时二倍体加倍率最高,为50.00%;当质量浓度为500 mg·L-1时,浸芽2 h时没有获得二倍体,只得到72.22%混倍体;当质量浓度为700 mg·L-1时,只有浸芽2 h的处理有存活植株,得到二倍体加倍率为33.33%。
同时发现在1.5%的DMSO溶液中浸芽6 h也能得到16.67%二倍体,植株的加倍率得到提高,表明DMSO辅助剂对植株加倍具有一定的促进作用。综合植株存活率和加倍率分析可知,秋水仙素诱导加倍效果好于氟乐灵,最佳诱导方法为600 mg·L-1的秋水仙素浸芽4 h。
2.4 滴生长点法对染色体加倍效果的影响
利用不同质量浓度的秋水仙素和氟乐灵对西瓜单倍体植株的生长点滴加诱导剂进行加倍,通过流式细胞仪鉴定的结果如表4所示,加倍植株的生长情况如图4所示。二倍体的最高加倍率只有50.00%,由600 mg·L-1的秋水仙素处理所得。利用秋水仙素诱导液加倍时,植株的存活率都达到了100.00%,而500 mg·L-1的氟乐灵处理时植株的存活率只有58.33%,700 mg·L-1的氟乐灵处理时植株的存活率为0,说明氟乐灵对植株的毒害作用较大。随着秋水仙素质量浓度的增加,二倍体加倍率呈先升高后降低的变化趋势,600 mg·L-1时达到最大值,为50.00%;混倍体一直保持递增的变化趋势,800 mg·L-1时达到最大值,为58.33%。随着氟乐灵质量浓度的增加,二倍体和混倍体加倍率均呈先升高后降低的变化趋势,但二倍体的加倍率低于秋水仙素处理,最高加倍率只有27.78%,500 mg·L-1时混倍体的加倍率最高,达到61.11%。试验结果表明,滴生长点加倍的最佳方案为600 mg·L-1秋水仙素。
3 讨论与结论
多倍体诱导时常用的诱导剂主要有秋水仙素、除草剂类物质(氟乐灵)、植物激素(激动素)等化学诱变剂,这些诱导剂对处在分裂旺盛期的细胞都具有一定的影响,能抑制细胞有丝分裂,从而使染色体加倍,同时添加DMSO等辅助剂,将会有效地提高植株加倍率。其中秋水仙素是典型的诱导剂,在苹果[23]、黄瓜[20]、非洲菊[24]等很多种作物上都取得了一定成果,而氟乐灵作为诱导剂的使用范围相对狭隘。笔者利用秋水仙素和氟乐灵2种化学诱变剂对单倍体西瓜进行诱导加倍,结果表明,秋水仙素诱导加倍的植株存活率均达到100.00%,且长势良好;氟乐灵诱导的加倍植株致死率最高达到100.00%,且呈现出一种病态的长势。秋水仙素诱导二倍体的最高加倍率为75.00%,高于氟乐灵诱导二倍体的最高加倍率50.00%。李丽[25]在诱导萱草多倍体的研究中,发现秋水仙素和氟乐灵的诱导率没有明显区别,而褚丽红等[26]对安祖花的研究结果表明,氟乐灵的诱导效果好于秋水仙素,可能与不同的植物对不同诱导剂的敏感程度存在差异有关,但具体原因还有待进一步研究。笔者还发现在不添加任何诱导加倍剂的条件下,在含有激素KT、椰汁等基础培养基中诱导也能得到8.33%的二倍体,在通过1.5%DMSO处理后再接入基础培养基诱导,二倍体的诱导率能达到16.67%,说明KT具有一定的加倍功效,DMSO具有辅助提高植株加倍率的功能,朱惠琴[27]在烟草上的研究也表明DMSO对加倍具有促进作用。
多倍体诱导的效果与诱导方法有着直接的关系。常用的有浸芽、浸种、浸根、浸苗、滴生长点和组培法等多种诱导方法。笔者利用不同质量浓度的秋水仙素和氟乐灵2种诱导剂通过不同的诱导方法,诱导的二倍体加倍率在0~75.00%。在培养基添加法诱导加倍过程中,二倍体的加倍率随着2种诱变剂质量浓度的增加均表现先升高后降低的变化趋势,均在60 mg·L-1时达到最大值,分别为50.00%、41.67%,均高于高宁宁等[14]的培养基添加法(37%)。浸芽法诱导加倍时,600 mg·L-1秋水仙素浸芽4 h时达到二倍体最高加倍率75.00%,300 mg·L-1氟乐灵浸芽2 h得到最高二倍体加倍率50.00%。从最佳诱导效果上來看,秋水仙素在质量浓度和浸芽时长上都要高于氟乐灵,而氟乐灵在植株长势和诱变率上都低于秋水仙素,在李丽[25]的研究中秋水仙素处理时长同样高于氟乐灵处理,但诱导率却没有明显的差异,可能是不同作物的倍性与诱变剂的剂量和处理时间有关。滴生长点诱导加倍法的研究比较少,在李勤菲等[17]对芸薹属3种单倍体染色体加倍中有研究报道,在笔者的研究中不同质量浓度的秋水仙素滴生长点诱导二倍体加倍率均高于氟乐灵,诱导率最高为50.00%,但2种诱变剂的诱导率均高于李勤菲等[17]的17.54%的加倍率,可能是不同的作物对不同质量浓度的诱变剂的敏感程度不同。
植物染色体倍性的改变是一个复杂的生理生化变化过程,受植物基因型、诱变剂类型和外界环境条件等多种因素的影响。因此,还需要进一步利用基因工程技术探讨染色体加倍的分子机制,以提高西瓜单倍体的加倍率,加快双单倍体育种的进程。笔者通过利用培养基添加法、浸芽法和滴生长点法3种不同的加倍技术对西瓜单倍体加倍的效果进行研究,结果表明,浸芽法加倍效果最佳,秋水仙素诱导剂效果好于氟乐灵诱导剂,其二倍体诱导率和植株长势均优于其他。600 mg·L-1秋水仙素浸芽4 h,二倍体加倍率达到最高,为75.00%。研究结果为西瓜单倍体快速获得纯合的双单倍体提供了技术参考,同时获得的西瓜多倍体种质丰富了育种材料,对加快育种进程、提高育种效率具有重要意义。
参考文献
[1] 马超,曾剑波,朱莉,等.北京西瓜产业发展40年来回顾及展望[J].中国瓜菜,2022,35(2):112-117.
[2] 杨红,顾妍,张朝阳,等.辐射花粉授粉诱导西瓜单倍体[J].江苏农业科学,2017,45(22):159-161.
[3] 李慧,赵林姝,古佳玉,等.小麦花药培养体系优化及高再生力基因型的筛选[J].植物遗传资源学报,2022,23(3):738-745.
[4] ALI J,NICOLAS K L C,AKTHER S,et al.Improved anther culture media for enhanced callus formation and plant regeneration in rice(Oryza sativa L.)[J].Plants-Basel,2021,10(5):839.
[5] SORNTIP A,POOLSAWAT O,KATIVAT C,et al.Gynogenesis and doubled haploid production from unpollinated ovary culture of cucumber(Cucumis sativus L.)[J].Canadian Journal of Plant Science,2018,98(2):1-29.
[6] 曹冰东,付文苑,唐兵,等.黄瓜未授粉子房离体培养条件的优化及植株再生[J].中国瓜菜,2022,35(5):8-16.
[7] 薛光荣,费开伟.西瓜花药培养获得花粉植株简报[J].中国果树,1982(2):51-52.
[8] 薛光荣,余文炎,费开伟,等.西瓜花药离体培养获得花粉植株[J].植物生理学通讯,1983(4):40-42.
[9] 袁万良,付润民,雷保林,等.西瓜花培试验初报[J].陕西农业科学,1995(1):29-30.
[10] 魏瑛.低温预处理对西瓜花药愈伤组織诱导的影响[J].甘肃农业科技,1999(9):34-36.
[11] 李娟,张丽,李焕秀,等.西瓜花药培养技术研究[J].中国瓜菜,2008,21(4):8-10.
[12] 缑艳霞,张明方.西瓜花药离体培养影响因子研究[J].北方园艺,2013(10):117-120.
[13] 朱迎春,刘君璞,邓云,等.不同因素对西瓜花药愈伤组织诱导的影响[J].河南农业科学,2015,44(12):104-111.
[14] 高宁宁,李晓慧,康利允,等.单倍体甜瓜染色体加倍技术研究[J].中国瓜菜,2021,34(6):28-32.
[15] 成锴,苏晓慧,栗建枝,等.不同加倍技术加倍玉米单倍体的研究[J].玉米科学,2019,27(4):42-46.
[16] 魏昌松,许贵明,谭澍,等.两种药剂对玉米单倍体加倍效果研究[J].农业科技通讯,2016(3):55-58.
[17] 李勤菲,向竹清,梅家琴,等.秋水仙碱对芸薹属三种单倍体染色体加倍效率[J].中国油料作物学报,2011,33(4):409-411.
[18] 朱惠琴,张宪银,薛庆中.开发实用的染色体加倍体系构建成烟草DH群体[J].分子植物育种,2004,2(5):643-648.
[19] CHAIKAM V,GOWDA M,MARTINEZ L,et al.Improving the efficiency of colchicine-based chromosomal doubling of maize haploids[J].Plants-Basel,2020,9(4):459.
[20] 付文苑,唐兵,邓英,等.辐射花粉授粉诱导黄瓜单倍体及染色体加倍[J].分子植物育种,2019,17(21):7150-7155.
[21] LE C T,姜二花,王康,等.利用氟乐灵进行同源四倍体萝卜种质创制研究[J].基因组学与应用生物学,2012,31(3):276-281.
[22] 章鹏,孙守如,陈解放,等.氟乐灵诱导南瓜染色体加倍初步研究[J].河南农业大学学报,2011,45(1):42-45.
[23] 张春芬,邓舒,肖蓉,等.单倍体苹果染色体加倍技术[J/OL].分子植物育种,2023,1-17[2023-11-02].https://kns.cnki.net/kc ms/detail//46.1068.S.20230201.1546.005.html.
[24] 单芹丽,王继华,李绅崇,等.秋水仙素对非洲菊单倍体加倍效果研究[J].西南农业学报,2017,30(10):2230-2234.
[25] 李丽.不同试剂离体诱导萱草多倍体的研究[D].山西太谷:山西农业大学,2016.
[26] 储丽红,彭佳佳,王钊,等.氨磺灵、氟乐灵和秋水仙素诱导安祖花多倍体的研究[J].园艺学报,2014,41(11):2275-2280.
[27] 朱惠琴.二甲基亚砜(DMSO)对烟草单倍体植株的染色体加倍效应[J].青海师范大学学报(自然科学版),2004(2):54-56.
