基于网络药理学和分子对接技术探讨桔梗治疗非小细胞肺癌分子机制
2024-01-30杨策余婉莹王文祥李宁易东阳谭小燕
杨策,余婉莹,王文祥,李宁,易东阳,谭小燕
1. 重庆三峡医药高等专科学校,重庆 404120
2. 三峡库区道地药材开发利用重庆市重点实验室,重庆 404120
3. 重庆文理学院,重庆 402160
非小细胞肺癌(NSCLC)是肺癌病理分类中最常见的类型,是除小细胞肺癌(SCLC)以外,所有来源于肺上皮的各种类型癌症的集合体。NSCLC 的常见类型有鳞状细胞癌、腺癌、大细胞癌。其临床治疗以化疗为主,也有多种靶向药物治疗,但预后效果并不理想[1]。因此,寻找治疗NSCLC 的新靶点具有重要的临床意义。研究显示,多种中药成分及其提取物具有较好的抗肿瘤作用,如苦参碱、染料木素和紫杉醇,部分已广泛应用于临床[2-3]。桔梗在临床上常用于治疗咳嗽痰多、肺痛吐脓等症,为肺经之要药。药理学研究证实,桔梗具有抗氧化、抗炎、抗癌等药理作用,能抑制多种肿瘤细胞增殖[4]。然而,桔梗治疗NSCLC 的报道较少,其作用机制也尚未明确。因此,明确桔梗治疗NSCLC 的分子机制可以为桔梗防治NSCLC 提供更多参考。“成分-靶点-通路”网络关系中,多成分、多靶点、多途径的特点体现了中医治疗的整体观念。本研究基于网络药理学探讨桔梗治疗NSCLC 的活性成分和可能的分子机制,并通过体外实验验证了相关靶基因的相对表达量,结果报道如下。
1 材料与方法
1.1 材料A549 细胞株(中国科学院上海细胞库);桔梗(中国食品药品检定研究院,批号121028-201612);RPMI 1640 培养基、胎牛血清(美国Gibco公司);Cell Counting Kit-8(CCK-8)细胞增殖检测试剂盒(南京建成生物工程研究所);涡旋混合器(美国赛洛杰克仪器有限公司,MX-F);聚合酶链式反应引物(北京擎科生物科技有限公司);ELX800TM酶标仪(美国伯腾仪器有限公司);MCO-15AC 细胞培养箱(日本三洋公司);磷酸盐缓冲液(PBS)、Trizol 试剂(碧云天生物技术有限公司)。
1.2 潜在作用靶点筛选通过中药系统药理学数据库与分析平台数据库(TCMSP)(https://tcmspw.com/tcmsp.php)获得桔梗的化学成分,根据口服生物利用度(OB)≥30%,类药性(DL)≥0.18,筛选桔梗的潜在活性成分。将桔梗的潜在活性成分导入Swiss Target Prediction(https://Swiss.com/)和PharmMapper 数据库(https://www.PharmMapper.org/)中,获取相关的靶点信息。然后将筛选得到的靶点导入Uniprot 数据库(https://www.uniprot.org/),将检索出的蛋白名统一转换为基因名。在TTD(http://db.idrblab.net/ttd)和DrugBank 数据库(https://www.drugbank.com)中得到与NSCLC 相关的疾病靶点信息。最后通过Venny 2.1.0在线平台(https://bioinfogp.cnb.csic.es/tools/venny/)筛选桔梗活性成分靶点与NSCLC 疾病靶点的交集靶点,得到桔梗治疗NSCLC 的潜在作用靶点。
1.3 蛋白-蛋白相互作用(PPI) 网络构建在STRING 数据库(https://string-db.org)中导入交集靶点。置信度设定为“high confidence=0.4”,生物种类设定为“Homo sapiens”,其余的相关设置均为默认设置,获得PPI 网络及相关网络数据文件。将网络数据文件导入CytoScape 3.9.1 软件(https://cytoscape.org/),建立PPI 网络可视化图。用Network Analyzer模块进行网络可视化分析,获得度值(Degree)、节点介度(Betweenness)、节点紧密度(Closeness)的信息。度值越大表明该节点在网络中越重要。
1.4 基因本体论(GO)和京都基因与基因组百科全书(KEGG)通路富集分析将筛选的桔梗治疗NSCLC 的潜在靶点导入DAVID 6.8 平台中,通过GO功能及KEGG 通路进行富集分析。对潜在靶点进行GO 功能分析,以研究桔梗活性成分治疗NSCLC 的主要生物功能,如生物过程(BP)、细胞组分(CC)和分子功能(MF),并根据P值使用生物信息分析平台(http://www.bioinformatics.com.cn/)绘制柱状图。进行KEGG 通路分析,通过Omicshare(https://www.omicshare.com/)绘制气泡图,将结果进行可视化,以分析桔梗治疗NSCLC 的潜在作用机制。
1.5 “成分-靶点-通路”构建与分析将活性成分与潜在作用靶点通过CytoScape 3.9.1 软件筛选结果导入,并展开网络可视化分析,根据节点和边显示靶点与关键化合物间的关系。再利用Network Analyzer功能进行网络拓扑学分析,其中分析参数含节点介度中心性、节点紧密度和度值等,经拓扑学参数比对,确定化合物在网络中的重要性,分析主要活性成分及核心靶点。
1.6 分子对接筛选出桔梗治疗NSCLC 的活性成分和核心靶点,通过RCSB PDB 数据库(https://www.rcsb.org)下载核心靶点的3D 结构。将核心靶点的3D结构导入分子对接软件进行去水、加氢、能量最小化等操作,通过Glide Dock 模块进行分子对接,以对接评分评价活性成分与核心靶点结合的稳定性。
1.7 体外实验验证
1.7.1 细胞分组及给药37 ℃、5%二氧化碳(CO2)饱和湿度下,将A549 细胞培养于RPMI 1640 培养液中(10%胎牛血清、100 U/mL 青霉素及0.1 mg/mL 链霉素)。实验组别设置为空白对照组(A549 细胞,不加药物干预),桔梗提取物低剂量组(40 μg/mL),桔梗提取物高剂量组(80 μg/mL)。
1.7.2 细胞活性实验采用CCK-8 试剂盒进行细胞活性检测。将A549 细胞浓度调至1×104个/mL,以100 μL/孔接种于96 孔板中,于37 ℃、5% CO2培养箱内孵育24 h 后,对各组细胞进行药物处理,每组6 个复孔。药物作用24 h 后,每孔加入CCK-8 试剂10 μL 并摇匀,于CO2培养箱孵育1 h,于450 nm 下测定吸光度值,每孔测3 次,取平均值并计算细胞存活率。
1.7.3 桔梗提取物对调控通路基因的mRNA 相对表达的影响A549 细胞经桔梗提取物干预24 h 后,弃去培养基,以PBS 清洗5 次,并加入Trizol 试剂1 mL,室温放置10 min 后,收集至2 mL EP 管中,于260 nm 处测吸光度值,并确定RNA 浓度。采用逆转录试剂盒将mRNA 逆转录至cDNA。逆转录后采用20 μL 体系进行qPCR 检测,测定mRNA 相对表达量,结果采用2-ΔΔCt法进行相对定量分析。
1.8 统计学方法使用GraphPad Prism 8.0 统计学软件对数据进行分析。计量资料以均数±标准差()表示,多组间比较使用单因素方差分析,两两比较采用LSD 法检验。P<0.05 表示差异有统计学意义。
2 研究结果
2.1 桔梗治疗NSCLC 潜在作用靶点通过TCMSP检索共得到102 个桔梗化学成分。符合筛选条件的潜在活性成分共7 个,见表1。合并Swiss Target Prediction 数据库和PharmMappe 数据库中桔梗活性成分的靶点信息,去重复后获得285 个药物靶点。合并DrugBank 数据库和TTD 数据库的疾病靶点信息,去重后获得165 个与NSCLC 相关的疾病靶点。将桔梗活性成分靶点与NSCLC 疾病靶点取交集,得到桔梗治疗NSCLC 的靶点35 个,交集靶点韦恩图见图1。
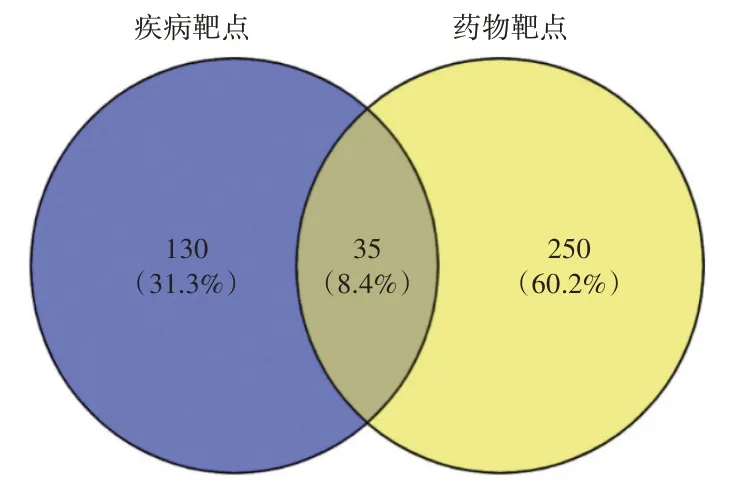
图1 交集靶点韦恩图

表1 桔梗活性成分靶点信息
2.2 PPI 网络构建PPI 网络图中节点代表交集靶点蛋白,节点颜色越深代表相互关联度越强,见图2。从图中可知,白蛋白(Alb)、表皮生长因子受体(EGFR)、乳腺癌抵抗蛋白(ABCG2)、前列腺素内过氧化合物酶2(PTGS2)、P-糖蛋白(ABCB1)、非受体酪氨酸激酶(SRC)等可能是桔梗治疗NSCLC 的关键靶点。

图2 PPI 网络图
2.3 GO 功能富集分析设定P<0.05,总共得到167 条富集通路,其中94 个通路与BP 相关,26 个通路与CC 相关,47 个通路与MF 相关。根据P值由小到大排列,分别选取BP、CC、MF 中前10 条绘制柱状图,见图3。BP 主要涉及异生刺激的反应(response to xenobiotic stimulus)、药物反应(response to drug)、凋亡信号通路(negative regulatioin of apoptotic process)等;CC 主要涉及质膜(plasma membrane)、细胞核(nucleus)、细胞质(cytoplasm)等;MF 主要涉及三磷酸腺苷结合(ATP binding)、蛋白结合(identical peotein binding)等。

图3 GO 富集分析图
2.4 KEGG 通路富集分析设定P<0.05,采用KEGG 通路富集对35 个潜在作用靶点进行分析,共获得42 条富集通路,按照P值依次增大的排列顺序,筛选出前20 条与NSCLC 相关的通路。气泡的颜色代表富集的显著性,气泡越红说明差异基因在这个通路上富集越显著。见图4。

图4 KEGG 富集通路气泡图
2.5 “成分-靶点-通路”可视化网络见图5。获得7 种化学成分,包括刺槐黄素、菠菜甾醇、花旗松素、2-O-甲基-3-O-β-D-吡喃葡萄糖基桔梗酸酯A、木犀草素、3-O-β-D-吡喃葡萄糖基桔梗酸A 二甲酯、刺槐素。与化学成分相互作用联系的35 个基因靶点主要有ABCB1、PTGS2、EGFR、Alb、SRC、ABCG2 等。与桔梗治疗NSCLC 有关联的信号通路主要有癌症通路(pathway in cancer)、EGFR 酪氨酸激酶抑制剂耐药性(EGFR tyrosine kinase inhibitor resistance)、MAPK 信号通路(MAPK signaling pathway)、Rap1 信号通路(Pap1 signaling pathway)、FoxO 信号通路(FoxO signaling pathway)等。
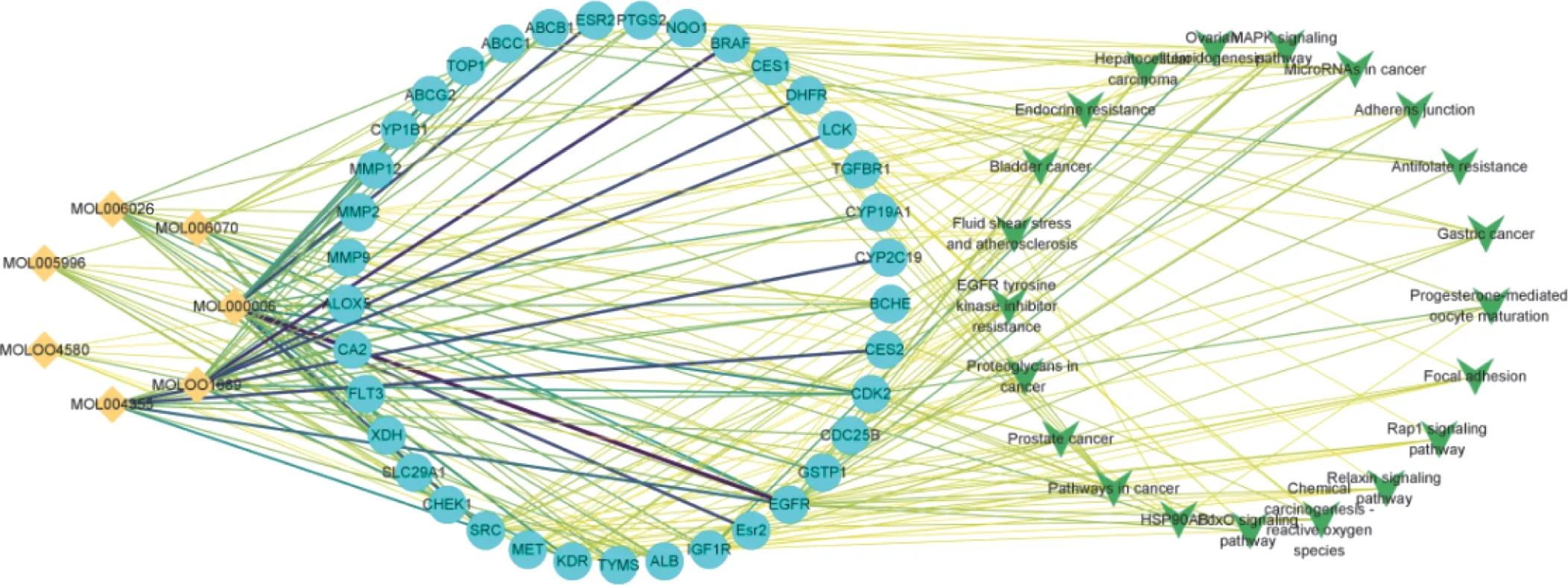
图5 成分-靶点-信号通路网络
2.6 分子对接见图6。花旗松素与PTGS2、木犀草素与ABCB1 和PTGS2、刺槐素与EGFR 等对接评分较高。选取ABCB1、EGFR、PTGS2 与其对接评分最高的活性成分进行可视化,见图7。

图6 分子对接评分热图

图7 分子对接可视化图
2.7 体外实验验证见图8。给药24 h 后,与空白对照组相比,桔梗提取物低剂量组A549 细胞活性下降(P<0.05),桔梗提取物高剂量组A549 细胞活性低于桔梗提取物低剂量组(P<0.05)。qPCR 实验结果显示,与空白对照组相比,桔梗提取物低剂量组A549 细胞中ABCB1、EGFR、PTGS2 mRNA 表达量均降低(P<0.05),桔梗提取物高剂量组A549 细胞中ABCB1、EGFR、PTGS2 mRNA 表达量均低于桔梗提取物低剂量组(P<0.05)。

图8 桔梗提取物对A549 细胞活性及核心靶点基因表达的影响
3 讨论
中医药作为补充和替代医学被广泛用于改善接受肿瘤切除术后化疗、放疗或免疫治疗的NSCLC 患者的生活质量。研究发现,桔梗中的桔梗皂苷D 与异类叶升麻苷可通过调控EphA2/AKT/mTOR 通路和调节TNF-α、IL-6 来抑制A549 细胞增殖、迁移和侵袭[5]。桔梗皂苷D 还可以通过下调基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)mRNA和蛋白的表达及抑制其上游ERK 信号通路和p-AKT表达,进而抑制NSCLC H460 和A549 细胞的黏附、侵袭和迁移[6]。但迄今为止桔梗治疗NSCLC 的作用机制仍不明确。网络药理学基于“疾病-基因-靶点-药物”相互作用网络,为系统发现中药活性成分及作用靶点提供新的策略[7]。因此,本研究结合网络药理学、分子对接及分子生物学等方法,深入挖掘桔梗的有效成分,阐明其治疗NSCLC 可能的作用机制。
从TCMSP 中检索得到102 个桔梗化学成分,根据OB 和DL 筛选得到7 个潜在活性成分。其中刺槐黄素具有抗氧化和抗炎作用,有研究表明刺槐黄素显著降低了p38 α-cDNA 转染细胞中磷酸化p38 α 丝裂原活化蛋白激酶(MAPK)、MMP-2/MMP-9 及尿激酶型纤溶酶原激活剂(u-PA)水平,从而显著降低了NSCLC A549 细胞的侵袭及迁移[8-9]。花旗松素可以通过促进胞内磷脂酰肌醇激酶(PI3K)和OCT4 失活来抑制肺癌细胞干性和上皮-间质转化作用,同时能通过降低SOX2 和OCT4 表达来抑制A549 异种移植BAlb/c小鼠的肿瘤生长[10]。木犀草素可以通过抑制Hsp90 与突变型EGF 受体的结合来诱导EGF 受体降解,从而阻止PI3K/Akt/mTOR 信号传导,加速NSCLC A549细胞凋亡[11]。其余潜在活性成分未见治疗NSCLC 的相关报道。
PPI 网络分析表明,Alb、EGFR、ABCG2、PTGS2、ABCB1 及SRC 为桔梗治疗NSCLC 的核心靶点。研究表明,EGFR 靶点联合检测血清ProGRP、NSE 可有效提高诊断晚期NSCLC 的效能[12]。NSCLC 患者体内Alb 降低是发生癌痛的独立危险因素[13]。ABCG2靶点的高表达与肺癌患者术后复发转移呈正相关关系,表明ABCG2 靶点可作为预测肺癌复发的重要指标[14]。SRC 蛋白激酶在正常组织的细胞中广泛表达,当SRC 过度表达时,可能会导致癌症的发生。在NSCLC 患者机体中,SRC 的过度表达与不良的预后以及促进迁移、侵袭、转移和耐药有关[15]。
通过GO 和KEGG 通路富集分析交集靶点,结果表明桔梗主要通过作用于癌症通路、EGFR 酪氨酸激酶抑制剂耐药性、MAPK 信号通路、Rap1 信号通路、FoxO 信号通路等发挥治疗NSCLC 的作用。相关研究表明,桔梗可通过激活T 细胞促进抗肿瘤作用,癌症通路的调节至关重要[16];EGFR 信号通路也能影响到突变晚期NSCLC 的表达[17];桔梗还可通过抑制MAPK 通路及PI3K/AKT 通路的活化治疗NSCLC小鼠肺组织部位[18];桔梗可抑制细胞质Rap1 靶点,进而介导下游炎症及凋亡通路,有效提升机体对NSCLC 化疗药物的耐药性[19];化疗药物具有细胞毒性,可促使细胞凋亡,桔梗能抑制FoxO 信号通路,从而降低细胞对化疗药物的敏感性,提升治疗NSCLC 的药效[20]。
针对以上预测结果,以qRT-PCR 进行验证实验,结果表明ABCB1、EGFR、PTGS2 等核心靶点可能是桔梗治疗NSCLC 的有效靶点。EGFR 是受体酪氨酸激酶ErbB 家族的一员,可以与受体特异性配体结合形成同源和异源二聚体,二聚体的形成可以促进酪氨酸激酶的激活。酪氨酸残基的自动磷酸化启动了一系列下游信号转导通路。EGFR 信号通路对细胞生长、增殖和分化的生理过程有重要影响,EGFR是抗NSCLC 药物的最佳靶点[21]。MAPK 和PI3K-AKT信号通路是EGFR 的主要下游通路,分别参与细胞增殖、细胞存活和运动[22]。ERK 和AKT 的激活在肿瘤的细胞生长和细胞分裂中起重要作用。抑制MAPK和PI3K-AKT 信号通路有望成为治疗NSCLC 的有效方法[23]。SRC 的过度表达与促进迁移、侵袭、转移和耐药有关,SRC 被多种受体酪氨酸激酶(RTKs)激活时,与局部粘着斑激酶(FAK)相互作用,然后通过肾素-血管紧张素系统(RAS)和Raf 蛋白激酶(RAF)导致丝裂原活化蛋白激酶激酶(MAPK)-磷酸化丝裂原活化蛋白激酶激酶1/2(MEK1/2)和细胞外调节蛋白激酶(ERK1/2)的激活,最终促进肿瘤细胞的增殖、迁移和血管生成[24]。PCR 实验结果表明,桔梗提取物能够有效调控以上靶点,进而改善NSCLC,且可能呈现一定的剂量依赖性。
综上所述,本研究利用网络药理学、分子对接及分子生物学的方法探讨了桔梗治疗NSCLC 的分子机制。研究表明桔梗可能通过靶向ABCB1、EGFR、PTGS2 等靶点调节MAPK 等信号通路,进而发挥抑制肿瘤细胞增殖的作用。桔梗可通过多成分、多靶点、多途径发挥治疗NSCLC 的作用。然而,由于本研究是基于基因层面分析,还需要来自体外和体内更加深层次的研究来验证。
