稻曲病发病规律、病菌功能基因组以及免疫反应的遗传机制
2024-01-30何旎清程朝平晋艺丹黄凤凰李生平杨德卫
何旎清 程朝平 晋艺丹 黄凤凰 李生平 杨德卫*
(1 福建省农业科学院水稻研究所,福州 350018;2 福建农林大学农学院,福州 350002;#共同第一作者;*通信作者:dewei-y@163.com)
由稻绿核菌(Ustilaginoidea virens)引起的稻曲病(Rice false smut)是重要的水稻病害之一,近年来在亚洲、非洲、美洲、欧洲和大洋洲等地区均有发生。该病害不仅对水稻产量和品质有影响,而且其病原菌产生的毒素对人和动物均有危害,已引起世界植物保护学家和育种学家的高度重视[1-2]。近几年,随着杂交水稻面积的不断推广,尤其是甬优系列籼粳交杂交稻的大面积种植与推广,稻曲病发病越发严重,严重时可造成20%~30%的产量损失[3]。稻曲病已成为稻瘟病、纹枯病之后的又一大水稻病害。能否实现对稻曲病的有效防控事关我国粮食生产安全和食品安全。鉴于此,本文归纳形成了稻曲病菌触发植物免疫反应的模型,同时,探讨了当前稻曲病抗性鉴定方法、抗性基因挖掘、侵染机制、稻曲病菌与水稻互作以及病情监测预报和防治等方面存在的问题,并对今后进一步开展相关研究进行了展望。
1 稻曲病的症状与发生概况
1.1 稻曲病的命名
《本草纲目》记载的“粳谷奴,谷穗媒者”实际上就是稻曲病。1878 年COOKE 在印度首次发现稻曲病病原菌并命名为Ustilago virens。1896 年TAKAHESHI 正式将其命名为Ustilaginoidea virens。2007 年许志刚将该病原菌的学名修订为Ustilaginoidea virens(che),并写入《拉汉-汉拉植物病原生物名称》中[4]。
1.2 稻曲病菌产生症状
稻曲病菌在稻穗上会形成黑色、墨绿色和黄色稻曲球[5]。稻曲病发病初期,受害病粒菌丝在谷粒内形成块状,并仅局限于水稻花序颖片内。后逐渐扩大,最后形成直径达1 cm 以上,能将整个花序部分完全包裹的完整稻曲球。一般1 个病粒含有1 个菌核,有的含有2~4 个菌核。
研究者在田间还发现了与上述症状明显不同的稻曲球病粒,即白色稻曲球。早在1978 年印度就报道了这种白色稻曲球,其症状与黑色、墨绿色和黄色的稻曲球外部形态明显不同,1991 年日本HONKURA 等报道了这种白色稻曲球,1996 年我国王疏等也报道了白色稻曲球[6]。
1.3 稻曲病发生情况
稻曲病是一种世界性真菌病害,在亚洲、非洲、美洲、欧洲和大洋洲均有发生,在亚洲的中国、日本、印度和菲律宾等国家发病较为严重,在欧洲主要以英国、意大利和荷兰等国家发病较为严重[7-8]。
我国在20 世纪30、40 年代已有稻曲病发生的报道;50 年代开始关注该病;70 年代以后,随着杂交稻面积扩大及栽培技术提高,该病逐年加重;80 年代开始,由于密穗型水稻品种的大面积推广,该病越来越严重;80 年代末期,随着杂交水稻和粳稻面积进一步扩大,该病已危及我国10 多个省的水稻生产;进入90 年代,我国相当部分水稻产区都发生该病,对水稻产量造成重大损失[5]。2015—2017 年,每年约有240 万hm2的稻田受到该病的影响[9]。2022 年全国农业技术推广服务中心组织各省(区、市)测报技术人员预测全国发生面积约240 万hm2。
2 稻曲病菌的生物学特征
2.1 稻曲病菌的生物学特征
2.1.1 稻曲病菌的特征分类
1934 年SAKURAI 发现了该病原菌的有性孢子,该菌被归于子囊菌的麦角菌属,由于各种原因,该病原菌命名并没有获得学术上的认可。直至2008 年TANAKA在系统研究的基础上,将该病原菌从Claviceps 属独立出来,将其有性态定名为Villosiclava virens[10]。稻曲病菌的繁殖体主要有厚垣孢子、子囊孢子和分生孢子3 种,稻曲病菌在田间主要以厚垣孢子和菌核2 种形态越冬,而且这2 种形态可以成为次年稻曲病的初次侵染源。研究显示,稻曲病菌厚垣孢子(无性态)有黄色、淡墨绿色和黑色3 种颜色,除黑色外,其他2 种颜色的厚垣孢子均可萌发,萌发温度为25 ℃~30 ℃[11]。
2.1.2 稻曲病菌的遗传多样性分析
稻曲病菌由于易受外界环境变化而变化,表现出丰富的遗传多样性[12-14]。最近基因组研究显示,Uv-Gvt的基因库与中国和日本报道的UV-8b和MAFF 236576具有相似性[15]。
2.2 稻曲病菌的功能基因研究
2.2.1 稻曲菌基因组学研究
FU 等[16]对稻曲菌核型进行了分析,结果显示,菌核中至少包含10 条大小不等的染色体,这些染色体分子量在0.6 kb~6 Mb 之间,推测其基因组大小为23 Mb左右。WANG 等[17]通过构建人工染色体文库,对稻曲菌菌株Uv-8b进行测序,结果显示,其基因组长度约为51.2 Mb。SUN 等[18]对2 个不同稻曲菌株的基因组进行比较,结果表明,不同区域群体间遗传多样性存在显著差异,且存在遗传分化。ZHANG 等[19]利用Illumina 等平台对稻曲菌Uv-8b的全基因组进行了高通量测序,结果显示,该菌基因组大小约为39.4 Mb,包含约8 426个编码基因,平均基因长度为1 672 Mb,平均每个基因包含2.6 个外显子和1.6 个内含子。
最近研究者对稻曲病菌UV-FJ-1(38.48 Mb)进行了全基因组测序。该基因组包含116 个contigs,N50 为0.65 Mb,最大长度为2.10 Mb,共鉴定出7 164 个蛋白质编码基因,其中5 818 个具有功能注释,223 个编码假定的效应蛋白[19]。
2.2.2 稻曲菌相关功能基因的克隆及功能分析
CHEN 等[20]利用同源克隆技术,从稻曲病菌中鉴定出一个重要的转录因子UvCom1G,该基因可影响跨膜转运富集基因的表达。CHEN 等[21]利用转录组分析鉴定了一个假定的酯环化酶UvEC1,UvEC1 突变体表现出降低的毒性。TANG 等[22]从稻曲病菌中鉴定到2 个CMGC(CDK/MAPK/GSK3/CLK)激酶基因UvPmk1和UvCDC2,研究显示,UvPmk1和UvCDC2敲除突变体的感染菌丝生长缺陷和毒力显著丧失。CHEN 等[23]利用转录组分析,鉴定出一个重要的转录因子UvCGBP1,并可以通过MAPK 途径调控真菌毒力。XIE 等[24]对稻曲菌中UvBI-1基因进行克隆和互补验证,结果表明,UvBI-1在菌丝生长和产孢过程中起着负作用,并对其抗逆性、细胞壁完整性、次生代谢产物的产生和致病性起着至关重要的作用。
FANG 等[25]利用瞬时表达系统对稻曲病菌中119个效应蛋白进行筛选,并通过酵母系统验证了其中11个具有分泌活性。ZHENG 等[26]克隆了稻曲病菌中铁转运蛋白Uvt3277,证明了该蛋白在稻曲病致病过程中具有重要的调控作用。YIN 等[27]从稻曲菌基因组中鉴定出28 个bZIP基因,并进一步证明了17 个bZIP在病原菌致病过程中具有调控作用,8 个bZIP可能参与病原菌抗氧化压力的调控。
2.3 稻曲病菌毒素研究
稻曲病菌一个非常重要的特点就是会对人畜产生严重的健康危害。NAKAMURA[28]研究显示,稻曲菌的提取物对兔子有毒。20 世纪50 年代,中国科学家研究发现,稻曲病中含有有色毒素C9H6O7,对牛有毒。
研究发现,到目前为止稻曲病菌中含有3 类次生代谢产物:一类是稻绿核菌素(Ustilaginoidins) ,为萘并吡喃酮类化合物;二类是稻曲菌素(Ustiloxins) ,为环肽类化合物;三类是山梨素类(Sorbicillinoids),为六聚酮类脂溶性化合物[29-31]。稻曲菌素代谢物具有不同的生物学活性,主要表现动物毒性、植物毒性以及细胞毒性的特点,稻曲菌素主要成分是稻曲菌素A、稻曲菌素B 以及其他稻曲菌素。最近研究发现,稻曲菌素表现植物毒、动物毒及细胞毒活性,主要原因是稻曲菌素可以抑制微管蛋白的组装,进而阻碍细胞骨架的形成[29-31]。
3 稻曲病菌侵染水稻的特征
早在1962 年IKEGAMI[32]就对稻曲病菌在苗期侵染水稻的过程进行了系统的组织学观察,研究发现,稻曲病菌从侵染幼嫩胚芽鞘开始,沿着韧皮部筛管表面向外扩展,一直到水稻分蘖中晚期,但是并没有观察到可以到达水稻茎尖部的穗原基。ASHIZAWA 等[33]研究表明,水稻幼穗形成期至孕穗中期最易受稻曲病菌侵染,而在破口期之后很难侵入。TEBEEST 等[34]研究显示,稻曲病菌可以侵染水稻幼嫩的胚根,进一步利用PCR 技术检测发现,随着水稻生长,病原菌可扩展至整个植株,其中包括穗子和稻粒等不同组织。SONG 等[35]通过PCR 技术检测显示,稻曲病菌可以从芽鞘和苗期根部伤口侵入。TANG 等[36]研究结果显示,稻曲病菌最先侵染水稻的雄蕊花丝,但雌蕊和浆片子房上没有观察到菌丝。HU 等[37]利用同样的接种方法,接种1 d 后观察显示,菌丝最先侵染小穗的花丝,然后侵染花药基部;在接种7 d 后,菌丝包围整个花器官,最后形成稻曲球。
SONG 等[38]对稻曲病菌侵染水稻小穗过程进行了系统观察,结果显示,在侵染第1 d,分生孢子在小穗外表面萌发并形成菌丝团,但菌丝在小穗里面没有观察到;在侵染第2 d,菌丝大部分通过小穗外稃和内稃之间的空隙,从顶端延伸至小穗内部,有些菌丝在小穗外表面随机扩散,部分菌丝通过外稃和内稃中部或基部的裂缝进入小穗;在侵染第3 d,菌丝已进入小穗并到达花表面器官,如花丝、花柱和垂叶;在侵染第4 d,花丝被真菌菌丝感染;在侵染第5 d,雄蕊的花药上能看到菌丝;在侵染第6 d,柱头及花柱雌蕊被真菌菌丝覆盖,这时感染花丝开始塌陷;在侵染第7 d,可以看到大量菌丝进一步感染并坍缩花丝,有些柱头或花柱也被侵染,在荧光显微镜下可以清楚观察到许多被稻曲病菌侵染的小穗;在接下来几天,真菌菌丝迅速发育覆盖了所有的花器官;在侵染第10 d,许多表皮细胞被感染;在侵染第15 d,大部分柱头和花柱被感染,少量菌丝延伸至卵巢;在侵染第21 d,少数子房被真菌菌丝侵染。最近研究者利用水稻雌蕊异常突变体和雄蕊缺陷突变体研究发现,雄蕊对稻曲病菌侵染水稻花器形成稻曲球是不可或缺的[39]。
根据以上研究,推测稻曲菌侵染水稻的过程是:稻曲病菌通过小穗外稃和内稃之间的空隙进入,从顶端延伸至小穗内部,病原菌先侵染水稻花丝,阻止了成熟花粉产生,从而阻碍水稻授粉,在接下来的几天里,稻曲病菌侵入柱头和花柱,接着继续侵染并由子房、柱头供给营养,很快向花药及整个颖花内扩散蔓延,最后形成稻曲病球。
除了用普通PCR 进行检测外,SUN 等[40]提出了一种环介导等温扩增(LAMP)的方法用于稻曲病菌的特异性检测,该方法具有快速、简便、灵敏度高的特点。
4 稻曲病抗性的遗传规律与基因鉴定
4.1 稻曲病抗性基因的遗传方式
目前对于稻曲病抗性遗传规律研究进展缓慢。2008 年LI 等[41]研究结果显示,稻曲病抗性遗传有显著主基因效应,主要符合2 对主效基因+微效多基因混合遗传模式。方先文等[42]研究显示,稻曲病抗性遗传与2对主基因+多基因遗传模式相吻合。钱可峰[43]研究显示,其抗性遗传主要是受1~2 对主效基因控制。
4.2 抗稻曲病基因的鉴定
近年来,国内外学者开展大量研究挖掘稻曲病抗性基因,鉴定了一些稻曲病抗性相关的QTLs(表1)。徐建龙等[44]利用创建的近等基因系,在水稻第10 和第12条染色体上分别鉴定了QFsr10和QFsr12等2 个稻曲病抗性相关QTLs。袁丽华等[45]以MR183-2 和08R2394为研究材料,鉴定了4 个稻曲病抗性相关QTL:qFsr2-1、qFsr2-2、qFsr3-1和qFsr8-1。LI 等[41]以抗病材料IR28作父本构建157 个重组自交系为研究材料,鉴定了7 个稻曲病抗性相关QTLs 位点:qFsrl、qFsr2、qFsr4、qFsr8、qFsr10、qFsr11和qFsr12。ZHOU 等[46]以构建的Lemont/特青的213 个入渗系为研究材料,鉴定了4 个稻曲病抗性相关QTLs:qFSR-6-7、qFSR-10-5、qFSR-10-2和qFSR-11-2。

表1 鉴定的稻曲病相关QTLs
最近QIU 等[47]以南京11 号为研究材料,通过图位克隆技术,将稻曲病抗性基因FSR1定位于水稻第1 染色体220 kb 的区域内,并初步推断LOC_Os01g42630为其候选基因。LONG 等[48]通过全基因组关联分析方法,确定了第1 号染色体(12.3 kb)上的基因LOC_Os01g15580为稻曲病抗性的候选基因。NEELAM 等[49]以RYT2668为研究材料,定位了7 个与稻曲病抗性相关的QTLs:qRFSr5.3、qRFSr7.1a、qRFsr9.1、qRFSr2.2、qRFSr4.3、qRFSr5.4和qRFSr7.1b。此外,HUANG 等[50]在粳稻品种XS47 和XS664 中鉴定了3 个与RFS 抗性相关的QTLs(qFSR10、qFSR2和qFSR9),分别位于第2、第10 和第11 号染色体上,并对其中的qFSR2进行了精细定位。然而,迄今为止,尚未有抗稻曲病QTL 被克隆的报道。
5 稻曲病免疫反应遗传机制研究
植物与病原菌互作过程中,植物本身会进化出一套有效的先天免疫系统来抵御病原菌的侵染,主要包括PTI(PAMP-triggered immunity)和ETI(Effector-triggered immunity)免疫系统[51]。病原菌为了成功侵染植物会分泌大量效应蛋白来抑制植物的免疫反应,发挥毒性功能。
在稻曲病菌与植物形成的免疫反应中,众多研究者通过开展系列相关研究初步形成了稻曲病菌触发宿主免疫反应机制,作者归纳如图1。SONG 等[52]从稻曲菌分泌液中鉴定到一个在真菌中保守的微生物相关分子模式SGP1,SGP1 作用于植物细胞的质外体,并且依赖于植物免疫核心受体BAK1 识别。SGP1 编码一个丝氨酸、苏氨酸糖基磷脂酰肌醇锚定蛋白。ZHENG 等[53]研究发现,该类蛋白在真菌中普遍存在,植物特异性识别SGP1 中保守的22 个氨基酸,该22 个氨基酸的肽段(SNP22)足以诱导植物的细胞死亡和抗病性反应。最近研究显示,稻曲病菌中磷酸酶效应因子SCRE6,在侵染期间分泌并转移到水稻细胞中,与丝裂原活化蛋白激酶6(OsMPK6)相互作用并使其去磷酸化,负调控水稻免疫反应。进一步研究发现,OsMPK6 去磷酸化增强其稳定性,从而抑制水稻免疫力。CHEN 等[54]研究显示,稻曲菌中毒性效应蛋白UvSec117 进入寄主细胞中,与水稻组蛋白去乙酰化酶OsHDA701 靶向互作,通过UvSec117 的核定位信号将大量的OsHDA701 招募到细胞核,同时UvSec117 与OsHDA701 互作过程中可增强OsHDA701 去乙酰化活性,从两方面降低水稻组蛋白的乙酰化水平,进而干扰防御基因的激活和寄主免疫。
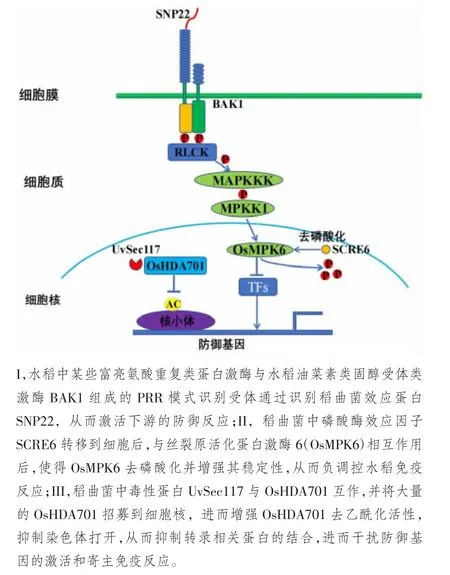
图1 稻曲病菌PAMP 触发宿主免疫反应的模型
6 稻曲病抗性鉴定技术
6.1 稻曲病抗性鉴定方法
稻曲病抗性鉴定方法主要有3 种,分别为人工接种法、田间自然诱发法以及两种方法相结合的方法。在注射、喷雾和直接撒稻曲球等人工接种方法中,注射接种的方法发病率相对较好,较为稳定,同时注射接种一般选择在水稻破口前6~9 d,尤其在傍晚接种更有利于水稻发病,同时在充分利用自然条件的情况下,采用自然诱发法鉴定稻曲病也是可行的[55-56]。大部分研究显示,田间自然鉴定由于影响因素较多,重复性效果不理想,而人工接种方法稳定性较好[57-58]。
6.2 稻曲病抗性分级标准
6.2.1 以每穗受害小花数进行分级
IRRI[59]根据每穗受害水稻小花数百分率作为考察指数,将稻曲病进行了分级。具体为:未发生,表现高抗(HR),定为0 级;小花发病率低于1%,表现抗病(R),定为1 级;小花发病率1%~5%,表现中抗(MR),定为3级;小花发病率6%~25%,表现中感(MS),定为5 级;小花发病率26%~50%,表现感病(S),定为7 级;小花发病率51%~100%,表现高感(HS),定为9 级。
6.2.2 以病株率或病穗率分级
陈嘉孚等[60]依据稻曲病病株率对稻曲病进行了分级:病株率为0,完全抗病(HR);病株率<5%,抗病(R);病株率5.1%~10.0%,中抗(MR);病株率10.1%~25.0%,中感(MS);病株率25.1%~50.0%,感病(S);病株率为>50.1%,高感(HS)。
何会流等[61]根据病穗率,将稻曲病等级划分为0级、1 级、3 级、5 级、7 级和9 级等级别。
6.2.3 以单穗稻曲球数量分级
唐春生等[62]利用聚类分析方法,并根据单穗稻曲球数量的多少,将稻曲病划分为5 个等级:未发病为0级,有1 粒稻曲球为1 级,有2~3 粒稻曲球为2 级,有4~5 粒稻曲球为3 级,有6~9 粒稻曲球为4 级,有10粒以上稻曲球为5 级。
6.2.4 按穗重损失率分级
施辰子等[63]根据穗重损失率将稻曲病进行分级:穗重损失率为0,0 级;穗重损失率5%以下,1 级;穗重损失率10%以下,2 级;穗重损失率20%以下,3 级;穗重损失率50%以下,4 级;穗重损失率50%以上,5 级。
6.2.5 以单穗稻曲球数量和产量损失率分级
李小娟等[64]结合每穗病粒数和产量损失率相关指数,将稻曲病划分为0~9 个级别。
7 影响稻曲病发病因子
7.1 水稻品种的抗性水平
不同类型的水稻品种抗性不同,稻曲病发病程度差异很大。这些差异与水稻的株型特征、品种类型、生育期长短等都有密切关系[65]。水稻孕穗末期即稻曲病最高感病期,当时如与低温、高湿、阴雨气候条件相结合,易导致稻曲病发生[66]。
7.2 水稻品种穗部特征
研究显示,大穗、多粒的品种,直立密穗类型的品种,颖壳表面粗糙的品种都易发稻曲病[67]。
7.3 外界气象因素
稻曲病的发生还受温度、湿度、降雨量以及日照等气象因素的影响。研究显示,在水稻生殖生长阶段,平均温度不超过32 ℃,降水量多,且持续时间长,有利于稻曲病流行发生[67]。在水稻破口前3 d 至齐穗期,日平均温度在30 ℃左右时稻曲病容易发生;平均温度高于34 ℃或低于26 ℃时,则稻曲病不易发生[68]。
7.4 栽培条件
稻曲病发生与施肥有关。施氮量的增加有利于稻曲病的发生,而磷、钾肥的施用对稻曲病发病程度影响不显著[69]。另外,稻曲病发生还与种植方式和灌溉方式等因素有关。WANG 等[70]研究发现,水稻田间种植密度过大、栽植株距过小、灌溉过于频繁和排水不良导致田间相对湿度较高等,均有利于稻曲病的发生。
8 展望
8.1 稻曲病抗性鉴定方法
人工接种技术是鉴定不同水稻品种稻曲病抗性有效方法之一,主要分为注射接种、喷雾和直接撒稻曲球3 种方法。然而,人工注射接种耗时费工,效率低。而以喷雾接种并结合自然鉴定方法,有利于提高稻曲病发病率和鉴定工作效率。国内外研究者对稻曲病抗性分级标准进行大量研究,但目前还没有统一的分级标准。IRRI 的分级标准既能较好反映发病程度,也方便于田间操作,但在生产实际中还有一定局限性。例如,同一个水稻品种或者品系,不同大小的穗子,根据IRRI 分级标准,评价结果是不一样的,笔者对中花11 进行稻曲病接种发现,大的穗子有5~9 个发病粒,而小的穗子只有3~5 个发病粒。另外,一般常规籼稻和粳稻的每穗粒数在200 粒左右,而一些超级稻品种,每穗粒数在300 粒以上,有的甚至350 粒以上。如果按每穗病粒数计算发病等级,在同样病粒数的情况下(即发病等级相同),每穗粒数多的品种其病粒率就很低,而每穗粒数少的品种其病粒率很高;如果按照发病穗率进行等级划分,则结果又明显不一样[71]。
因此,只有建立统一的稻曲病抗性分级标准,才能为水稻品种稻曲病抗性评价和抗病育种奠定良好的基础。
8.2 稻曲病抗性鉴定与抗性基因挖掘
研究者利用不同的遗传群体,鉴定了一些与稻曲病抗性相关的QTLs,这些QTLs 主要是数量性状位点控制,而目前还没有克隆到稻曲病抗性的主效基因。其次,水稻中是否存在抗稻曲病的基因以及水稻穗部性状差异(如水稻直立穗、散穗、密穗、大穗、长穗等性状)是否对稻曲病的抗性产生影响还有待研究。
因此,需要建立标准统一的稻曲病抗性鉴定技术,筛选广谱抗稻曲病水稻种质资源,并利用这些抗源,克隆稻曲病抗性相关基因。再通过开发这些基因功能标记,利用分子标记技术,将这些抗性基因转入到优良水稻品种中,进而培育出高产、优质、抗病的水稻新品种。
8.3 稻曲病侵染机制
国内外研究者对稻曲病菌侵染方式、侵染过程以及侵染机制等方面研究较多,然而有一些问题还需深入研究。例如,多数研究认为,稻曲病侵染时间主要集中在水稻孕穗期至破口期,推测这段时期病原菌较容易侵入并引起发病,但这种推测还缺乏严格实验数据和可靠证据[57-63]。一方面,稻曲病菌是通过局部侵染还是通过系统侵染还没有确凿的证据;大多数研究者根据发病症状和条件,推测稻曲病菌的侵染时期为水稻幼穗形成期至扬花期的局部侵染。其次,有研究者认为,病原菌通过种子、苗根、芽鞘和苗叶侵入并引起发病,但是这种推测没有详细证据,还需要深入的病理学研究。再次,稻曲病菌的寄主范围是什么?稻曲病菌在田间越冬途径是什么?稻曲病菌在侵染过程中如何坍缩花丝,使水稻无法完成授精,并进而阻断水稻的营养供应的?最后,稻曲球是如何形成的?稻曲球发育相关基因以及形成的机制是什么?这些均缺乏系统研究。
8.4 稻曲病菌与水稻互作机制
在拟南芥中,病原菌与寄主之间互作研究方面已基本形成,包括抗病R 蛋白与效应蛋白之间互作机制也取得一定进展。而稻曲病菌与水稻之间互作模式,抗病R 蛋白与效应蛋白之间识别关系,抗病蛋白识别和信号传导以及免疫反应遗传机制还不明确。例如,稻曲病菌与寄主之间的互作模式是不是存在独特性?病原菌效应蛋白和感病蛋白在稻曲病菌侵染过程中的具体功能是什么?水稻被稻曲病菌侵染诱导后,植物体内的活性氧相关基因的表达为什么上调?
因此,为了解决这些问题,研究者需要克隆稻曲病抗性相关蛋白,寻找对应的效应蛋白,通过进一步研究它们之间互作关系来揭示稻曲病抗病遗传机制;并利用病原菌基因组学和蛋白质组学数据库,来筛选鉴定病原菌中相关基因及蛋白的功能,并阐明稻曲病菌致病的遗传机理。
8.5 稻曲病监测预报和发病规律研究方面
由于稻曲病侵染期特殊性,不易被发现,等到可以观察到的时候,往往在水稻生产后期,这时候再去进行防治已经来不及,而且没有明显效果,所以对病害发生预测预报技术的开发迫在眉睫。例如,有研究者在稻曲菌侵染前期,通过快速检测方法来评估菌源数量,并快速采取应对措施,可以有效减少病害造成的损失。有研究者通过连续7、8 年监测不同区域、不同品种的稻曲病发生情况,结果显示其发生危害差异很大[72]。然而还有一些问题需要深入研究。例如,在不同气候情况条件下,空气中病原菌的孢子数量有没有变化,他们之间是否具有相关性?能否通过快速检测技术或测定技术,准确预测稻曲病的发病情况?
实际上,任何病害的发生都应有其规律可循,相当一部分研究表明,稻曲病发生与水稻破口到抽穗前后的天气条件极为相关。但张俊喜等[73]研究发现,2014 年江苏部分地区在水稻破口到抽穗前后天气非常适合稻曲病发病,但当年江苏省稻曲病发病很轻,甚至感病的品种当年也没有发病。
因此,全国各个单位和部门要联合协作攻关,加强稻曲病发生规律的研究,进行全面系统的调查,为稻曲病预测预报提供理论依据。同时要充分发挥中国疆土辽阔的优势,研究不同区域、不同品种以及不同气候条件稻曲病发生危害规律,从而为水稻新品种推广与稻曲病防治提供参考依据。
