工业发酵雪茄烟叶霉变微生物的分离鉴定及生物学特性研究
2024-01-30刘琳琳胡延奇常月勇时永楠
刘琳琳,芦 柯,胡延奇*,常月勇,李 艳,时永楠,李 萌,李 晓*
工业发酵雪茄烟叶霉变微生物的分离鉴定及生物学特性研究
刘琳琳1,芦 柯2,胡延奇1*,常月勇1,李 艳1,时永楠1,李 萌2,李 晓2*
(1.山东中烟工业有限责任公司济南卷烟厂,济南 250104;2.郑州轻工业大学烟草科学与工程学院,郑州 450000)
为明确引起工业发酵雪茄烟叶霉变的微生物种类及其生物学特性,从工业发酵霉变雪茄烟叶表面分离纯化得到3株霉菌,采用形态学和分子生物学结合的方法进行种属鉴定,并研究其生物学特性。结果表明曲霉属是本研究中引起工业发酵雪茄烟叶霉变的主要菌种,分离纯化得到3株霉变菌株分别为烟曲霉、黄曲霉和蒙地曲霉A。3株霉菌在不同培养基上的生长速度为黄曲霉>烟曲霉>蒙地曲霉。3株霉菌在25~35 ℃都能生长,40 ℃只有黄曲霉能生长,45 ℃及以上3株霉菌均不能生长。黄曲霉生长的最适pH为4,烟曲霉和蒙地曲霉生长最适pH为8~9。3株霉菌均对紫外光较敏感,紫外光照射15 min后致死率均达到90%以上。综上,本研究发现工业发酵过程中引起雪茄烟叶霉变的3种曲霉分别是烟曲霉、黄曲霉和蒙地曲霉,合理运用温度调控和紫外光照射对于防霉控霉有重要意义。
雪茄;霉变;微生物;鉴定;生物学特性
近年来雪茄消费量呈现高速增长的趋势,但优质雪茄原料的紧缺限制了雪茄产能的进一步提升[1]。发酵是提升雪茄烟叶品质的重要技术环节[2-5],国内雪茄烟叶发酵一般分为农业发酵和工业发酵两个环节完成[6]。农业发酵主要在雪茄烟晾制之后进行,而工业发酵主要目的是弥补初次发酵的不足,可以进一步改善雪茄的香吃味、提高烟叶工业可用性,所以雪茄烟叶在工业发酵之后才能进行卷制[7]。由于烟叶含水量较高且环境相对湿度较大,雪茄烟叶在工业发酵过程中发生霉变较为普遍,给企业带来巨大损失的同时也使得原料紧缺问题愈发突出。
烟叶霉变研究多集中于烤烟烟叶,曲霉属和青霉属真菌是其主要致霉微生物,不同地区主要霉菌有所不同[8-17]。如广西烟仓主要致霉微生物为溜曲霉、匍匐散囊菌和桔青霉[13];导致云南烘烤期烟叶霉变的微生物为少根根霉菌[16];山东仓储片烟霉菌主要类群为黄柄曲霉、黑曲霉、黄曲霉和桔青霉等[17]。
目前雪茄烟叶霉变的相关研究较少,有研究对仓储期间雪茄烟叶和成品雪茄烟的致霉菌进行了分离和鉴定[18-21],尚未见工业发酵中致霉菌的鉴定和生物学特性研究。本研究以工业发酵霉变雪茄烟叶为研究对象,对重要霉菌进行分离、纯化,并应用形态学结合系统发育树构建确定其分类地位,同时研究致霉菌的生物学特性,旨在为工业发酵中雪茄烟叶的霉变防控提供基础信息。
1 材料与方法
1.1 供试材料
工业发酵过程中霉变雪茄样品由山东中烟提供;PDA培养基,CYA培养基[22],烟汁培养基(1000 mL水加10 g雪茄烟叶,煮沸过滤后加水至1000 mL,加20 g琼脂,灭菌后得到1%烟汁培养基,同理可得5%、10%、20%烟汁培养基)。真菌基因组DNA快速抽提试剂盒购于上海尚宝生物科技有限公司;2×Taq Plus Master Mix II购于上海源叶生物有限公司;CaM5(5'-TCCGTAGGTGAACCTG CGG-3')和CaM6(5'-TCCTCCGCTTATTGATATGC-3')通用引物由生工生物工程(上海)有限公司合成。
1.2 研究方法
1.2.1 致霉微生物分离、纯化和致霉性验证 在无菌条件下,用接种环在霉变烟叶样品表面霉层挑取少量菌丝在PDA平板上点接,30 ℃恒温培养,待长出单菌落后,挑取单菌落在PDA平板点接培养,重复此操作2~3次,得到形态单一的菌落,即为疑似霉变病原菌菌株。取适量未霉变雪茄烟叶置于玻璃培养皿中,121 ℃灭菌30 min,将分离得到的疑似病原菌菌株用打孔器(内径为5 mm)打取菌饼,接种于灭菌后的雪茄烟叶表面,30 ℃培养5 d,观察疑似霉变菌株对雪茄烟叶的致霉效果,并打开培养皿盖对菌株生长情况进行拍照。从人工接种后发生霉变的烟叶上再次分离、纯化霉菌,观察与原菌株是否一致。
1.2.2 形态学鉴定 培养特征观察:将菌株分别接
种至PDA和CYA培养基,30 ℃恒温培养3~5 d,观察其菌落形态特征。镜检:采用斜插镜检法。将盖玻片倾斜45°插入PDA培养基中,将分离得到的霉变菌株分别点接于插有盖玻片的PDA平板培养基中央,待霉变菌株菌丝长至盖玻片1/2处时取出。将其固定在无水乙醇浸泡过的载玻片上,用结晶紫均匀染色后在显微镜下观察。
1.2.3 系统发育树构建 用真菌基因组DNA快速抽提试剂盒提取霉菌基因组DNA。应用通用引物和扩增钙调蛋白基因()片段,扩增程序参考宋嘉宝等[18]的试验条件略有改动。观察琼脂糖凝胶电泳产物条带;由生工生物工程(上海)有限公司对PCR产物测序,在NCBI数据库进行BLAST同源性比对测序结果,利用MEGA X软件构建系统发育树[23]。
1.2.4 生物学特性 (1)不同培养基对霉菌生长的影响。供试培养基有PDA、CYA和烟汁培养基(1%、5%、10%、20%)。菌株在PDA中培养3 d(30 ℃)后,用打孔器(内径为5 mm)打取菌饼,将其移入供试培养基,30 ℃培养3 d后测量菌落直径。每个处理设3个重复,下同。
(2)不同培养温度对霉菌生长的影响。将菌饼(直径为5 mm)移入新的PDA培养基,分别在25、30、35、40、45和50 ℃下培养,3 d后测量菌落直径。
(3)不同pH对霉菌生长的影响。取直径为5 mm的菌饼用无菌水冲洗表面孢子,再将其稀释成适宜浓度的孢子悬浮液。用HCl和NaOH溶液调节CYA液体培养基的pH,使CYA培养基的pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0。分别取1 mL孢子悬浮液加入梯度pH培养基中,于恒温摇床中28 ℃、110 r/min培养3 d,所得菌液在4 ℃下4000 r/min离心20 min,将上清液倒出,沉淀烘干称重。离心管质量为初始质量,菌丝体干质量=总质量−初始质量。
(4)紫外光对霉菌生长的影响。无菌条件下将0.1 mL(107cfu/mL)孢子悬浮液涂布于PDA平板上。涂布后将培养皿盖打开,分别在超净工作台的紫外灯下照射0(对照)、5、10、15、20和30 min后,在30 ℃下倒置培养5 d,记录平板单菌落数量。
致死率=(对照菌落数−处理后菌落数)/对照菌落数×100%。
1.3 数据处理
应用Excel和SPSS进行数据处理和统计分析。
2 结 果
2.1 霉变微生物的分离、纯化及致霉性验证
经过多次分离纯化,从霉变雪茄烟叶样品得到3株真菌,分别命名为SD4、SD8和SD9。为确定其致霉性,分别将3株菌株接种至雪茄烟叶,接种烟叶表面均出现与霉变烟叶样品相同的霉层(图1)。接种霉变烟叶可再次分离得到菌株SD4、SD8和SD9且无其他杂菌,证明3株菌株均为雪茄烟叶致霉菌。

图1 SD4、SD8、SD9接种后在烟叶上的生长情况
2.2 形态学分析及镜检
如图2所示,菌株SD4菌落在PDA培养基上整体呈淡褐色,边缘呈白色,表面较为平整;在CYA培养基上呈白色,菌落中间凸起,背面有浅橙色色素沉积。菌株SD8菌落在PDA培养基上整体呈淡绿色,边缘呈浅黄色,表面呈粉末状;在CYA培养基上呈白色,中间呈黄色粉末状,菌落表面呈不规则凸起,背面有褶皱且有淡黄色色素沉积。菌株SD9菌落在PDA培养基上整体呈翠绿色,表面有黄绿色颗粒,中间凸起;在CYA培养基上菌落整体呈墨绿色,表面呈均匀褶皱状,背面中心有深褐色色素沉积。
菌丝形态均在100倍油镜下观察,结果如图3所示。SD4菌株孢子呈圆形或椭圆形,菌丝有隔膜。SD8菌株孢子呈圆形,菌丝有隔膜,顶囊呈近球形,分生孢子呈放射状。SD9菌株孢子呈椭圆形,菌丝有隔膜,顶囊呈近球形,分生孢子头为辐射状或疏松柱状。
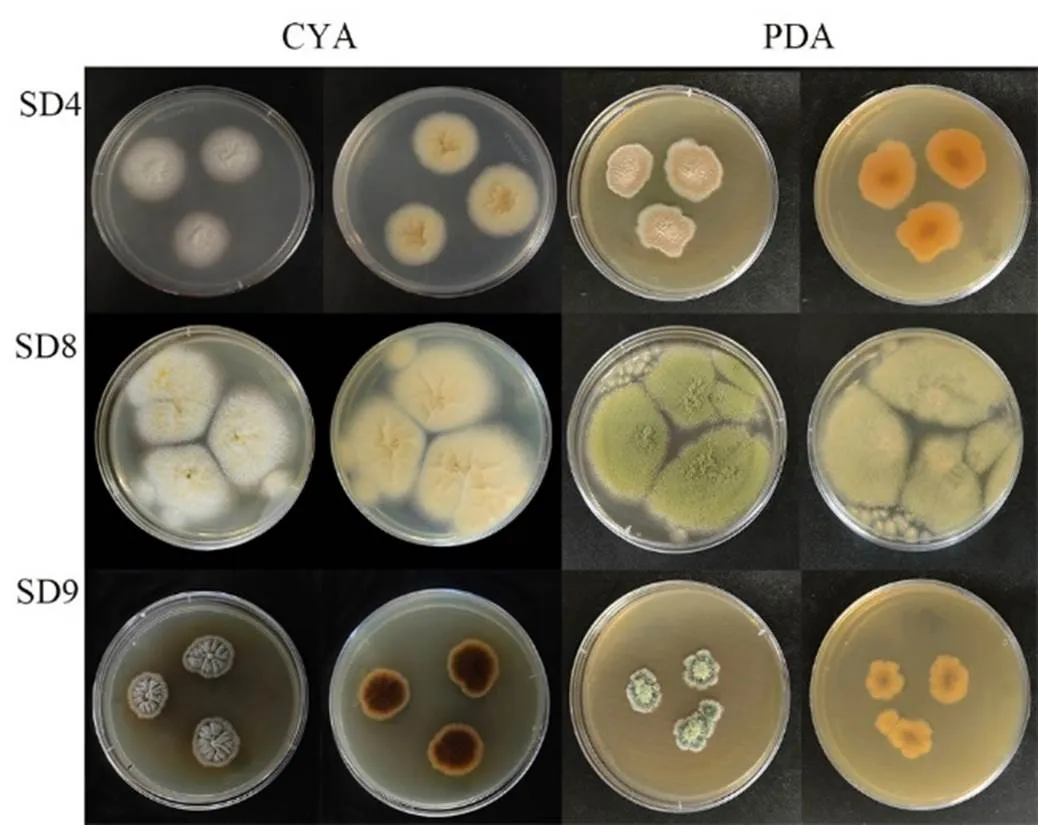
图2 菌株SD4、SD8、SD9菌落形态特征
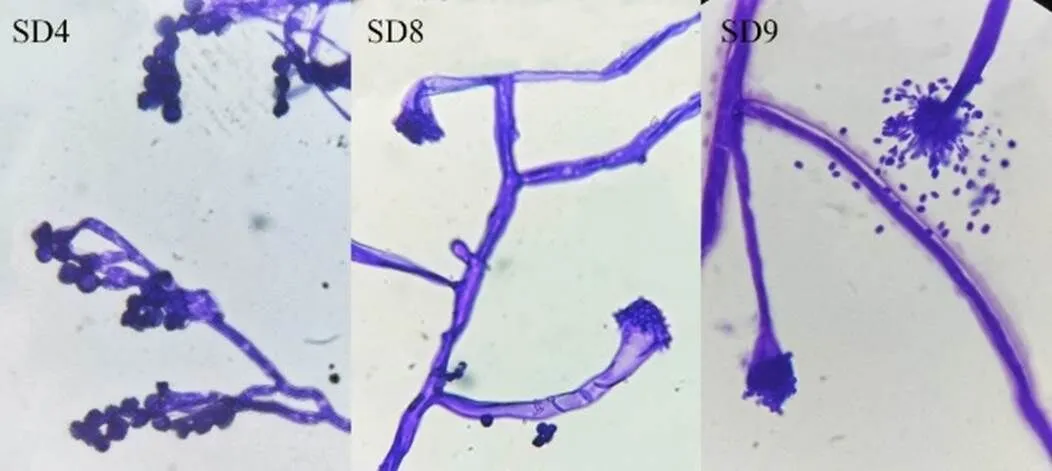
图3 菌株SD4、SD8、SD9镜检
2.3 分子鉴定
PCR扩增产物在550 bp处有单一且明亮的条带,可用于菌株鉴定(图4)。根据基因序列构建的系统发育树如图5、图6和图7所示。根据菌株形态特征和序列比对结果可知,SD4、SD8和SD9均属于曲霉属,分别为烟曲霉、黄曲霉和蒙地曲霉(表1)。
2.4 生物学特性
2.4.1 不同培养基对霉菌生长的影响 如表2所示,3种霉菌在CYA上生长最好,在PDA上次之,在烟汁培养基上生长最慢。SD8在几种供试培养基上的生长速度均最快,其次为SD4,而SD9整体生长速度较慢。3株霉菌在不同培养基上的生长速度和适应性为SD8>SD4>SD9。

图4 PCR产物电泳图
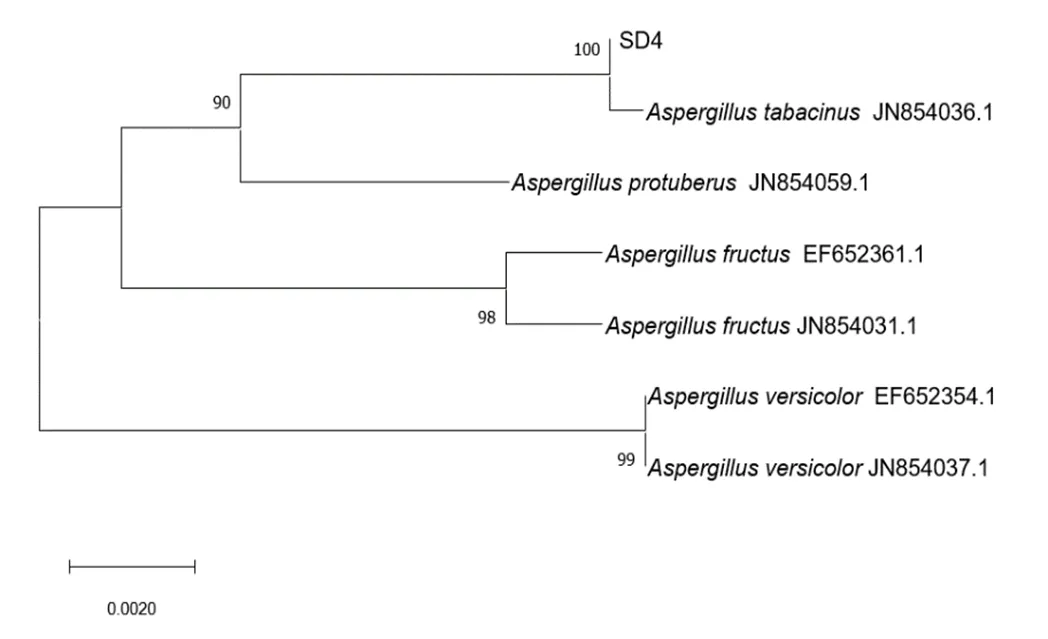
图5 菌株SD4系统发育树
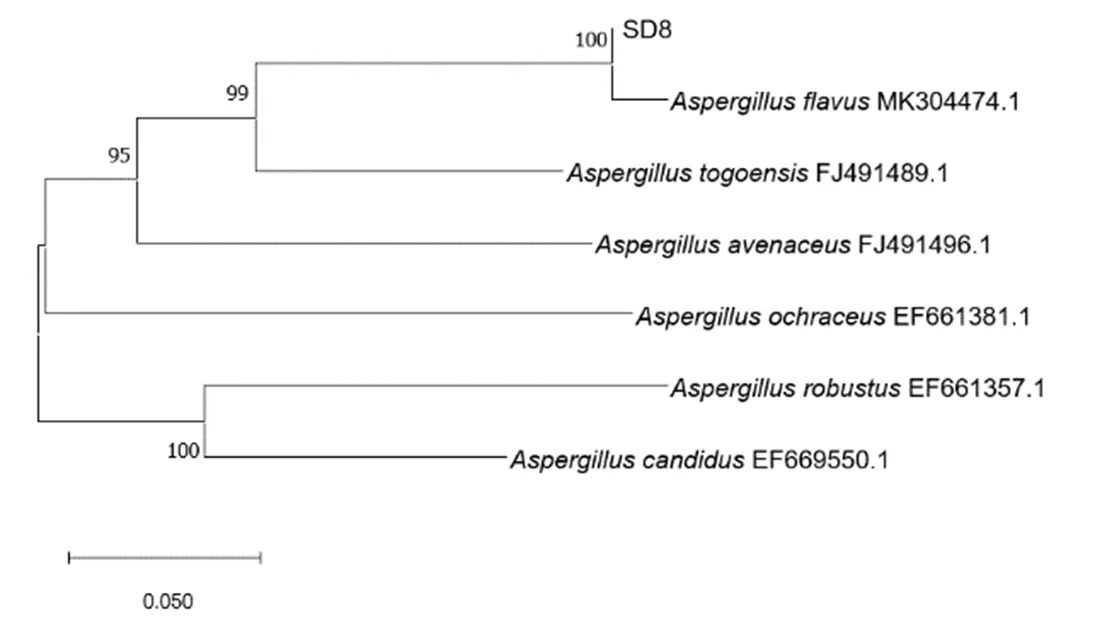
图6 菌株SD8系统发育树
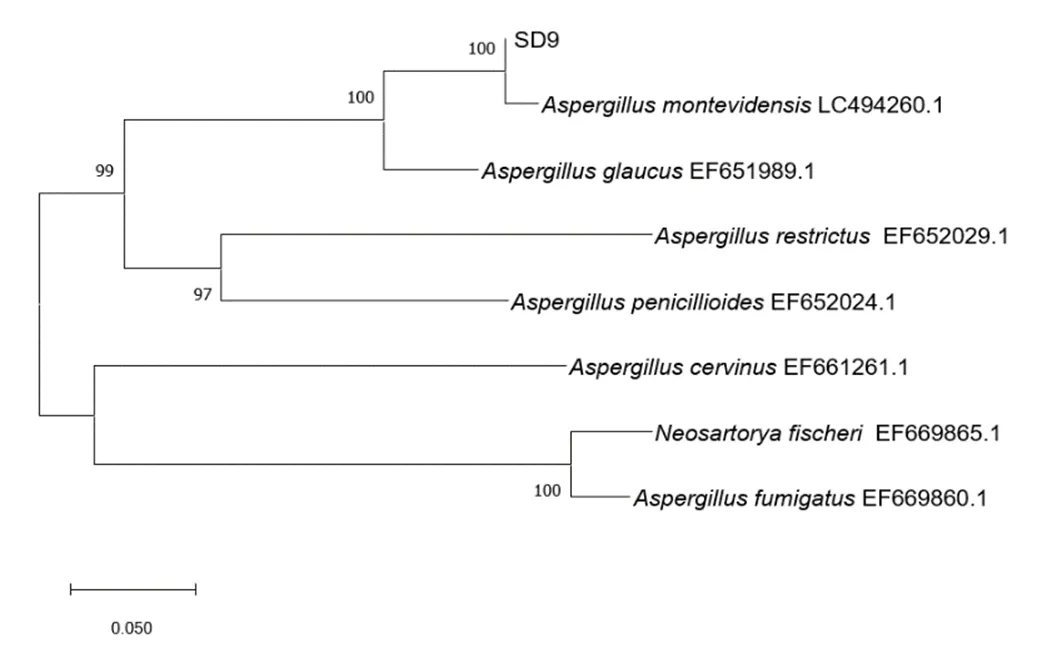
图7 菌株SD9系统发育树
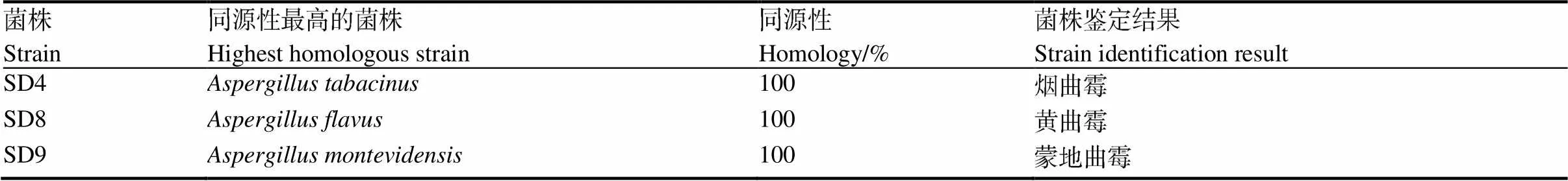
表1 雪茄烟叶霉变菌株的序列分析

表2 3株霉菌在不同培养基上生长3 d 的菌落直径
注:表内数据为平均值±标准误,同行不同小写字母、同列不同大写字母表示差异显著(<0.05),下同。
Note: The data in the table are presented as mean ± standard error, and different lowercase letters in the same row and different uppercase letters in the same column indicate significant differences (<0.05), as indicated in the following tables.
2.4.2 不同培养温度对霉菌生长的影响 如表3所示,3株霉菌在25 ℃~35 ℃均生长较好,只有SD8在40 ℃还能生长,45 ℃及以上温度3株霉菌均不能生长。SD4在25 ℃~35 ℃范围内随着温度的升高生长速度逐渐加快;SD8和SD9在可生长温度范围内,均呈现随温度升高菌株生长速度先增高后降低的趋势,且均在30 ℃生长状况最好。
2.4.3 不同pH对霉菌生长的影响 如图8所示,3株霉菌在pH为3~10的环境中均能生长,SD4的最适pH在8~9之间,适合在偏碱性的环境中生长;SD8的最适pH为4,表现出较好的耐酸性;SD9的最适pH为9,碱性环境更适合菌株SD9生长。
2.4.4 紫外光对霉菌生长的影响 不同紫外光照射时间对3种霉菌的影响如图9所示,紫外光照射5 min后SD8的死亡率达到51%;10 min后SD4、SD8和SD9的死亡率分别达到了96%、71%、64%;15 min后3株霉菌的死亡率均高于90%;随着照射时间的增加,3株霉菌的死亡率最终均接近100%。3株霉菌均对紫外光较为敏感,可以考虑在发酵前对车间环境进行紫外消杀。
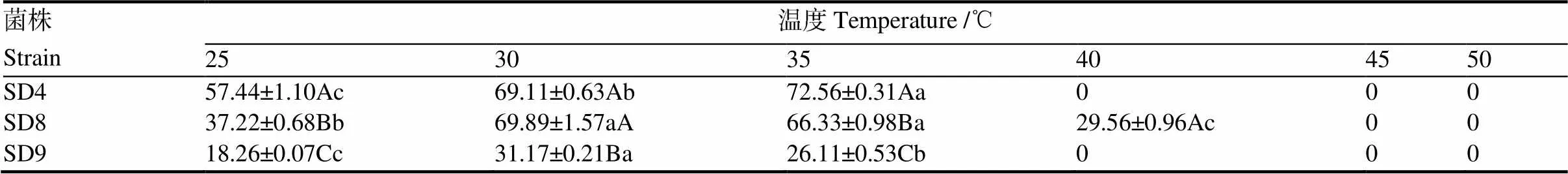
表3 3株霉菌在不同温度下生长3 d 的菌落直径
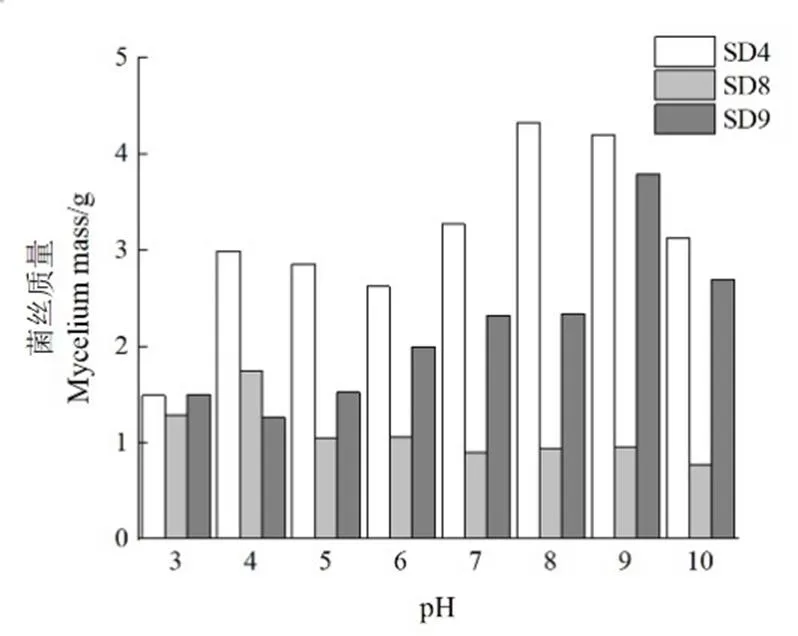
图8 不同pH对3种霉菌生长状况的影响
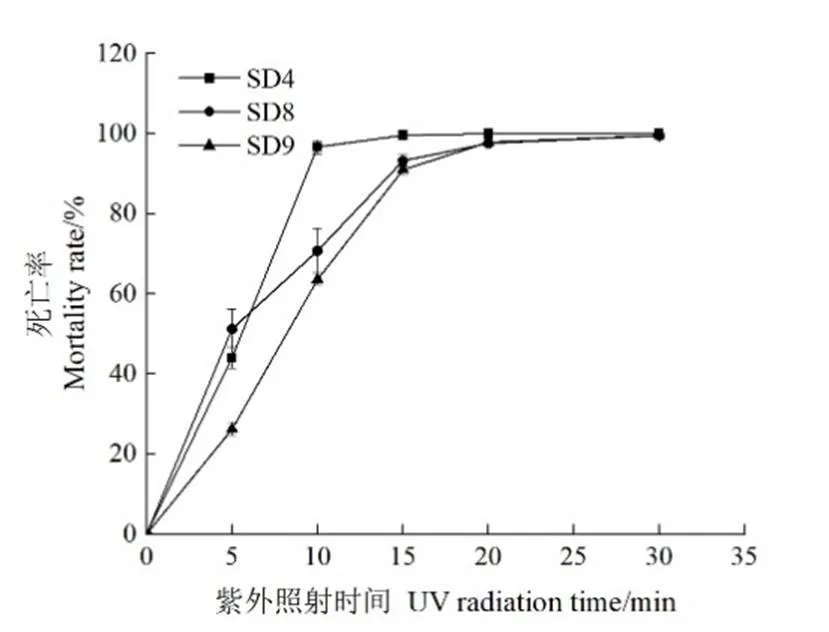
图9 不同紫外光照射时间对3种霉菌的影响
3 讨 论
目前针对烟草制品霉变的研究多集中于烤烟和成品烟支,对雪茄烟叶的研究较少。宋嘉宝等[18]研究发现曲霉属、蓝状菌属和帚霉属是引起海南仓储雪茄烟叶霉变的主要霉菌种类,朱贝贝等[19]和张岱源等[20]分别以雪茄烟叶和手工雪茄为研究对象,均分离得到了聚多曲霉()和产黄青霉()两种霉菌。本研究分离鉴定的工业发酵过程中引起雪茄霉变的3株霉菌均为曲霉属,分别是烟曲霉、黄曲霉和蒙地曲霉,其中黄曲霉与付克剑等[21]的研究结果一致,其余两种均为首次报道。但本研究只通过致霉性试验确定上述菌株为致霉菌,未定量研究导致烟叶霉变的接种量临界值,后续将开展相关试验,为优化雪茄烟叶微生物群落生态系统提供相应的数据支撑。
试验结果表明3株霉菌均在CYA培养基上生长最好。除黄曲霉的最适pH为4外,其余两种菌株的最适pH均为8~9。3株霉菌最适生长温度均在25~35 ℃之间,烟曲霉的最适温度高于其他两种霉菌,均在霉菌适宜生长温度范围内[24];烟曲霉和蒙地曲霉在40 ℃就停止生长,而黄曲霉在45 ℃及以上不生长。发酵过程中合理调控发酵温度一定程度上可以抑制霉菌正常生长,从而减少烟叶霉变。
Calado等[25]讨论了紫外照射对于霉菌生长的抑制作用,白冬红等[26]研究了不同方式(使用食品防腐剂和紫外照射等方式)对产黄青霉和黑曲霉生长的影响,结果表明紫外照射10 min,对两种霉菌的杀菌率分别达到93.85%和76.65%。本研究中紫外光照射对于3种菌株的影响均较大,紫外光照射15 min后3种菌株的死亡率分别为99%、93%和91%。烟叶发酵前合理运用紫外光对车间环境进行消杀,可以抑制霉菌的生长,从而减少发酵过程中雪茄烟叶的霉变。
4 结 论
从工业发酵霉变雪茄烟叶上分离到3株致霉微生物SD4、SD8、SD9,经鉴定分别为烟曲霉、黄曲霉和蒙地曲霉,除黄曲霉外的两株霉菌为首次报道;3株霉菌均在CYA培养基上生长最好,PDA次之,在烟汁培养基上生长的最慢,在不同培养基上的生长速度和适应性表现为SD8>SD4>SD9;3株霉菌在25~35 ℃都能正常生长,只有SD8在40 ℃能生长,其余2株霉菌在40 ℃及以上不生长;3株霉菌在pH 3~10的环境内均能生长,SD8最适pH为4,SD4和SD9最适pH为8~9;3株霉菌对紫外光均较敏感,照射15 min后死亡率均高于90%,可以考虑在发酵前对车间环境进行紫外消杀。
[1] 蔡斌,耿召良,高华军,等. 国产雪茄原料生产技术研究现状[J]. 中国烟草学报,2019,25(6):110-119.
CAI B, GENG Z L, GAO H J, et al. Research progress of production technologies of cigar tobaccos in China[J]. Acta Tabacaria Sinica, 2019, 25(6): 110-119.
[2] AMAURY B M, FRANCISCO J C, ISNERI T B, et al. The role of chemosensory relationships to improve raw materials’ selection for premium cigar manufacture[J]. Chemical Papers, 2021, 75(8): 1-17.
[3] JIA Y, LIU Y F, HU W R, et al. Development ofautochthonous starter for cigar fermentationdissecting the microbiome[J]. Frontiers in Microbiology, 2023, 14: 1138877.
[4] 黄阔,李栋,王彬,等. 雪茄烟叶工业发酵过程中细菌群落多样性和结构变化[J]. 烟草科技,2023,56(5):17-24.
HUANG K, LI D, WANG B, et al. Variations of bacterial community diversity and structure of cigar tobacco during industrial fermentation[J]. Tobacco Science and Technology, 2023, 56(5): 17-24.
[5] 胡婉蓉,蔡文,郑召君,等. 发酵介质和发酵过程对雪茄烟叶品质的影响[J]. 烟草科技,2023,56(2):41-52.
HU W R, CAI W, ZHENG Z J, et al. Effects of fermentation media and process on cigar tobacco quality[J]. Tobacco Science and Technology, 2023, 56(2): 41-52.
[6] 张倩颖,罗诚,李东亮,等. 雪茄烟叶调制及发酵技术研究进展[J]. 中国烟草学报,2020,26(4):1-6.
ZHANG Q Y, LUO C, LI D L, et al. Research progress in curing and fermentation technology for cigar tobacco leaf production[J]. Acta Tabacaria Sinica, 2020, 26(4): 1-6.
[7] 潘勇,李林林,方欣,等. 工业发酵对雪茄茄芯中性香气成分的影响[J]. 湖北农业科学,2023,62(5):142-147,195.
PAN Y, LI L L, FANG X, et al. Effect of industrial fermentation on neutral aroma components of cigar core[J]. Hubei Agricultural Science, 2023, 62 (5): 142-147,195.
[8] YANG D Q. Isolation of wood-inhabiting fungi from Canadian hardwood logs[J]. Canadian Journal of Microbiology, 2005, 51(1): 1-6.
[9] 雷声,杨乾栩,师艳萍,等. 成品卷烟霉变微生物的分离纯化与鉴定[J]. 食品与机械,2019,35(9):98-101.
LEI S, YANG Q X, SHI Y P, et al. Isolation, purification and identification of microorganisms in moldy cigarettes products[J]. Food and Machinery, 2019, 35(9): 98-101
[10] WELTY R E, NELSON L A. Growth ofin flue-cured tobacco[J]. Applied Microbiology, 1971, 21(5): 854-859.
[11] 李魁,李廷生,王平诸,等. 我国烟草真菌区系调查及霉变成因的研究[J]. 郑州工程学院学报,2003,24(3):20-24.
LI K, LI T S, WANG P Z, et al. Study on mycoflora in tobacco and the cause of its going mildewed[J]. Journal of Zhengzhou Institute of Technology, 2003, 24(3): 20-24.
[12] 程龙,徐亮,赵晓忠. 仓储片烟霉变微生物的研究进展[J]. 贵州农业科学,2015(1):77-80.
CHENG L, XU L, ZHAO X Z. Advances in mildewed microorganism in stored tobacco stripes[J]. Guizhou Agricultural Sciences, 2015(1): 77-80.
[13] 晏卫红,黄思良,朱桂宁,等. 广西仓储烟叶霉变微生物的分类鉴定[J]. 烟草科技,2008(2):50-56.
YAN W H, HUANG S L, ZHU G N, et al. Taxonomy and identification of microorganism causing mold damage of stored tobacco leaf in Guangxi[J]. Tobacco Science and Technology, 2008(2): 50-56.
[14] 张成省,王海滨,李更新,等. 仓储片烟霉变的影响因素分析[J]. 中国烟草科学,2011,32(3):80-83.
ZHANG C S, WANG H B, LI G X, et al. Mildew factor analysis of stored flue-cured tobacco strips[J]. Chinese Tobacco Science, 2011, 32(3): 80-83.
[15] 王革,张中义,孔华忠,等. 云南烟叶贮藏期霉变研究(1)——曲霉[J]. 云南农业大学学报,2002,17(4):356-359,363.
WANG G, ZHANG Z Y, KONG H Z, et al. Storage mold diseases of Yunnan tobacco (1):[J]. Journal of Yunnan Agricultural University, 2002, 17(4): 356-359, 363.
[16] 卢灿华,苏家恩,盖晓彤,等. 烤烟霉变病原菌鉴定及其生防菌筛选[J]. 中国烟草科学,2022,43(2):45-51.
LU C H, SU J N, GAI X T, et al. Causal pathogen identification and antagonistic bacteria screening of tobacco leaf mold[J]. Chinese Tobacco Science, 2022, 43(2): 45-51.
[17] 张成省,林建胜,孔凡玉,等. 山东仓储片烟表面微生物区系研究[J]. 中国烟草学报,2010,16(4):58-62,66.
ZHANG C S, LIN J S, KONG F Y, et al. Research on phyllosphere microflora in stored flue-cured tobacco strips in Shandong province[J]. Acta Tabacaria Sinica, 2010, 16(4): 58-62, 66.
[18] 宋嘉宝,王明锋,罗昭标,等. 海南雪茄烟叶霉变微生物鉴定及拮抗菌株筛选[J]. 烟草科技,2022,55(11):7-13.
SONG J B, WANG M F, LUO Z B, et al. Identification of microorganisms resulted mildew on Hainan cigar tobacco and their antagonistic strains’ screening[J]. Tobacco Science and Technology, 2022, 55(11): 7-13.
[19] 朱贝贝,黄阔,薛芳,等. 手工雪茄主要霉菌的分离鉴定及其生物学特性研究[J]. 中国烟草学报,2023,29(6):93-101.
ZHU B B, HUANG K, XUE F, et al. Isolation and identification of major molds in handmade cigars and study of their biological characteristics[J]. Acta Tabacaria Sinica, 2023, 29(6): 93-101.
[20] 张岱源,叶长文,李栋,等. 湖北雪茄烟叶致霉菌分离鉴定及芽胞杆菌属拮抗菌株筛选[J]. 烟草科技,2023,56(6):8-16.
ZHANG D Y, YE C W, LI D, et al. Isolation and identification of molds in Hubei cigar tobacco and screening of antagonistic strains ofspp[J]. Tobacco Science and Technology, 2023, 56(6): 8-16.
[21] 付克剑,宋学茹,杨芳,等. 玉溪雪茄烟发酵霉变病原菌鉴定及生防菌筛选[J]. 中国烟草科学,2023,44(4):41-48.
FU K J, SONG X R, YANG F, et al. Identification of pathogenic fungi and screening for biocontrol bacteria during fermentation of Yuxi cigars[J]. Chinese Tobacco Science, 2023, 44(4): 41-48.
[22] 沈萍,陈向东. 微生物学实验[M]. 北京:高等教育出版社,2008.
SHEN P, CHEN X D. Experiments in microbiology[M]. Beijing: Higher Education Press, 2008.
[23] KUMAR S, STECHER G, TAMURA K, et al. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874.
[24] SAMSON R A, VISAGIE C M, HOUBRAKEN J, et al. Phylogeny, identification and nomenclature of the genus[J]. Studies in Mycology, 2014, 78: 141-173.
[25] CALADO T, VENÂNCIO A, ABRUNHOSA L. Irradiation for mold and mycotoxin control: areview[J]. Comprehensive Reviews in Food Science and Food Safety, 2014, 13(5): 1049-1061.
[26] 白冬红,陈义伦,张晶,等. 柿饼污染霉菌的实用控制技术研究[J]. 山东农业科学,2018,50(3):98-102.
BAI D H, CHEN Y L, ZHANG J, et al. Study on practical control technology on mold contaminating dried persimmon[J]. Shandong Agricultural Sciences, 2018, 50(3): 98-102.
Isolation, Identification and Biological Characterization of Mold Species from Industrial Fermented Cigar Tobacco Leaves
LIU Linlin1, LU Ke2, HU Yanqi1*, CHANG Yueyong1, LI Yan1, SHI Yongnan1, LI Meng2, LI Xiao2*
(1. Jinan Cigarette Factory of China Tobacco Shandong Industry Limited Company, Jinan 250104, China; 2. College of Tobacco Science and Engineering, Zhengzhou University of Light Industry, Zhengzhou 450000, China)
To identify the mold species during the industrial fermentation process of cigar tobacco leaves, fungi were isolated and purified from the surface of moldy cigar tobacco leaves, and were identified with the combination of morphological and molecular techniques. The biological characteristics of mold were also investigated. The results showed that the main mold causing moldiness of cigar tobacco leaves werein this study, and three strains of mold were identified as,and. The growth rate of the three mold strains were in the order of>>on different culture media. All three mold strains could grow at 25 ℃ to 35 ℃, onlycould grow at 40 ℃, and none of the strains could grow at 45 ℃or higher temperature. The optimal pH forwas 4, whileandwere most suitable for pH 8-9. All three mold strains were sensitive to UV radiation, and after 15 minutes of exposure, the mortality rate was over 90%. Overall, the results from this study indicated that the three types ofthat cause cigar tobacco leaf mold during industrial fermentation are,and. The rational use of ultraviolet irradiation is important for mold control and prevention.
cigar; mold; microorganisms; identification; biological characteristics
TS41+4
A
1007-5119(2023)06-0100-06
中国烟草总公司重大科技项目(110202201034);山东中烟工业有限责任公司科技项目(KJXM-GS-202202006)
刘琳琳(1990-),女,助理工程师,硕士,主要从事微生物技术研究。E-mail:lll9066@163.com*通信作者。胡延奇,E-mail:huyanqi1971@163.com;李 晓,519389150@qq.com
2023-06-16
2023-10-11
10.13496/j.issn.1007-5119.2023.06.014
