骨盆影像学测量预测直肠癌手术难度的研究进展
2024-01-29余淼李瑞杰袁子涵董晓强
余淼, 李瑞杰, 袁子涵, 董晓强
(苏州大学附属第一医院普外科, 江苏 苏州 215000)
2023年最新癌症统计显示,全球男性、女性结直肠癌发病率均居恶性肿瘤第三位,死亡率均居第二位[1]。然而中国的结直肠癌发病率远高于发达国家,且发病率和死亡率均在上升,并呈现年轻化的趋势[2]。直肠癌手术自20世纪80年代Heald等[3]引入标准化的全直肠系膜切除术(total mesorectal excision,TME)以来,直肠癌外科手术治疗发生了革命性变化。TME结合了沿直肠系膜筋膜的精确解剖、原发肿瘤完全切除和最大化局部区域清除的理念,能做到原发肿瘤的整块切除及其血液供应和淋巴引流的清扫,已成为中低位直肠癌的标准治疗方法。TME是中低位直肠癌外科治疗的金标准,已被证实可以显著提高生存率[4-5]。环周切缘状态是肿瘤复发的重要预测因素,是肿瘤预后的有力预测因子[6]。对于超低位及局部晚期的直肠癌患者,环周切缘的肿瘤阳性率往往较高,然而采用TME的创新手术方式,例如:经肛门全直肠系膜切除术(TaTME)、机器人直肠手术,可能会降低此类患者阳性率的发生[7]。目前对影响手术的难治性骨盆仍没有明确的定义,各国对此的看法也不尽相同,文献中几乎没有相关的研究报告。本文主要对近些年的直肠癌手术技术发展、手术难度鉴定、骨盆影像学测量及其与直肠癌手术难度的关系等进行综述。
1 直肠癌手术技术发展
直肠癌手术有近两百年历史,随着手术的发展,形成了一些经典的手术方式,例如Dixon手术、Miles手术、Hartmann手术等。近二十年来,随着微创手术的发展,腹腔镜手术均可与经典手术相结合,从而达到微创。腹腔镜切除术与开腹手术相比,在近期疗效方面有较大优势[8]。而且,TaTME和机器人直肠手术等新兴技术为直肠癌的治疗提供了更多的选择,TaTME是一种自下而上的手术策略和TME的手术理念,在深而狭窄的骨盆中,使用这种方法进行肠系膜切除和低位直肠切除可能会更容易[9-10],为低位直肠癌提供了保留括约肌的可能性。机器人直肠手术有多个可以360°旋转的机械臂,可以克服骨盆解剖带来的困难,执行人手和传统腹腔镜都无法完成的操作,但机器人手术昂贵,只能选择性地应用于能从这项新技术中受益的患者。此外,尚有直肠经腹肛管拉出切除术(Bacon术)、超低位直肠前切除结肠肛管吻合术(Parks术)、经内外括约肌间直肠切除术(ISR术)与腹腔镜手术相结合改良,可为保肛愿望强烈的超低位直肠癌患者提供保肛机会,为困难的骨盆手术提供便利。手术原则均是沿着直肠尽可能地解剖至盆底水平,从而减少腹部伤口;功能化、精细化、微创化的解剖分离有利于盆腔自主神经的保护,在保证根治性切除(R0)的前提下一定程度地保存患者的肛门括约肌控制力、排尿及性功能,使患者创伤最小化,功能保留最大化[11]。综上所述,随着新兴技术及手术方式的迅速崛起,直肠癌手术方式在不断创新。但直肠癌患者存在个体差异性,术前需评估手术的难度,根据患者不同的情况,选择适合个体的最佳手术方式,从而提升患者的预后和生活质量。
2 直肠手术难度鉴定
对于直肠手术难度的诊断标准尚无明确定义。文献中相关研究报告也较少,并且标准不一致。例如Escal等[12]根据手术难度制定了如下评分标准:手术持续时间>300 min为3分、转为开放手术为3分、经肛门切除为2分、术后住院时间>15 d为2分、失血量>200 mL和并发症(Ⅱ级和Ⅲ级)均为1分;手术难度等级范围为0~12分,得分≥6分的直肠癌手术被认为是高难度的手术。Yamamoto等[13]分析了121例接受微创直肠手术患者的数据,发现失血量中位数仅为30 mL,因此,对失血量的阈值进行了调整。此外,手术时间和术后住院时间中位数分别为310 min和18 d,所以对这些标准也进行了相应调整。而在Sun等[14]和Chen等[15]的研究中,术后平均住院时间分别为8 d和7.7 d,因此将术后住院的标准临界值调整为7 d进行分析;此外,他们定义总分>3分为高难度手术,而不是Escal等研究中使用的≥6分。而一部分作者只将手术时间和(或)出血量作为手术难度诊断的标准,从而来寻求骨盆测量参数与手术难度间的关系[16-19]。尚有部分作者将TME质量和环周切缘状态纳入结局变量中,寻求手术质量及效果与骨盆测量参数之间的关系[15,20-23]。
3 骨盆影像学测量
临床上,MRI与CT对于直肠癌诊断及术前分期都具有重要的应用价值。CT通过对人体进行逐层扫描,经计算机处理而获得重建图像,以不同灰度显示其密度的高低,具有很高的密度分辨力,易于检查病变,特别是能够较早地发现小病变和较准确显示病变范围。在直肠癌检查中CT能够显示出病变处软组织肿块和远处转移征象[24]。而且薄层螺旋CT成像可以3D重建骨盆[25],可以测量骨盆任何轴向的距离,从而更准确地评估骨盆参数。与CT相比,MRI具有更高的组织分辨力,对直肠癌的术前评估有许多优点[26]:① MRI对测量盆腔解剖方面具有较高准确性,在重建盆底肌肉、神经和血管方面也具有优势;② MRI可以更清楚地显示直肠周围的软组织,更准确地检测直肠系膜状况;③ MRI还可以评估肿瘤侵犯黏膜的深度和直肠系膜周围可疑的淋巴转移[27]。术前患者CT/MRI的骨盆解剖影像学测量可以用来评估手术难度。MRI骨盆影像学测量见图1,包括以下数据[28-30]:骶岬顶点与耻骨上缘中点之间的距离;耻骨联合下缘中点与骶尾部前缘中点的连线;耻骨联合下缘至尾骨尖的距离;耻骨矢状面中线的长度;骶骨顶点到尾骨尖的距离;从骶尾凹陷最深处到骶尾部距离的垂线;耻骨联合下缘至骶岬上缘中点的距离;两侧坐骨棘间的距离;两侧坐骨结节间的距离;第五骶椎尖端严格轴位T2加权图像直肠肠管面积;第五骶椎尖端严格轴位T2加权图像直肠系膜周围的整体区域,包括直肠区和直肠系膜脂肪区面积;第五骶椎尖端严格轴位T2加权图像上的直肠系膜脂肪面积;耻骨联合上缘与骶骨岬连线的夹角;构成骨盆入口前后径的连线延长线与骨盆出口前后径延长线之间的夹角。
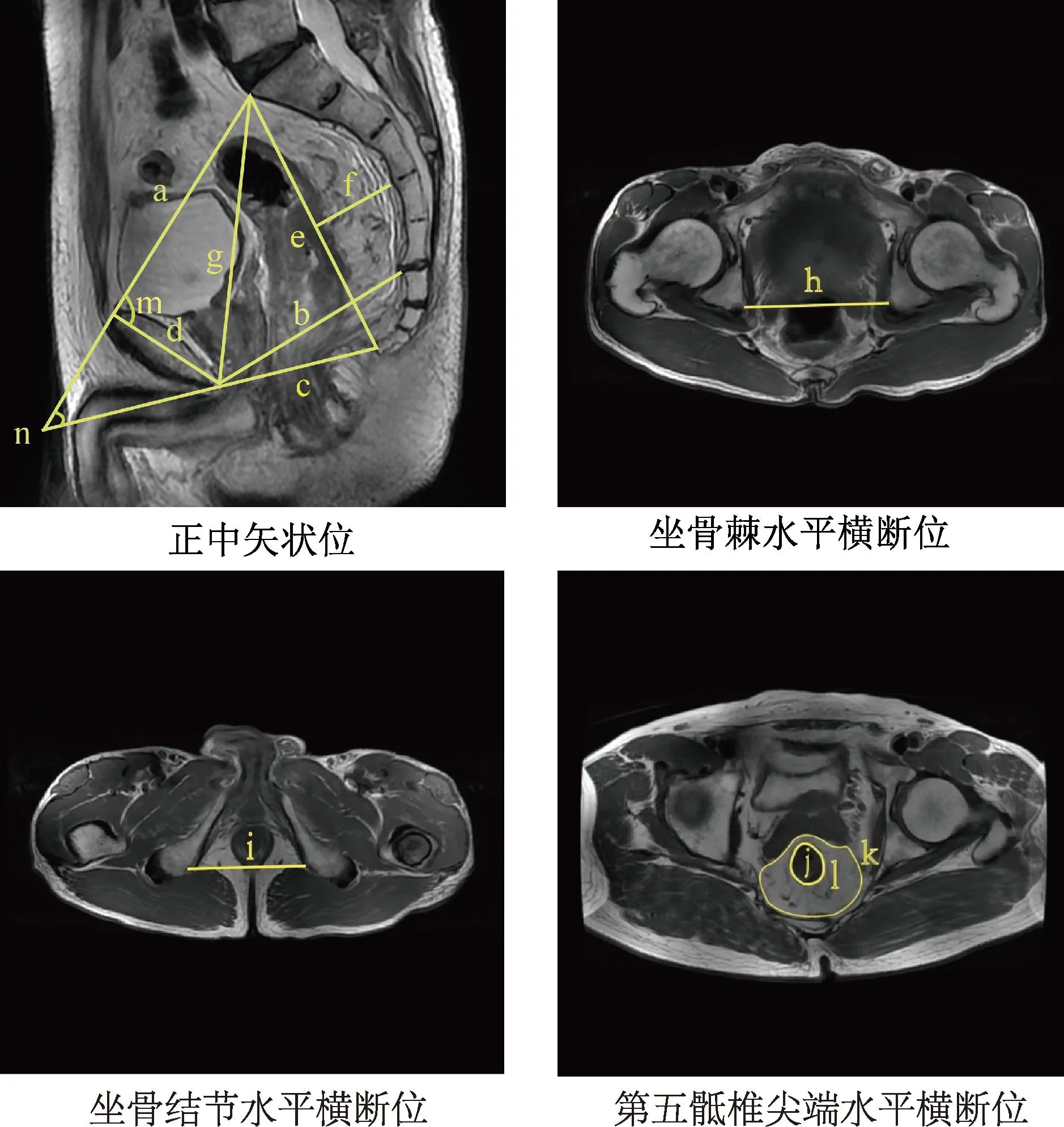
a:入口前后径;b:中骨盆前后径;c:骨盆出口前后径;d:耻骨上下径;e:骶尾径;f:骶尾曲度深度;g:骶耻内径(又称对角径);h:坐骨棘间径;i:坐骨结节间径;j:直肠面积;k:直肠系膜面积;l:直肠系膜脂肪面积;m:耻骨-骶骨角;n:骶尾-耻骨角
4 骨盆影像学测量参数与直肠癌手术难度的关系
4.1 骨盆测量参数与手术时间
骨盆测量最初用于评估阴道分娩成功的可能性[31],随着腹腔镜技术的不断探索,近年来,国内外众多结直肠专家也将目光投向了骨盆的测量。他们的手术难度标准各不相同,且选择从不同的角度、不同的参数来寻找手术难度与骨盆测量之间的关系。手术时间和手术中出血量是衡量手术难度最方便的指标。Teng等[19]按所有外科医生的手术时间中位数设置为截点值,手术时间大于截点值的直肠癌患者分配到长手术时间组,其他患者分配到短手术时间组,通过单因素及多因素分析发现只有体重指数和骨盆入口前后径是手术时间的独立预测因子;此外,长手术时间组吻合口瘘发生率较高。Wang等[32]收集了14例直肠癌患者人口统计数据、肿瘤特征和骨盆测量值,使用相关系数分析、主成分分析和线性回归,发现骨盆横径、体重指数、耻骨-骶骨角和耻骨到尾骨距离对手术时间有明显影响,且所建模型能较好地用于术前预测手术时间。Zhou等[16]研究显示体重指数、肿瘤高度、淋巴结转移、骨盆入口前后径、骨盆出口前后径、耻骨上下径、骶尾部曲度深度、骶尾-耻骨角、耻骨到尾骨距离是影响直肠癌患者手术时间的主要因素。除了相关的临床病理参数外,更宽、更浅和更少弯曲的骨盆可能会减少手术时间和术中失血量;相反,当治疗更深、更窄或更大弯曲骨盆的患者时,手术难度可能会增加[28]。表观扩散系数(ADC)显示的是水分子在细胞间隙中的相对运动,由磁共振弥散加权成像(DWI)确定,DWI可分析水质子在细胞外运动的差异,以区分不同细胞结构的组织[33]。ADC值的降低意味着水分子的自由度降低,因为细胞内空间变窄[34]。因此,ADC值被认为反映了组织中细胞的充血情况。Suzumura等[35]发现直肠系膜较低的ADC值是延长手术时间和失血量增加的独立危险因素,可能是腹腔镜直肠癌手术难度的预测指标。Huang等[36]对机器人辅助的直肠系膜切除术和ISR术进行了亚组分析,结果对于中低位直肠癌患者,肿瘤距肛缘的距离和骶骨长度与手术时间独立相关;病理T分期、骶尾径和直肠系膜脂肪面积是机器人辅助直肠系膜切除术手术时间的独立预测因素,较小的直肠系膜区域与机器人辅助的ISR术较长的手术时间独立相关。
4.2 骨盆测量参数与术中及术后综合指标
当然,也有结合直肠手术术中和术后指标来综合定义手术难度的。Escal等[12]收集164例直肠癌患者,并制定了手术难度的评分标准:手术持续时间>300 min为3分、转为开放手术为3分、经肛门切除为2分、术后住院时间>15 d为2分、失血量>200 mL为1分和并发症(Ⅱ级和Ⅲ级)为1分;得分≥6分的直肠癌患者分到高难度手术组,得分<6分的直肠癌患者分到低难度手术组。通过多因素分析发现,体重指数>30 kg/m2、结肠肛门吻合术、坐骨结节间径<10.1 cm、直肠系膜脂肪面积>20.7 cm2与较高的手术难度相关。Yamamoto等[13]按照此标准调整后将直肠癌患者分成低难度手术组和高难度手术组,多因素分析显示,体重指数>25 kg/m2、肿瘤直径>45 mm、肛门直肠角度>123°、骨盆出口前后径<82.7 mm与手术难度高度相关;用这些指标设计的4变量评分模型对手术难度显示出较好的预测价值。在高难度手术的患者中吻合口瘘的发生率为53%,而低难度手术的患者中吻合口瘘的发生率为6%,且高难度组的局部复发率显著高于低难度组。此外Yuan等[37]共纳入122例中低位直肠癌患者,多因素Logistic回归分析显示,体重指数、入口前后径和坐骨结节间径是手术难度的独立预测因素,结合这些预测因素构建的诺模图模型可较好预测手术的难度。
4.3 骨盆测量参数与TME质量
TME的质量和环周切缘状态也是评价直肠手术指标之一,是直肠癌局部复发最重要的预后因素。在Ferko等[20]的一项研究中,对198例中低位直肠癌手术的患者进行分析,发现耻骨-骶骨角对TME标本的完整性有显著影响;他们认为,耻骨-骶骨角角度越尖锐,操作越困难,TME标本质量越差。此外,Zur Hausen等[21]确定,入口前后径较短会增加TME标本损坏的可能性;而坐骨棘间距越短,TME标本质量下降风险越高,较短的坐骨棘间距可能是手术质量差的独立危险因素。环周切缘状态也是评价手术质量的重要参数之一。然而对于骨盆参数预测环周切缘状态的可用性仍然存在争议。Gojayev等[22]研究结果表明,骨盆解剖参数对环周切缘受累的影响并不显著。而距离肛门边缘的肿瘤高度、肿瘤大小和性别是环周切缘受累的重要危险因素。但最近一项国际化、多中心、优越性的随机对照试验中发现,对于中低位直肠癌,TaTME的环周切缘优于腹腔镜TME的环周切缘,对于那些术前评估经腹部手术可能导致较差的环周切缘,患者可选择TaTME[38]。Killeen等[17]的研究也表明,除了手术类型(直肠前切术与腹会阴联合切除术)之外,没有其他因素与环周切缘状态相关。也就是说,环周切缘状态与任何骨盆测量值、角度或衍生测量值均无关联。
4.4 直肠系膜脂肪面积与手术难度
先前对骨盆发育不良的研究主要集中在骨结构本身,而直肠癌手术中骨盆的可操作间隙也受到骨盆脂肪组织的影响。因此,在直肠癌手术中,所有手术空间有限的骨盆都是一个手术困难的骨盆。一般来说,肥胖会缩小腹部的相对空间,使手术更加困难,一些研究已经证实体重指数对直肠手术有负面影响[15-16,39]。然而,Chen等[40]通过多元回归分析发现,直肠系膜脂肪面积比例越大,直肠系膜完全切除的可能性就越低,而体重指数对直肠手术结果的影响并不显著。在肥胖患者中,直肠系膜脂肪面积似乎比体重指数更能预测手术质量和腹腔镜直肠手术的难度。同样,Levic等[41]发现,尽管体重指数为30 kg/m2的患者术中失血量增加,体重指数并非接受腹腔镜直肠癌手术患者不良预后的显著预测指标。这可能是由于内脏脂肪区域的分布在不同的患者中存在差异。体重指数反映了整体的肥胖程度,而腹部,特别是直肠周围的脂肪含量,对手术的难度有重大影响。因此,直肠系膜脂肪面积可能是反映手术难度的较好指标。此外,骨盆测量均是在二维图像截面上测量,无法完全呈现骨盆及直肠周围软组织形状,测量存在偏差。如借助3D图像重建技术,便可以在任何轴向测量骨盆参数,从而更准确地评估直肠手术的难度。
综上所述,骨盆的影像学测量已经被证实可以预测直肠癌手术难度,当骨盆入口前后径越短、中骨盆前后径越短、骨盆出口前后径越短、耻骨上下径越短、骶尾径越长、骶尾曲度深度越深、耻骨-骶骨角越小、骶尾-耻骨角越小、坐骨棘间距越短、坐骨结节间径越短,直肠系膜面积越大时,直肠癌手术难度就越高。
5 小结与展望
直肠癌是一种严重危害人类健康的疾病,手术仍是其主要的治疗方法。随着手术和影像学技术的发展,许多骨盆影像学测量参数已经被用来预测TME的手术难度,包括骨盆尺寸和骨盆角度。但哪些骨盆参数对手术难度的影响最大仍然存在较大争议,这可能是由于目前对于困难骨盆定义尚不明确,国内外研究各持不同观点,且存在病例少、手术难度评价指标不一等问题。此外,骨盆的解剖参数较多,直肠癌的手术方法也较多,直肠癌手术难度的预测可能需要综合的方法,如3D图像重建、诺模图、机器学习和人工智能来解决。外科医生结合术前检查结果评估手术难度,对于术前诊断为困难骨盆的患者可以选择合适的手术方式,如腹腔镜TME、机器人手术或TaTME,甚至转诊给更专业、经验丰富的外科医生。因此,通过骨盆影像学测量参数预测直肠手术难度,有很大的探索空间。