亚精胺通过抑制细胞凋亡、ROS 生成及铁死亡减轻脂多糖诱导的小鼠心肌损伤
2024-01-29张晓红蒯建科
张晓红,赵 品,蒯建科,常 超,袁 庆
1 西北大学生命科学学院,陕西 西安 710069;2 西北大学附属医院//西安市第三医院麻醉科,陕西 西安 710018;3西北大学生命科学与医学部,陕西 西安710069
脓毒症是由各种感染引起,导致机体反应失调,继而诱发的多器官功能障碍和全身炎症反应综合征[1,2]。脓毒症时心肌损伤较明显,脓毒性休克患者普遍存在心肌功能障碍,可直接导致脓毒症较高的死亡率[3],目前仍无有效的治疗手段。因此,研究脓毒症导致心肌损伤的机制,探索新的治疗方法显得尤为重要。既往的研究显示:脓毒症导致的心肌功能障碍与炎症反应[4]、细胞凋亡[5]、氧化应激[6]及铁死亡密切相关[7]。
铁死亡是一种铁依赖性细胞死亡,与谷胱甘肽代谢受损、脂质过氧化物代谢障碍和线粒体凋亡相关[8]。越来越多的证据表明:铁死亡参与了脓毒症诱发的多器官损伤[9],并且,相关研究中发现:抑制铁死亡可显著缓解脓毒症心肌损伤[10]、肺损伤[11]、肝损伤和肾损伤[12]。
亚精胺(SPD)是一种天然多胺,存在于各种日常膳食中,对内环境稳态的维持具有重要作用[13],且参与了各种病理生理状态的细胞活动,具有抗炎、抗氧化应激、抗凋亡和自噬调节特性[14];相关研究中发现:通过食物中补充的亚精胺可较好的被肠道吸收,并且在血液及相关组织中可检测到其表达水平增加[15],由于其极低的细胞毒性和细胞保护作用,亚精胺作为膳食补充剂的用途受到了越来越多的关注[16],文献研究中发现:亚精胺可调节线粒体功能、减少细胞凋亡,对心肌损伤有较好的保护作用[17]。但亚精胺能否可以改善脂多糖(LPS)诱导脓毒症性心肌损伤目前还不清楚。本研究通过在体内和体外建立脓毒症心肌损伤模型,探究亚精胺在脓毒症心肌损伤中的作用及其机制,为治疗脓毒症心肌损伤提供理论指导。
1 材料和方法
1.1 材料与试剂
脂多糖(LPS)、亚精胺(SPD,Sigma);DMEM培养基、胎牛血清、青霉素-链霉素(Cellmax);CCK-8细胞活力检测试剂盒、乳酸脱氢酶(LDH)试剂盒、DCFH-DA活性氧(ROS)荧光探针、蛋白提取试剂盒(碧云天生物技术有限公司);兔抗Bax(Abcam);兔抗Bcl-2、SLC7A11、GPX4抗体(上海爱博泰克有限公司);兔抗Cleaved-caspase3(万类生物科技有限公司);鼠抗GAPDH、山羊抗鼠和山羊抗兔二抗(Immunoway)。
1.2 动物分组及处理
C57BL/6雄性小鼠18只,6~8周龄,购买自江苏集萃姚康生物科技股份有限公司,许可证号SCXK(苏)2018-0008。所有小鼠在动物实验中心,采用标准饲喂环境[20~25 ℃,(50±5)%相对湿度,12 h昼夜循环光照]饲养,适应性喂养2周后,将小鼠随机分为3组:对照组(Control)、模型组(LPS)、亚精胺干预组(LPS+SPD)。对照组注射等量生理盐水,模型组腹腔注射LPS 10 mg/kg建立脓毒症心肌损伤模型,亚精胺干预组于LPS注射前两周,每天给予SPD(5 mmol/L)灌胃处理,在这期间Control组及LPS组给予等量生理盐水。在LPS注射12 h后,处死所有小鼠。本研究动物实验方案均经西北大学动物护理伦理委员会批准(NWU-AWC-20200602)。
1.3 心肌组织HE染色观察心肌形态
采用腹腔注射戊巴比妥钠(40 mg/kg)麻醉小鼠,取出心脏组织,在10%多聚甲醛中固定24 h,石蜡包埋。然后将包埋的组织切成3~5 μm的切片,用二甲苯脱蜡2次,5 min/次,并用乙醇水合。切片在室温下用苏木精染色5 min,用伊红溶液染色3 min,然后用分级醇脱水并在二甲苯中澄清。最后,用中性树脂密封风干切片,在光学显微镜下观察心肌组织形态。
1.4 透射电子显微镜观察心肌线粒体
另一半心肌组织用3%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水后,经过渗透和包埋(Epon812包埋),用钻石刀作超薄切片,将包埋组织切成约60~90 nm后,用醋酸铀和枸橼酸铅在室温下染色,在JEM-1400FLASH透射电镜下观察心肌细胞及线粒体变化。
1.5 细胞培养及处理
H9c2大鼠心肌细胞购自普诺赛生命科技有限公司(武汉)。H9c2细胞在含有10%胎牛血清(FBS)和1%青霉素链霉素双抗的完全培养基(DMEM)中培养。对照组不做处理,模型组将LPS(10 μg/mL)加入细胞培养基中以诱导脓毒症心肌损伤模型,对于亚精胺处理组,我们选用10 μmol/L(SPD10)和20 μmol/L(SPD20)的浓度作为预处理,在LPS刺激之前用亚精胺(SPD)预处理H9c2细胞2 h,每个实验至少重复3次。
1.6 细胞活力检测
将H9c2细胞接种于96孔板中培养过夜,药物处理24 h后,采用CCK-8试剂盒检测各组心肌细胞活力。在每个孔中加入10 μL CCK-8工作液,继续培养2 h后使用酶标仪测量并计算细胞活力。
1.7 细胞cTNI及LDH水平检测
将细胞接种于24孔板中培养过夜,药物处理24 h后,采用ELISA检测心肌肌钙蛋白I(cTNI)水平,采用乳酸脱氢酶试剂盒检测心肌细胞LDH水平。实验步骤参照各试剂盒说明书进行,加入相关检测工作液,最后使用酶标仪测定cTNI及LDH水平。
1.8 细胞活性氧(ROS)检测
将细胞接种于24孔板中培养过夜,药物处理24 h后,用无血清培养基清洗细胞,加入10 μmol DCFH-DA荧光探针工作液,在培养箱中孵育30 min,洗涤2次,用荧光显微镜观察并分析,其中绿色荧光强度变化代表心肌细胞内ROS的水平。
1.9 细胞Fe2+检测
采用FerroOrange橙色荧光探针,检测细胞内二价铁离子(Fe2+)变化。将细胞接种在35 mm培养皿中,各组加入药物处理24 h后,用无血清培养基清洗细胞,加入1 μmol/L FerroOrange工作溶液后,继续培养30 min后然后在倒置荧光显微镜下观察,用Image J 软件对Fe2+荧光强度进行定量。
1.10 线粒体膜电位检测
采用JC-1检测细胞线粒体膜电位水平,将细胞接种在35 mm培养皿中,各组加入药物处理24 h后,用无血清培养基清洗细胞,加入JC-1检测工作液,37 ℃下孵育30 min,洗涤细胞2次,最后在荧光显微镜观察并分析察细胞。其中红色荧光强度代表线粒体膜电位正常,绿色荧光强度代表线粒体膜电位下降。
1.11 Western blot测定相关蛋白表达
在药物处理完成后,收集细胞,采用RIPA裂解液进行裂解提取蛋白,蛋白浓度用BCA法测定,在10%的SDS-PAG凝胶中电泳,转至PVDF膜上,5%牛奶中封闭膜2 h,然后分别与Bax(ab32503,1∶3000)、Bcl-2(A0208,1∶500)、Cleaved-caspase3(WL02117,1∶500)、GPX4(A1933,1∶500)、SLC7A11(A2413,1∶500)、GAPDH(YM3029,1∶8000)抗体4 ℃孵育过夜,洗膜3次后,二抗室温孵育1 h。二抗山羊抗鼠(RS0001)和山羊抗兔抗体(RS0002)稀释度均为1∶10 000,继续洗膜3次后,用高敏ECL化学发光试剂盒1∶1配制显影液,曝光后获取图像并使用Image J软件分析。
1.12 统计学分析
采用Image J 软件对Western blot条带灰度分析和荧光定量分析,应用Excel 录入数据,采用GraphPad Prism 8统计软件统计图表,多组采用单因素方差分析进行组间比较,两组采用t检验进行两两比较并校正Ρ值。数据用均数±标准差表示,Ρ<0.05时认为差异有统计学意义。
2 结果
2.1 亚精胺减轻脓毒症小鼠心肌损伤
心肌组织HE染色结果(图1A)显示:与空白对照组比,LPS组小鼠心肌组织结构紊乱,间隙变大,肌纤维断裂,炎性细胞浸润,亚精胺处理组小鼠心肌组织结构较LPS组整齐,间隙减小,心肌纤维有所恢复,炎性细胞浸润减少。
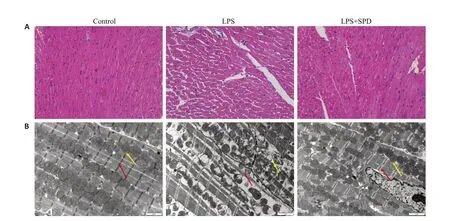
图1 各组小鼠心肌组织HE染色及透射电镜代表图Fig.1 Representative images of HE staining and transmission electron microscopy (TEM) of myocardial tissues of the mice in each group.A: HE staining of the myocardial tissues in the 3 groups (Original magnification: ×200).B:Observation of mitochondrial morphological changes in the myocardial tissues using TEM (×8000).Red arrows indicate myocardial sarcomeres and yellow arrows indicate the mitochondria).LPS: Lipopolysaccharide;SPD:Spermidine.
心肌组织透射电镜超微结构(图1B)显示:与空白对照组比,LPS组小鼠心肌肌节紊乱(红色箭头),线粒体肿胀、出现空泡化,嵴密度增大、外膜部分溶解和消失(黄色箭头),亚精胺处理组小鼠心肌肌节较LPS组整齐,减轻了LPS组所致的线粒体肿胀、空泡化程度。
2.2 亚精胺增强脓毒症心肌细胞活性
本研究前期预实验结果发现:10 μmol/L和20 μmol/L的亚精胺可较好的对H9c2细胞发挥保护作用,因此,实验中选用这2个浓度的亚精胺来探究其作用及机制。与空白对照组相比,LPS组细胞活力降低(Ρ<0.05),亚精胺处理组,与LPS组相比可提高细胞活力,且随浓度的增加而增加(Ρ<0.05,图2A);细胞形态结果显示:与空白对照组相比,LPS组细胞数量明显减少,悬浮的死细胞数量增加,亚精胺处理组细胞数量较LPS组增加,悬浮的死细胞数量减少(图2B)。

图2 亚精胺对脓毒症心肌细胞活力及形态的影响Fig.2 Effect of spermidine on viability and morphology of LPS-induced myocardial cells.A: CCK-8 kit analysis.B:Changes in cell morphology(×100).*P<0.05 vs control Group;#P<0.05 vs LPS group.
2.3 亚精胺下调脓毒症心肌细胞凋亡相关蛋白的表达
Bax,Bcl-2作为凋亡蛋白标记物,且Bax/Bcl-2表达的上调,表示凋亡水平增加,Cleaved-caspase3 存在于正在发生凋亡的细胞中,亦反应凋亡水平。与空白对照组相比,LPS组Bax、Cleaved-caspase3蛋白表达水平增加(Ρ<0.05,图3B、D),Bcl-2蛋白表达水平降低;亚精胺处理可降低LPS引起的Bax、Cleaved-caspase3蛋白水平增加,并增加Bcl-2蛋白水平(Ρ<0.05,图3)。
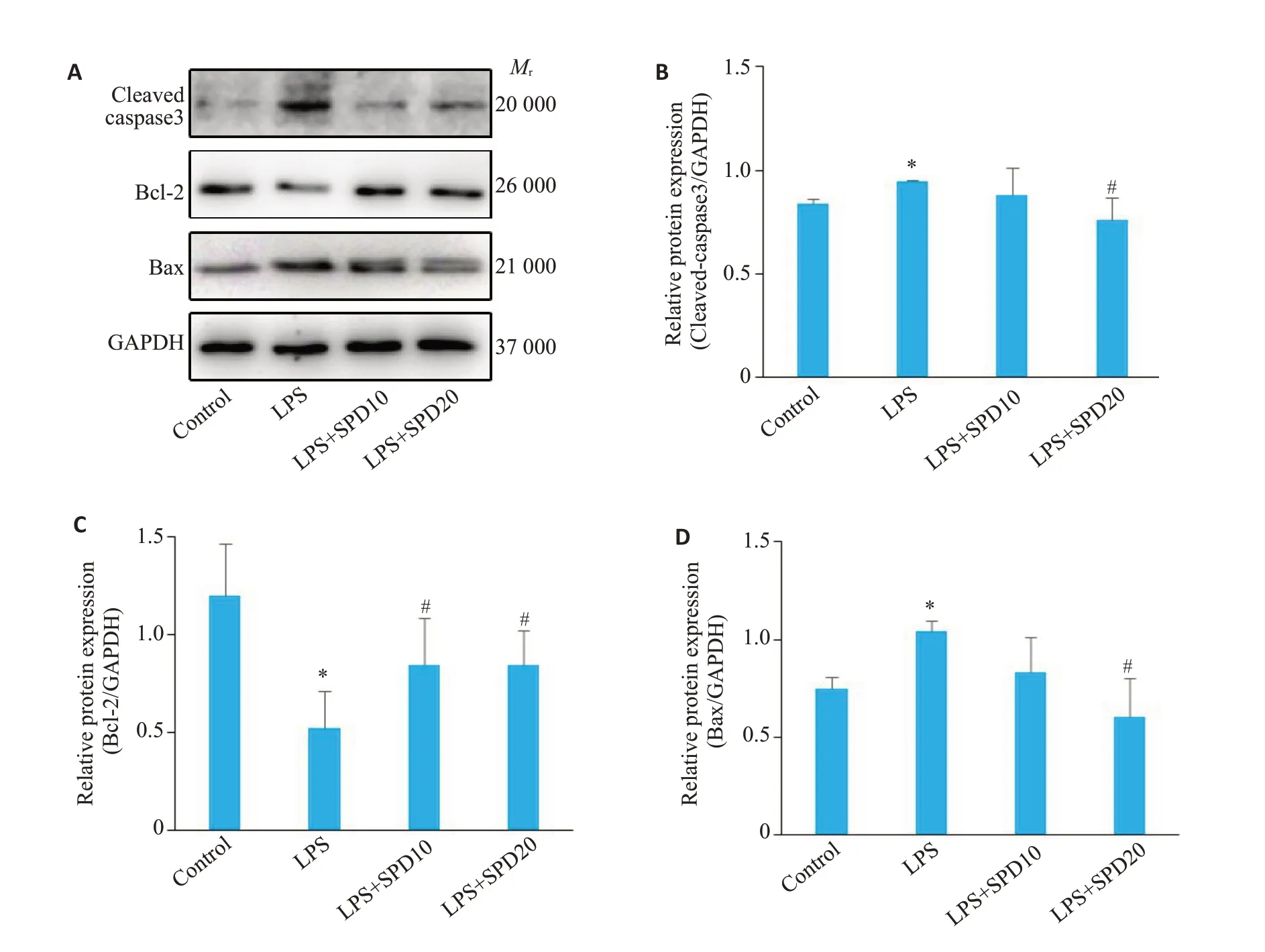
图3 亚精胺对脓毒症心肌细胞凋亡蛋白表达的影响Fig.3 Effect of spermidine on expressions of apoptotic proteins in LPS-induced cardiomyocytes.A:Western blotting of Bax,Bcl-2,and cleaved caspase-3 in myocardial cells.B-D: Quantification of the protein expressions.*P<0.05 vs control group;#P<0.05 vs LPS group.
2.4 亚精胺减轻脓毒症心肌细胞损伤和氧化应激
与空白对照组相比,LPS组心肌细胞乳酸脱氢酶(LDH)水平和心肌肌钙蛋白I(cTNI)水平升高(Ρ<0.05),亚精胺处理可明显降低LPS引起的LDH和cTNI升高水平(Ρ<0.05,图4A、B);细胞活性氧ROS荧光探针结果显示:LPS 组的绿色荧光显著增强,ROS 水平增加(Ρ<0.05),SPD干预组ROS水平降低(Ρ<0.05,图4C)。JC-1染色结果显示:LPS组绿色荧光增强,线粒体膜电位下降或消失(图4D),SPD干预组的绿色荧光强度降低,线粒体膜电位升高。
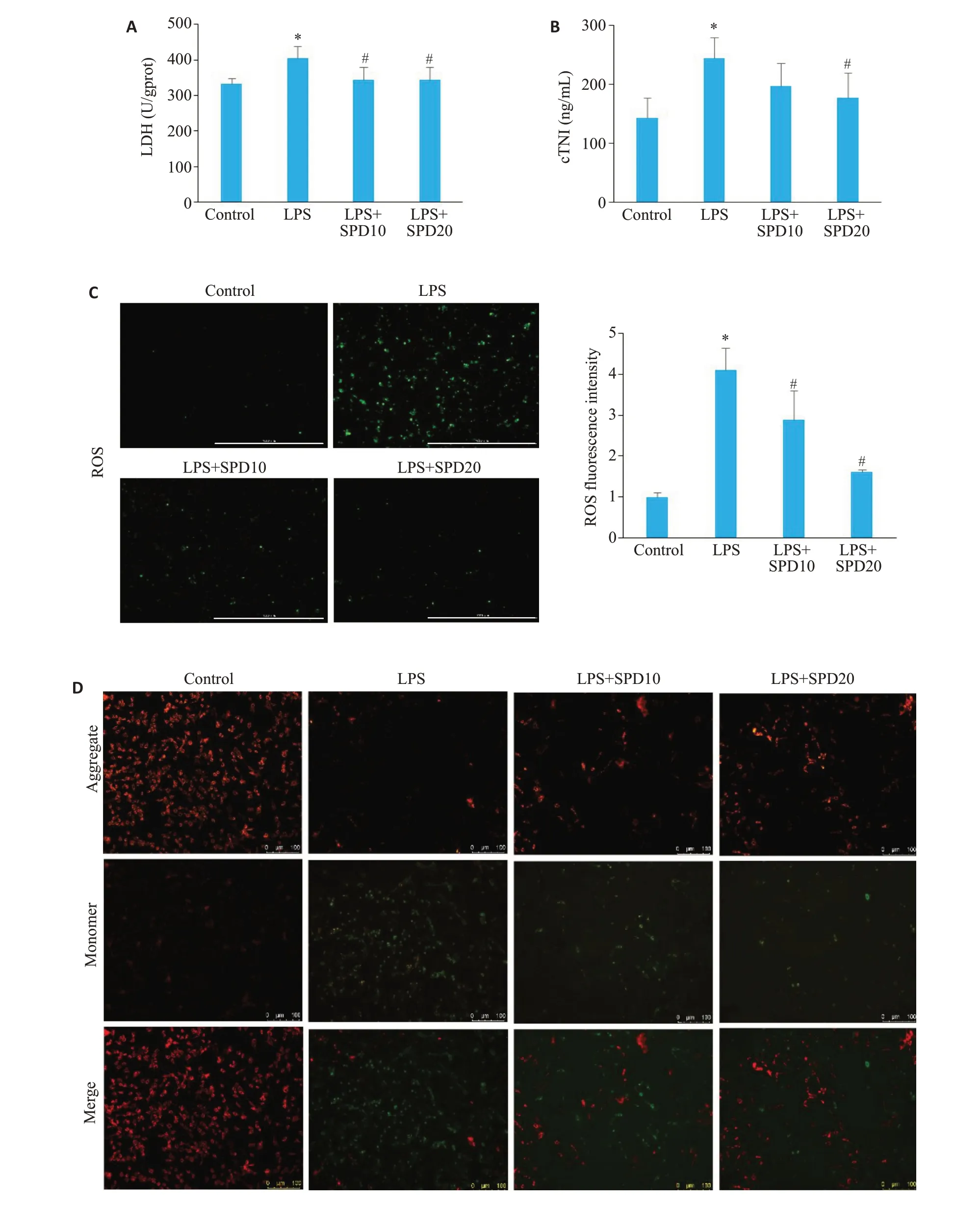
图4 亚精胺对脓毒症心肌细胞LDH、cTNI、ROS及线粒体膜电位表达的影响Fig.4 Effect of spermidine on expressions of LDH,cTNI,ROS and mitochondrial membrane potential in LPSinduced cardiomyocytes.A: Changes in LDH level.B: Changes of cTNI expression.C: Detection of ROS production in the cells using DCFH-DA fluorescence probe (Scale bar=1000 μm).D: JC-1 detection of mitochondrial membrane potential(×100).*P<0.05 vs control group;#P<0.05 vs LPS group.
2.5 亚精胺减轻脓毒症心肌细胞铁死亡
FerroOrange橙色荧光探针结果显示:与空白对照组相比,LPS组细胞内Fe2+水平明显增加(Ρ<0.05),亚精胺处理可显著降低LPS引起的Fe2+的水平增加(Ρ<0.05,图5A);Western bolt结果显示:与空白对照组相比,LPS组铁死亡相关蛋白SLC7A11、GPX4的表达水平明显降低(Ρ<0.05),亚精胺处理可明显提高SLC7A11、GPX4蛋白的表达水平(Ρ<0.05,图5B)。

图5 亚精胺对脓毒症心肌细胞铁死亡的影响Fig.5 Effect of spermidine on ferroptosis of LPS-induced myocardial cells.A:Detection of intracellular changes in divalent iron ions using FerroOrange probe(×250).B:Changes in iron regulatory protein expression.*P<0.05 vs control group;#P<0.05 vs LPS group.
3 讨论
脓毒症伴有严重心功能障碍时患者病死率升高至70%[18],目前仍缺乏特效治疗手段,深入研究脓毒症心功能障碍的机制和探索新的治疗方案显得尤为重要。而脓毒症心肌损伤发病机制复杂而多样,通常包含炎症,凋亡,氧化应激,铁死亡等[19]。亚精胺作为多胺成员之一[20],可维持DNA基因稳态,调节基因转录和翻译,调节自噬、凋亡、氧化应激,在细胞分裂和增殖中有着不可或缺的作用[21]。相关研究发现:饮食中亚精胺的摄入与心血管疾病(CVD)的发病率和死亡率呈负相关[22]。
本研究首先观察了在脓毒症小鼠中亚精胺对心肌组织形态病理状态。研究发现给予小鼠亚精胺预处理后,改善了LPS所致心肌组织结构紊乱,线粒体损伤,说明亚精胺可以作为相关治疗手段来缓解脓毒症心肌损伤。然后我们在心肌细胞中进一步研究亚精胺对脓毒症心肌损伤的作用。采用LPS处理H9c2心肌细胞构建脓毒症心肌损伤的体外模型,同时给予亚精胺预处理,观察亚精胺对H9c2心肌细胞的作用。研究结果发现:LPS处理后H9c2心肌细胞活力降低、凋亡蛋白表达增加,亚精胺预处理可以提高细胞存活率,降低凋亡蛋白的表达。LDH及cTNI是心肌损伤标志物,可反应心肌损伤或死亡高度敏感性和特异性程度[23]。而亚精胺可降低细胞中LDH及cTNI的释放量,减轻细胞损伤。既往的研究中报道:亚精胺在多种模型中可抑制活性氧(ROS)的产生,起到内源性ROS清除剂的作用[24-26]。所以我们继续观察亚精胺对脓毒症氧化应激的影响,研究结果显示:亚精胺可以降低LPS引起的ROS水平升高,恢复其线粒体膜电位的下降,以上结果可能是亚精胺通过抗氧化作用以及其他多个环节,降低ROS的产生,从而抑制细胞发生凋亡,减轻脓毒症心肌损伤。
铁死亡在各种心脏病引起的心肌损伤中都有参与[27]。铁死亡抑制剂能有效改善各种心脏病引起的心脏损伤,并且研究表明,铁死亡是脓毒症诱发的心脏损伤的主要致病机制之一,抑制LPS诱导的心肌铁死亡可缓解心肌损伤[28]。而有大量研究表明,铁死亡主要发生在体内代谢紊乱和氧化应激等条件下,主要表现铁依赖性积累,铁的积累会诱发铁死亡并导致心肌组织的损伤和功能障碍[29]。细胞内铁离子的过量产生,会通过芬顿反应在细胞内各种脂质膜上产生活性氧(ROS)而导致细胞死亡[30]。亚精胺具有抗氧化特性,外源性亚精胺的补充可以抑制小鼠发生氧化应激[31],但亚精胺是否通过抗氧化应激来减少铁死亡的发生,还尚未有报道。本研究表明,LPS刺激后,细胞内Fe2+及活性氧的增加、线粒体膜电位降低,GPX4和SLC7A11蛋白表达水平显着降低,表明在脓毒症心肌损伤中,氧化应激、脂质过氧化及铁死亡的发生。而亚精胺处理可降低Fe2+水平和活性氧ROS的产生,恢复LPS引起的线粒体膜电位下降,增加铁死亡调控蛋白GPX4 和SLC7A11 蛋白表达水平。这些数据表明,亚精胺抑制了LPS诱导脓毒症心肌细胞铁死亡。
综上所述,亚精胺作为一种天然产物,发挥其抗凋亡,抗氧化应激等特性,减轻脓毒症心肌损伤及抑制脓毒症心肌铁死亡的发生,并且可能通过多种作用机制来发挥对脓毒症心肌损伤的保护作用。但其具体的作用机制还需要更深入的研究。