构建犬声带瘢痕模型及初步筛选声带瘢痕形成相关靶基因*
2024-01-29黄玉刘豆黄文霞梁耕田
黄玉 刘豆 黄文霞 梁耕田
声带瘢痕(vocal fold scar)是由于炎症、外伤等各种原因引起喉腔损伤,使声带固有层细胞外基质(extracellular matrix,ECM)中胶原纤维、弹性纤维和纤维连接蛋白形态和含量发生改变,成纤维细胞增殖活跃,进而导致肉芽组织过度增生并逐渐纤维化的结果[1,2]。ECM的合成和降解与组织纤维化密切相关,其合成主要依赖于转化生长因子-β(transforming growth factor-β,TGF-β)信号通路调节,降解则依赖于基质金属蛋白酶(matrix metalloproteinase,MMPs)。与此相符,在声带损伤的瘢痕修复过程中,TGF-β1、Smmad7高表达[3,4]。Lim等[5]在大鼠声带瘢痕模型研究中发现,IL-1、NF-κB、TNF-α等也高表达。而本科研团队前期通过CO2激光烧灼术成功构建了犬声带瘢痕模型,发现:赖氨酰胺氧化酶(lysyl oxidase,LOX)、基质金属蛋白酶-1(matrix metalloproteinase-1,MMP1)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、热休克蛋白(heat shock proteins,HSP70)、透明质酸(hyaluronic acid,HA)等因子在声带瘢痕形成过程的不同时期表现出不同的表达水平,推测以上因子与声带创伤修复及瘢痕形成相关[6,7]。与声带瘢痕形成相关的基因众多且较为分散,不能较全面地汇总出重点相关的基因家族。本研究通过等离子射频消融术构建犬声带瘢痕模型,并采用高通量测序技术对正常声带和瘢痕化声带进行转录组基因检测分析,筛选出与声带瘢痕形成密切相关的靶基因及所富集的信号通路,为探索声带瘢痕发生机制提供进一步参考。
1 材料与方法
1.1实验动物 由三峡大学提供健康中华田园犬4只,均为1岁龄雄性犬,体重均为10 kg左右,全部通过湖北省疾病预防控制中心质量检测,具备科学研究条件。研究期间所有犬在同等环境条件下饲养于武汉大学附属同仁医院(武汉市第三医院)实验中心犬饲养间,所有操作均通过动物伦理委员会审批(武三医实伦SY2022-009)。
1.2实验试剂及仪器 内窥镜摄像系统(KARL STORZ)、医用内窥镜冷光源(KARL STORZ)、等离子动力系统(KARL STORZ)、0°内镜镜头(KARL STORZ)、支撑喉镜、负压吸引器、光学显微镜(Olympus)、超薄切片机(Leica)、钻石切片刀(Daitome)、透射电子显微镜(HITACHI)、苏木素染液(Servicebio)、伊红染液(Servicebio)、环保型脱蜡透明液(Servicebio)、电镜固定液(Servicebio)、4%多聚甲醛固定液(Biosharp)、环氧树脂812包埋剂(Servicebio)、RNA提取试剂盒(Omega)、PCR扩增试剂盒(Servicebio)。
1.3构建犬声带瘢痕模型 将4只中华田园犬禁食、禁水8 h,采用速眠新II 0.05 ml/kg+5%戊巴比妥钠0.25 ml/kg右后上肢肌肉注射麻醉,在支撑喉镜内镜辅助下充分暴露双侧声带,等离子刀(切割功率7档,电凝功率3档)逐层消融左侧声带中上1/2段,直至肌层,面积约7 mm2,右侧声带作为自身对照侧不予任何处理,苏醒4 h后予以少许软食,次日起恢复正常饮食。所有犬同等条件下饲养。
1.4声带大体形态观察 在参考本团队前期成功造模的基础上[6],将本研究观察时间点选为术前、术后即刻、术后3周和术后12周。将所有犬进行肌肉注射麻醉(方法同1.3),于支撑喉镜内镜辅助下充分暴露双侧声带,观察形态学特征及变化。
1.5组织取材 术后12周,将所有犬予以安乐死,将喉完整离体分离,充分暴露双侧声带,于术侧声带取多个典型标本,部分放入4%多聚甲醛固定液和电镜固定液(主要成分为2.5%戊二醛)中固定,部分放入EP管中于-80℃新鲜冻存,同法处理对照侧声带组织。所有样本大小相当、重量相仿。
1.6HE染色观察声带病理结构 将多聚甲醛固定后的声带组织进行石蜡包埋,垂直于声门区方向进行横切制片,厚度为4 μm,然后依次经过脱蜡透明液(2次,每次20 min)、梯度酒精、PBS(5 min)脱蜡水化,后滴加苏木素染色4 min,盐酸酒精分化3 s、氨水返蓝4 s后滴加伊红染色2 min,最后将切片经过梯度酒精和脱蜡透明液(2次,每次10 min)进行脱水透明,中性树胶封片后,于光学显微镜下观察双侧声带组织结构及变化。
1.7电镜下观察声带超微结构 将取出的犬声带组织按顺序进行多次固定(电镜固定液室温避光固定2 h→电镜固定液4℃继续固定2 d→0.1 M磷酸缓冲液漂洗后于1%锇酸室温避光后固定2 h),0.1 M磷酸缓冲液漂洗后经梯度酒精和丙酮(2次,每次15 min)脱水,然后丙酮∶环氧树脂1∶2于37℃渗透包埋过夜,后于60℃聚合48 h制备树脂块。垂直于声门区方向进行横切超薄制片,厚度为60 nm,150目方华膜铜网捞片,2%醋酸铀酒精染色8 min,70%酒精和双蒸水各清洗3次,2.6%枸橼酸铅染色8 min后双蒸水清洗、风干,于透射电镜下观察双侧声带超微组织结构及变化。
1.8两组犬声带高通量转录组基因测序 按照RNA提取试剂盒说明书提取正常声带和瘢痕声带组织总RNA,琼脂糖凝胶电泳检测完整性,Nanodrop和Qubit分别对提取的RNA进行纯度检测和总量测定。利用Oligo(dT)富集mRNA,并将其打断成200 bp左右的片段,以其为模板合成双链cDNA,经过End Repair Mix进行末端补平和末端加A后,连接测序接头并进行cDNA消化,留取单链cDNA后进行15个循环的PCR扩增,得到cDNA库后采用illumina Novaseq6000双端测序模式进行高通量测序。两组声带测序后进行转录组基因差异性统计学分析。
声带组织中提取总RNA经琼脂凝胶电泳检测示28S:18S≥1.5,Nanodrop检测RNA纯度示OD260/280比值均在1.8~2.2范围内,Qubit精确定量RNA总量≥500 ng。利用DESeq2软件对正常声带组和瘢痕声带组的基因表达情况进行差异性统计学分析,为提高结果准确性和排除个体差异性,于正常声带组4只犬中留取的大小相当、重量相仿的典型标本中随机选取3个样本,将测得的基因表达量取平均值记为对照组G1,同法于瘢痕声带组典型标本中随机选取3个样本,将测得的基因表达量取平均值记为实验组G2,以log2FC值为横坐标,log10(PValue)值为纵坐标绘制火山图,满足|log2FC|≥1且P≤0.05表明基因表达有明显统计学差异(其中log2FC≥1的点表示实验组G2相对于对照组G1表达显著上调的基因,≤-1的点表示实验组G2相对于对照组G1表达显著下调的基因,P≤0.05提示基因表达存在显著差异性)。
2 结果
2.1不同时期声带大体形态 术前犬双侧声带均呈白色条带状、边缘光滑整齐,活动对称,闭合良好(图1a)。左侧声带等离子消融术后,术侧声带组织损伤暴露至肌层,失去原有形态特征,对侧声带与术前无明显差异(图1b);术后3周,术侧声带创面已处于修复状态,但边缘不规则,组织仍有充血肿胀,可见红色肉芽组织形成,对侧声带与术前无明显差异(图1c);术后12周,术侧声带创面已修复完成,未见充血肿胀及肉芽组织,但局部挛缩凹陷、边缘不整齐,瘢痕形成,对侧声带与术前无明显差异(图1d)。
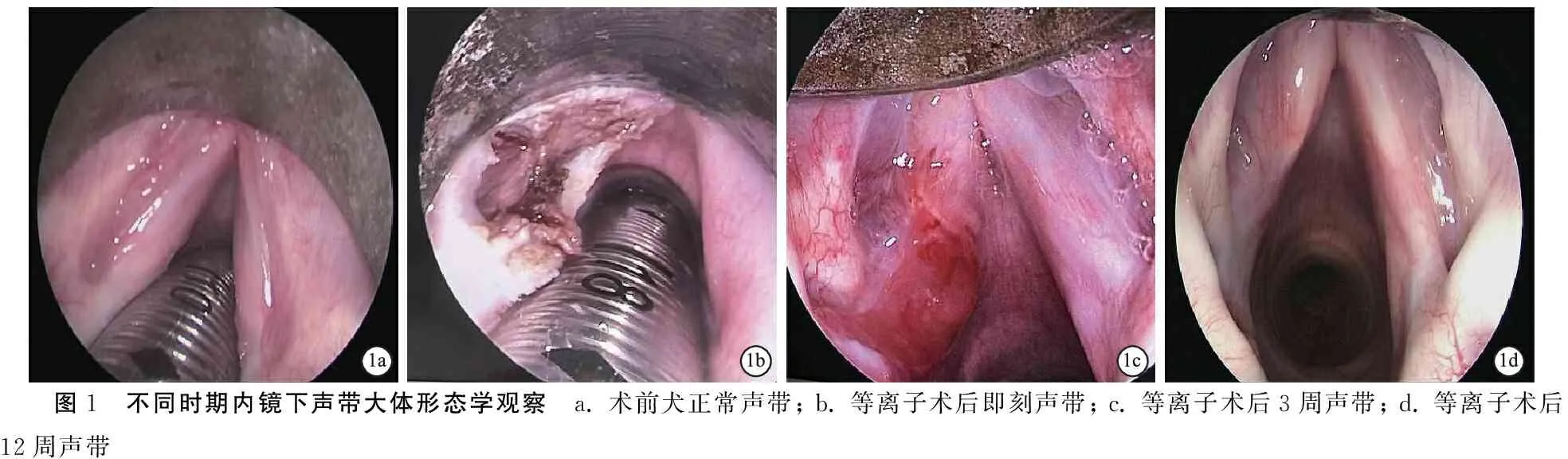
图1 不同时期内镜下声带大体形态学观察 a. 术前犬正常声带; b. 等离子术后即刻声带; c. 等离子术后3周声带; d. 等离子术后12周声带
2.2HE染色观察 正常声带组织结构完整、层次分明,外层为复层鳞状上皮层,紧接着可见疏松的结缔组织层以及排列有序、走向一致的纤维层和肌层(图2a)。术侧声带鳞状上皮层明显增厚,并可见多量散在纤维束,原有疏松结缔组织层纤维化,原有纤维层增厚、排列紊乱、走向不一,局部成团状或束状聚集(图2b);间质增厚、密度不均(图2c);总体层次混乱,肌层亦可见散在紊乱的纤维束(图2d)。
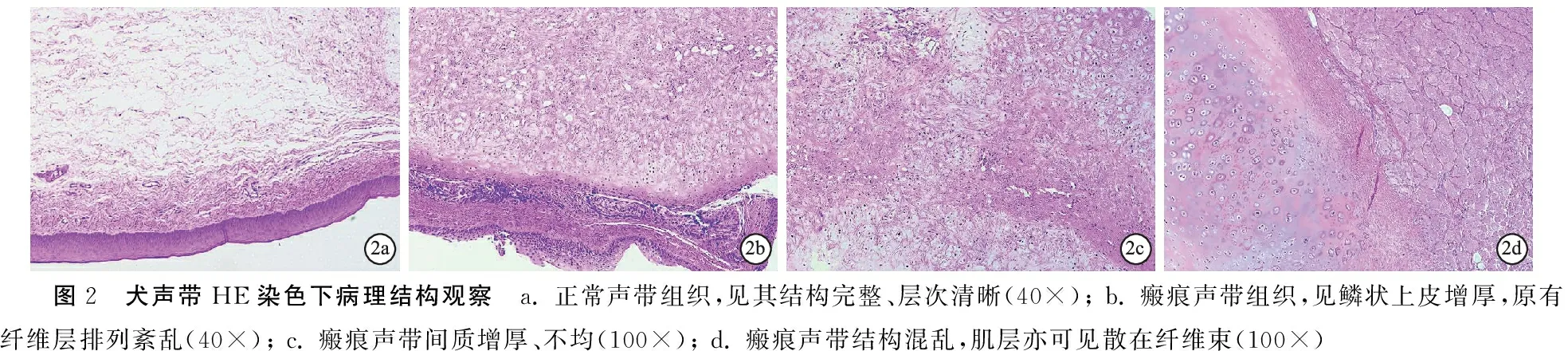
图2 犬声带HE染色下病理结构观察 a. 正常声带组织,见其结构完整、层次清晰(40×); b. 瘢痕声带组织,见鳞状上皮增厚,原有纤维层排列紊乱(40×); c. 瘢痕声带间质增厚、不均(100×); d. 瘢痕声带结构混乱,肌层亦可见散在纤维束(100×)
2.3超微结构观察 正常声带组织层次分明,复层鳞状上皮层细胞多层有序排列,细胞未见肿胀,相对静止(图3a);结缔组织层致密,间质密度较均,纤维层呈波浪形有序排列、走向一致(图3b)。术侧声带组织鳞状上皮增厚,细胞呈肿胀状态,细胞间亦可见散在纤维,纤维层排列紊乱(图3c);间质增厚、密度不均,细胞肿胀,细胞间界线不清,细胞核增生、线粒体增多,细胞较为活跃(图3d)。
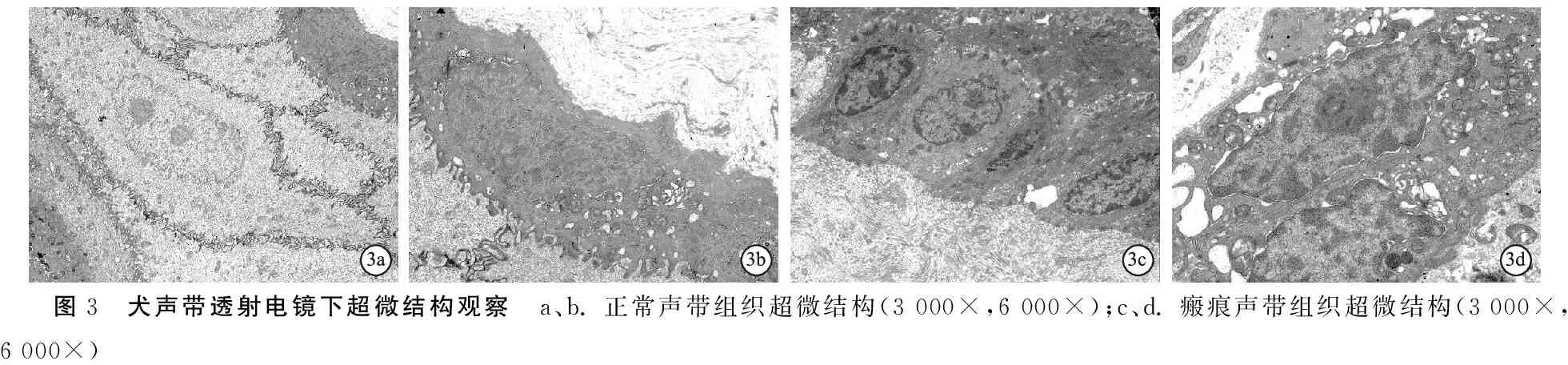
图3 犬声带透射电镜下超微结构观察 a、b. 正常声带组织超微结构(3 000×,6 000×);c、d. 瘢痕声带组织超微结构(3 000×,6 000×)
2.4高通量测序转录组基因分析 两组基因表达差异的火山图见图4,可见,两组声带组织基因表达总体存在较大差异性,实验组较对照组基因表达呈现显著上调、显著下调和无显著差异三种趋势,其中表达显著上调居多(图4)。再以基因在对照组G1中的表达量为横坐标,在实验组G2中的表达量为纵坐标绘制散点图(图5),显著差异基因表达筛选条件同火山图,同样表现为实验组较对照组基因表达呈现显著上调居多,趋势同火山图所示。
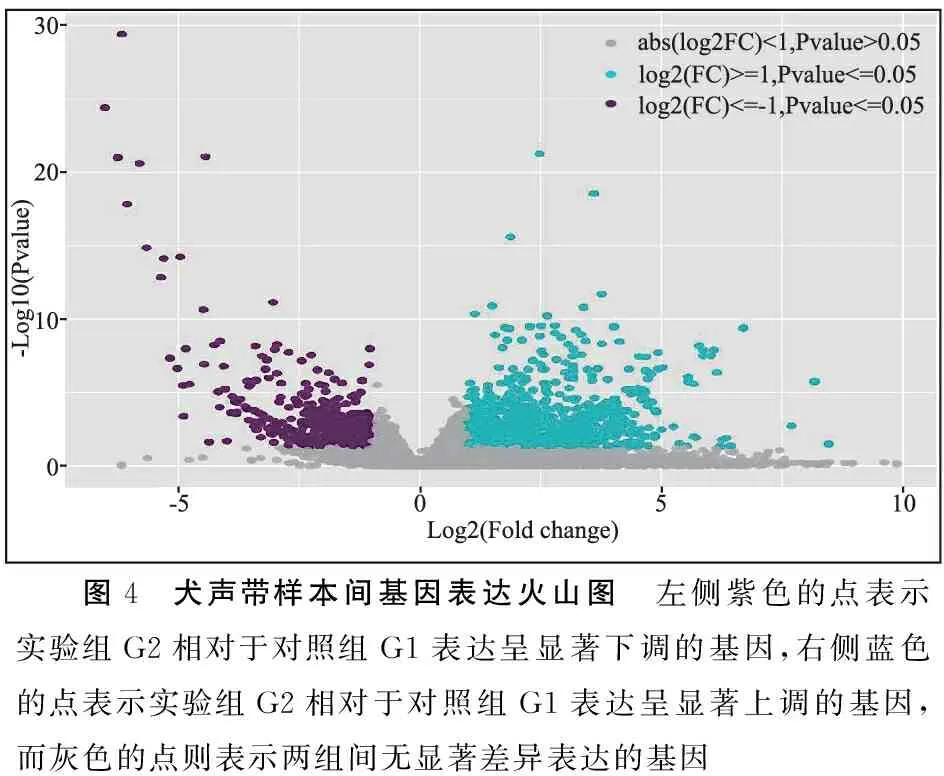
图4 犬声带样本间基因表达火山图 左侧紫色的点表示实验组G2相对于对照组G1表达呈显著下调的基因,右侧蓝色的点表示实验组G2相对于对照组G1表达呈显著上调的基因,而灰色的点则表示两组间无显著差异表达的基因
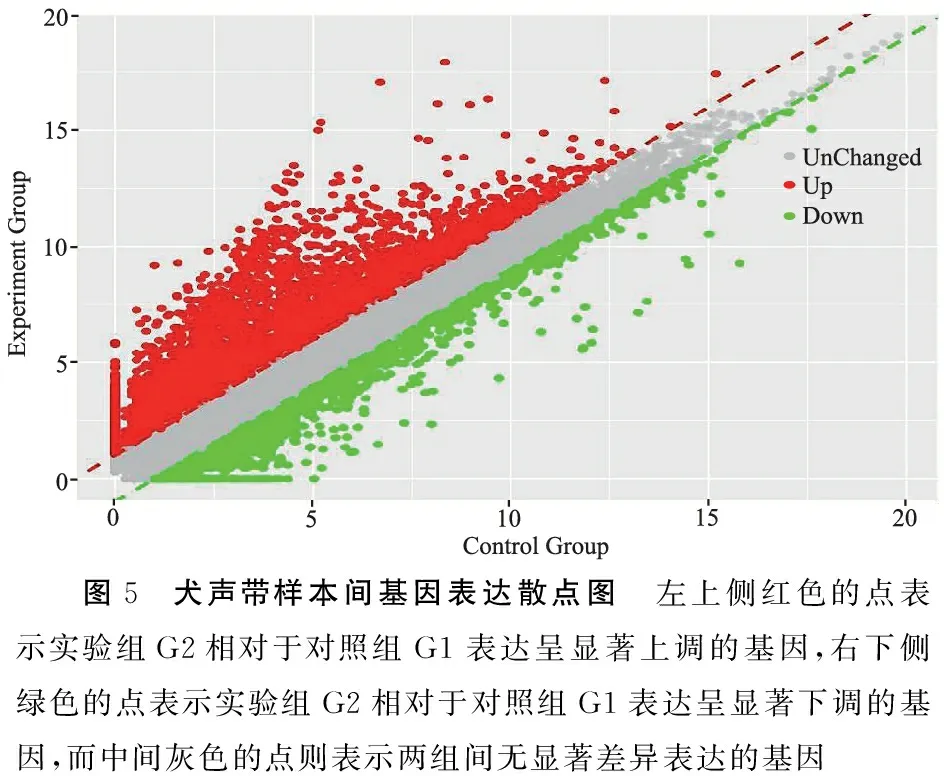
图5 犬声带样本间基因表达散点图 左上侧红色的点表示实验组G2相对于对照组G1表达呈显著上调的基因,右下侧绿色的点表示实验组G2相对于对照组G1表达呈显著下调的基因,而中间灰色的点则表示两组间无显著差异表达的基因
与声带瘢痕形成密切相关的基因家族见表1,包括炎症相关的IL家族、趋化因子CCL和CXCL家族、基质金属蛋白酶MMPs家族及其抑制剂TIMPs家族、参与多种细胞生理过程的Wnt家族、热休克蛋白HSP家族、丝裂原活化蛋白激酶MAPK家族和TGF-β家族等。其中,IL家族的IL16、IL18和IL33,CCL家族的CCL2、CCL8、CCL13、CCL14、CCL19、CCL20、CCL22和CCL23;CXCL家族的CXCL13和CXCL14;MMPs家族的MMP1、MMP2、MMP12、MMP16、MMP19、MMP25和MMP27、TIMP1均显著上调;Wnt家族的Wnt8a和Wnt通路抑制剂Wif1、DKK1、DKK2显著上调,但Wnt8b显著下调;HSP家族相关的HSP90β1显著上调,而HSPβ2、HSPβ2和HSPβ6显著下调;MAPK家族相关的MAPK4、MAPK12、MAP3K13、MAP3K20、MAP3K7CL和MAPKAPK2显著下调;TGF-β家族的BMP5和TGFβ2显著上调。

表1 犬正常声带和瘢痕声带间显著差异性基因
3 讨论
声带瘢痕是目前嗓音外科的常见并发症[8],尚缺乏有效统一的方法从组织学上逆转声带瘢痕,究其原因主要是因为声带瘢痕的发生机制尚不完全明确。声带损伤的预后与损伤程度相关,因透明质酸、核心蛋白聚糖等抗瘢痕形成物质的存在,上皮层及固有层浅层的损伤多可完全修复、不留瘢痕,但固有层深层乃至肌层的损伤会导致周边小血管的广泛闭合、纤维组织排序紊乱并过度增生,进而发生纤维化[9,10],导致瘢痕形成。低温等离子消融术是一种电化学微创技术,通过激发电极与组织之间的电解质产生带有能量的离子蒸汽层,即本质上是一种电热创伤,快速打破细胞分子化学键,达到多层组织快速消融的目的,有定位精准、用时短等优势[11],可对声带固有层深层及肌层造成所需程度的损伤,因此本研究所选用的低温等离子消融术具备构建声带瘢痕模型的能力。
本研究对犬左侧声带进行低温等离子消融术,术后3周见术侧声带组织充血肿胀,边缘不齐,可见红色肉芽组织形成,此时声带尚处于修复期;术后12周见术侧声带创面局部挛缩凹陷、边缘不整齐,此时声带已完成瘢痕修复。如前所述,声带损伤后,ECM发生降解与再合成,其胶原纤维、弹性纤维和纤维连接蛋白形态和含量改变,成纤维细胞增殖活跃,导致肉芽组织过度增生从而瘢痕化。本研究HE染色见术侧瘢痕声带鳞状上皮层明显增厚,疏松结缔组织层纤维化,纤维层增厚、排列紊乱,局部成团状或束状聚集,肌层亦可见散在纤维束;透射电镜见间质增厚、密度不均,细胞肿胀,细胞间界线不清,细胞核增生、线粒体增多,细胞处于活跃状态,与声带瘢痕化病理过程贴合。
本研究通过高通量测序分析发现瘢痕声带与正常声带间基因表达总体上存在较大差异性,瘢痕声带较正常声带基因表达呈现显著上调、显著下调和无显著差异三种趋势,其中显著上调的基因有:IL家族的IL16、IL18和IL33,CCL家族的CCL2、CCL8、CCL13、CCL14、CCL19、CCL20、CCL22和CCL23,CXCL家族的CXCL13和CXCL14,MMPs家族的MMP1、MMP2、MMP12、MMP16、MMP19、MMP25和MMP27,Wnt家族的Wnt8a和Wnt通路抑制剂WIF1、DKK1、DKK2,以及TIMP1、HSP90β1、BMP5和TGFβ2等。MMPs是胶原降解的关键酶,瘢痕形成的早期能降解I、II、III型胶原,其生理状况下与TIMPs以l∶l比例以非共价连接形成稳定复合物能维持ECM中胶原的动态平衡,二者动态平衡打破被认为是皮肤瘢痕形成及肝、肾、下呼吸道纤维化等疾病中的核心事件[12,13]。例如,MMP1表达异常会引起ECM的代谢紊乱,导致结构重塑、瘢痕形成等病理改变[14]。本研究测序发现包括MMP1在内的众多MMPs家族基因在瘢痕声带中高表达,证明MMPs家族基因在声带纤维化和瘢痕形成中也发挥了重要作用。IL33、MMP2和TIMP1常被作为评价肝组织纤维化程度的指标,其中IL33可通过促进巨噬细胞向M2型转化、诱导包括TGFβ在内的多种细胞因子、激活Th2细胞等多种作用诱导并促进纤维化;MMP2激活后可促进基质膜降解及血管生成,加速纤维化过程;而TIMP1作为MMP2的抑制剂,在MMP2激活后可被诱导高表达[15]。本研究测序发现这3种基因在声带过度纤维化致使瘢痕形成中也表现为高表达,还发现,CCL家族作为趋化因子,多数基因呈现高表达参与了ECM的重塑。
综上所述,本研究通过低温等离子消融术成功构建了犬声带瘢痕模型,并通过高通量测序富集出了与声带瘢痕形成密切相关的多个基因家族,初步筛选出了显著差异表达的靶基因,为声带瘢痕机制的探索和靶点研究的选择提供了一定的参考价值,但各个靶基因具体的功能定位和靶向调节作用以及靶基因及所在信号通路之间是否存在“窜扰”,尚需进一步研究。
