滋肾育胎丸水提液通过调控TGF-β 通路对DOR 秀丽隐杆线虫卵巢储备功能的影响
2024-01-29陶丛珊姜孙旻
许 云,陶丛珊,刘 枭,姜孙旻,姚 荧
(无锡市妇幼保健院,江苏 无锡 214000)
卵巢储备功能下降(diminished ovarian reserve,DOR)是指卵巢皮质区内的卵母细胞数量减少和(或)质量下降,属于生殖系统功能退行性疾病[1],进一步可发展为卵巢早衰。随着我国女性生育年龄的延迟,DOR 的发病率持续增高并呈现年轻化态势,其在女性不孕因素中约占10%[2],严重影响了女性的生殖健康和生活质量。
滋肾育胎丸源于全国中医妇科泰斗罗元恺教授经验方,临床研究发现其可以显著改善不孕症患者的卵巢储备功能[3-7],但对其作用机制研究较少,因此进一步深入探讨滋肾育胎丸对DOR 的干预作用机制对于临床合理用药具有重要意义。
秀丽隐杆线虫Caenorhabditiselegans,以下简称线虫,是目前生命科学研究中重要的模式动物之一,具有分化完整、结构简单的生殖系统,与哺乳动物卵子发生的生理过程高度保守。调控卵子发生的细胞凋亡通路,调控卵母细胞质量的转化生长因子-β (transforming growth factor-β,TGF-β)信号通路,在线虫和哺乳动物之间也高度保守[8]。这些基础研究的快速发展,为以线虫为模型的药物筛选和机制研究打下了很好的基础。本实验拟采用可致卵巢功能下降的雷公藤甲素进行应激暴露[9-10],构建线虫DOR 模型,研究滋肾育胎丸水提液改善卵巢储备功能的作用机制,明确其治疗靶点和分子通路,为滋肾育胎丸的临床应用提供理论依据。
1 材料
1.1 动物 秀丽隐杆线虫虫株,野生型线虫N2,MD701(bcIs39v)、JK2868 (qIs56v),均来源于美国明尼苏达大学线虫遗传中心。
1.2 药物 滋肾育胎丸 (国药准字Z44020008,批号A01026)购自广州白云山中一药业有限公司。将药丸碾碎成粉末,称取15.00 g,用适量去离子水浸泡30 min,大火煮沸后转小火熬制30 min,过滤后取滤液,滤渣再次用适量的去离子水浸泡30 min,大火煮沸后转小火熬制25 min,过滤后,合并2 次滤液,定容至50 mL,此时贮备液质量浓度为300 mg/mL (按生药量计)[11]。临用时,用纯水配制成5、10、20 mg/mL 使用。
1.3 试剂 雷公藤甲素对照品 (纯度98%,批号FY105B211)购自南通飞宇生物科技有限公司,称取1.0 mg 雷公藤甲素,溶于50.0 μL 二甲基亚砜,50 ℃超声振荡30 min,摇匀,用K 溶液配制为1 mg/mL 溶液。胰蛋白胨、酵母提取物(英国Oxoid 公司,批号3176539、4263680-02); 琼脂糖(美国HydraGene 公司,批号EZ6789A160);TRIzol (德国BioFrox 公司,批号R0016); PrimeScriptTMRT Master Mix (日本TaKaRa 公司,批号AL22263A); FSE DNA Green Master (瑞士Roche 公司,批号54460200);Triton-X-100 (广东光华科技股份有限公司,批号201811106)。
1.4 仪器 正置荧光显微镜Axio ScopeA1 (德国Zeiss 公司); Nanodrop1000 Spectrophotometer (美国Thermo Fisher Scientific 公司); LightCycler96 Real-Time PCR (瑞士Roche公司); 连续变倍体视显微镜XTZ-E (上海光学仪器六厂)。
2 方法
2.1 线虫分组、造模与给药 线虫培养于含有大肠杆菌OP50 的线虫生长培养基 (nematode growth medium,NGM),20 ℃恒温培养,同步化获得大量年轻成虫期线虫[12]。在表面涂布有大肠杆菌OP50 的直径30 mm 的琼脂培养基上,加入200 μL 0.1 mg/mL 雷公藤甲素溶液,使其均匀分布于培养基表面。待其晾干后将年轻成虫期线虫转移到加入雷公藤甲素溶液的培养基中,于20 ℃培养箱中处理10 h,制备DOR 线虫模型[10]。同期,另挑取未喂饲雷公藤甲素的线虫10 条作为空白组。将造模线虫随机分为雷公藤甲素组和滋肾育胎丸水提液5、10、20 mg/mL 组,每组10 条。各组线虫分别处理24、48、72 h,转移至无药物处理液的NGM 培养基中,观察后代数目、DTC 细胞荧光强度、粗线期凋亡细胞数目、终变期卵母细胞数目。处理48 h后,检测线虫细胞凋亡通路、TGF-β 通路关键基因mRNA 表达。
2.2 后代数目测定 后代数目是指将一个年轻成虫期线虫放入培养皿中处理,处理结束后,每隔24 h 将线虫转至1个新的NGM 培养皿,直至线虫停止产卵,于体视显微镜下观察,将每天所产子代数目(各期幼虫和受精卵)相加,即得该线虫的后代数目。
2.3 DTC 细胞荧光强度分析 于荧光显微镜下观察处理结束后的JK2868 线虫(GFP 特异性标记DTC 细胞的转基因线虫),分别在U 型性腺臂双侧远端顶部确定DTC 细胞,荧光显微镜下DTC 细胞为边界清晰、亮绿色伞状细胞,固定曝光时间,定焦拍照,应用Image J 软件对DTC 细胞的荧光强度进行分析。
2.4 粗线期细胞凋亡数目测定 于荧光显微镜下观察处理结束后的MD701 线虫(GFP 特异性标记生殖腺凋亡细胞的转基因线虫),凋亡细胞呈亮绿色圆形纽扣状。于荧光显微镜下统计线虫单侧性腺臂减数分裂区凋亡细胞的数目。
2.5 终变期卵母细胞数目测定 于显微镜下观察处理结束后的N2 线虫,统计线虫单侧性腺臂远端Loop 区转折处到性腺臂近端纳精囊之间卵母细胞的数目。
2.6 线虫卵子发生相关通路关键基因mRNA 表达检测 每组取约6 000 条线虫,以TRIzol 法提取RNA 后,逆转录为cDNA,配制25 μL 体系 (cDNA 2 μL、FSE DNA Green Master 12.5 μL、正向引物1.0 μL、反向引物1.0 μL、H2O 8.5 μL),在荧光实时定量PCR 仪上进行扩增反应,条件为95 ℃预变性5 s,特异退火30 s,采集荧光信号40 个循环; 72 ℃延伸10 min,并绘制熔解曲线。目的基因的引物用Primer 5.0 设计,序列见表1。以比较域值法测定目的基因相对表达,以2-ΔΔCT相对定量法计算目的基因与内参基因荧光的比值,用于表示目的基因的表达情况。

表1 引物序列
2.7 统计学分析 通过SPSS 24.0 软件进行处理,计量资料以(x±s)表示,各组间比较采用方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 雷公藤甲素致线虫卵巢储备功能下降模型评判 如表2 所示,与空白对照组比较,N2 线虫经0.1 mg/mL 雷公藤甲素处理10 h 后,后代数目、卵母细胞数量减少 (P<0.05,P<0.01)。结果显示雷公藤甲素对线虫的生育能力和卵母细胞形成能力有抑制作用,可用于构建卵巢储备功能下降模型。

表2 雷公藤甲素对N2 线虫生育能力的影响(个,x±s,n=10)
3.2 滋肾育胎丸水提液对DOR 线虫后代数目的影响 如表3 所示,与空白对照组比较,雷公藤甲素组后代数目减少(P<0.01); 与雷公藤甲素组比较,滋肾育胎丸水提液5、10、20 mg/mL 组线虫后代数目均增加(P<0.01),滋肾育胎丸水提液1、2.5 mg/mL 组线虫后代数目无明显变化(P>0.05)。因此,后续实验使用5、10、20 mg/mL 这3 个剂量进行。

表3 滋肾育胎丸水提液对DOR 线虫后代数目的影响(x±s,n=10)
3.3 滋肾育胎丸水提液对DOR 线虫卵母细胞数量的影响 如表4 所示,与空白对照组比较,雷公藤甲素组线虫卵母细胞数量减少(P<0.01); 与雷公藤甲素组比较,处理24、48 h 后,滋肾育胎丸水提液5、10 mg/mL 组线虫卵母细胞数量均增加(P<0.01),处理72 h 后,滋肾育胎丸水提液各剂量组线虫卵母细胞数量均增加 (P<0.01)。
表4 滋肾育胎丸水提液对DOR 线虫卵母细胞数的影响(±s,n=10)

表4 滋肾育胎丸水提液对DOR 线虫卵母细胞数的影响(±s,n=10)
注:与空白对照组比较,##P<0.01; 与雷公藤甲素组比较,**P<0.01。
组别剂量/(mg·mL-1)卵母细胞数目/个24 h48 h72 h空白对照组—9.7±0.39.3±0.49.7±0.4雷公藤甲素组0.15.5±0.3##5.2±0.5##4.8±0.4##滋肾育胎丸水提液组57.7±0.4**7.4±0.4**8.1±0.4**108.4±0.3**8.3±0.6**8.9±0.6**206.3±0.56.0±0.36.5±0.3**
3.4 滋肾育胎丸水提液对DOR 线虫DTC 伞状细胞荧光强度的影响 如表5 所示,处理24、48 h 后,与空白对照组比较,雷公藤甲素组线虫DTC 伞状细胞荧光强度减弱(P<0.05); 与雷公藤甲素组比较,滋肾育胎丸水提液10 mg/mL 组线虫DTC 伞状细胞荧光强度增强(P<0.05)。

表5 滋肾育胎丸水提液对DOR 线虫DTC 细胞荧光强度的影响(x±s,n=10)
3.5 滋肾育胎丸水提液对DOR 线虫凋亡细胞数量的影响 如表6 所示,处理24、48、72 h 后,与空白对照组比较,雷公藤甲素组线虫凋亡细胞数量均增加(P<0.05);与雷公藤甲素组比较,滋肾育胎丸水提液5、10 mg/mL 组线虫凋亡细胞数量均减少(P<0.05,P<0.01)。
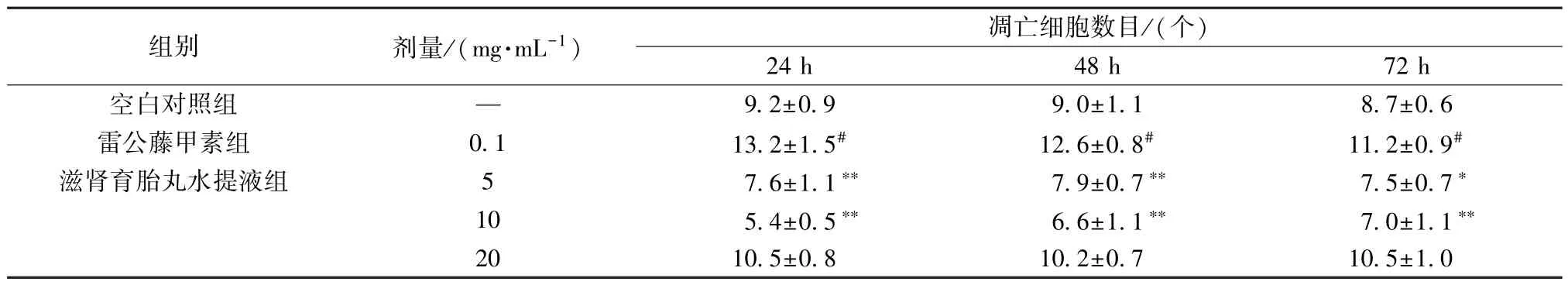
表6 滋肾育胎丸水提液对DOR 线虫凋亡细胞数的影响(x±s,n=10)
3.6 滋肾育胎丸水提液对DOR 线虫卵子发生相关信号通路基因mRNA 表达的影响 如表7~8 所示,与空白对照组比较,雷公藤甲素组线虫细胞凋亡通路ced-3、ced-4 mRNA表达升高(P<0.05),TGF-β 信号通路上daf-4 mRNA 表达降低(P<0.05); 与雷公藤甲素组比较,滋肾育胎丸水提液10 mg/mL 组线虫细胞ced-3、ced-4 mRNA 表达降低(P<0.05),daf-4、sma-2、sma-3 mRNA 表达升高(P<0.05)。

表7 滋肾育胎丸水提液对DOR 线虫凋亡通路基因mRNA表达的影响(x±s,n=10)

表8 滋肾育胎丸水提液对DOR 线虫TGF-β 通路基因mRNA 表达的影响(x±s,n=10)
4 讨论
中医理论认为肾主宰女性生殖机能的发育、旺盛与衰退,对女性卵巢生理功能起决定作用。滋肾育胎丸方中菟丝子和人参能补肾益精,而巴戟天、续断和杜仲能协同菟丝子补肾壮阳,白术和党参有补气健脾之功,全方合奏滋补肝肾、益气培元之功,临床上多用于脾肾虚弱型卵巢储备功能减退的治疗[13-14]。
滋肾育胎丸包含多种中药成分,检测任何一种活性成分均不能很好的体现其复方整体疗效,最好采用复方给药。但秀丽隐杆线虫体积极其微小,成年线虫也仅1.0 mm 左右长,无法采用啮齿类动物的给药方式。常规的线虫给药途径多采用将药物配制成溶液铺涂在琼脂培养板上给药。滋肾育胎丸为浓缩水蜜丸,为较好的保留复方中的有效成分,且利于给药,本实验对药物进行了水提,配制成适宜秀丽隐杆线虫给药的形式,但水提液和蜜丸状药物在制备方法上还是存在差异,可能会导致药物成分的改变,也可能会影响药物的药理作用,这些尚需进一步的研究。本实验先就滋肾育胎丸水提液提高生育力的药理作用进行初步研究。
本研究发现低剂量滋肾育胎丸水提液能提高DOR 秀丽隐杆线虫后代数目,提示其具有恢复卵巢功能的作用,继而确定低剂量滋肾育胎丸水提液能恢复DTC 细胞,降低凋亡细胞、提高终变期卵母细胞的生成。凋亡是卵母细胞发生中必不可少的过程,与雷公藤甲素组比较,10 mg/mL 滋肾育胎丸水提液能降低ced-3、ced-4 mRNA 表达,提示药物能通过抑制细胞凋亡来提高卵母细胞的生成。
TGF-β 信号通路在卵泡的发育中也起着重要作用,是调节秀丽隐杆线虫卵母细胞质量的信号通路,在秀丽隐杆线虫和哺乳动物中高度保守[8]。sma-6 和daf-4 编码Ⅰ型和Ⅱ型受体,配体受体复合物募集和磷酸化信号传导蛋白,该蛋白由sma-2、sma-3、sma-4 和sma-9 编码形成[15-17]。磷酸化后的信号传导蛋白进入细胞核,与DNA 结合后通过调控下游基因,调控卵母细胞质量[18]。与雷公藤甲素组比较,10 mg/mL 滋肾育胎丸水提液能升高daf-4、sma-2、sma-3 mRNA 表达。TGF-β 与细胞凋亡有相关性[19],提示药物可能通过TGF-β 通路影响细胞凋亡,从而促进卵母细胞的生成。
综上所述,滋肾育胎丸水提液可以通过影响TGF-β 通路抑制细胞凋亡,从而提高卵母细胞的质量和数量,促进卵母细胞的发育成熟,提高卵巢储备功能。但滋肾育胎丸成分复杂,富含丰富的活性物质,其具体的活性成分和作用机制尚需进一步的研究。
