灯台叶总碱与氟康唑联用对耐药白念珠菌株CA23 的协同抑菌作用
2024-01-29廖一川苏刘艳李家生王应仙王睿睿
廖一川,苏刘艳,李家生,王应仙,李 俊,张 祎,王睿睿*
(1.云南中医药大学,云南 昆明 650500; 2.云南省民族特色养生理论与健康产品工程实验室,云南 昆明 650500)
白念珠菌Candidaalbicans是一种分布广泛的条件致病菌,好发于免疫低下及免疫缺陷人群,易引起黏膜感染和全身感染。据研究报道,全世界约70%的真菌感染由白念珠菌引起[1],且死亡率达40%[2]。目前临床治疗药物种类稀缺,一线药物频繁使用引起的耐药性使单一药物治疗效果较差。研究表明,一些中药复方、中药提取物及中药来源的天然化合物能有效抑制白念珠菌生长,特别是与氟康唑联用时,表现出良好的协同抗菌作用[3]。课题组长期从事中药及其活性成分抗真菌活性筛选,发现灯台叶总碱与氟康唑联用仅对白念珠菌氟康唑耐药株发挥抑菌作用,在此基础上,进一步探讨灯台叶总碱与氟康唑联用对耐药白念珠菌的作用机制,以期为灯台叶总碱的抗真菌感染应用提供科学依据。
1 材料
1.1 菌株及预处理 临床耐药株CA23、CA381、CA4508、CA3816、CA800、CA3511、CA550、CA602、CA187、CA808、CA4574,由昆明医科大学第一附属医院皮肤科李玉叶教授惠赠; 白念珠菌SC5314 购自云南登楼生物科技有限公司。菌株从-80 ℃冰箱中取出,解冻后用沙氏液体培养基稀释,取适量接种于沙氏琼脂平板,37 ℃恒温恒湿培养24~48 h,接种环取单克隆菌落,传代备用。
1.2 药物 氟康唑 (南昌弘益药业有限公司,批号200117); 灯台叶总碱由中国科学院昆明植物研究所罗晓东研究员惠赠。
1.3 试剂 沙氏液体培养基、沙氏琼脂培养基(广东环凯微生物科技有限公司,批号1097061、1106401); 二甲基亚砜(DMSO)(天津市化学试剂一厂,批号EZ6789B127);K2HPO4(西陇科学股份有限公司,批号181024); 氯仿(云南杨林工业开发区汕滇药业有限公司,批号20191015); 营养肉汤、罗丹明6G (R6G)、甘露醇(北京索莱宝科技有限公司,批号 531F031、20200928、20181010); 无氨基酸酵母氮源培养基(yeast nitrogen base,YNB)(北京酷来搏科技有限公司,批号PM291712100);葡萄糖(广州赛国生物科技有限公司,批号EZ2811F128);TRIzol 试剂 (上海罗氏制药有限公司,批号252612);cDNA 逆转录试剂盒、实时荧光定量PCR 试剂盒(美国Promega 公司,批号0000499195、0000497768); db-cAMP(美国MedChemExpress 公司,批号66069)。
1.4 仪器 恒温恒湿真菌培养箱(天津市泰斯特仪器有限公司); 恒温摇床(上海天呈实验仪器制造有限公司); 生物安全柜(新加坡ESCO 公司); 血细胞计数板(上海求精生化试剂仪器有限公司); 多功能酶标仪(美国Molecular Devices 公司); 倒置生物显微镜(德国卡尔蔡司公司); 多功能PCR 仪(杭州晶格科学仪器有限公司)。
2 方法
2.1 培养基配制 SD 液体培养基:精密称取营养肉汤2 g至200 mL 纯水混匀溶解,115 ℃湿热灭菌30 min,冷却至50~60 ℃,加入2 g 甘露醇、0.4 g K2HPO4混匀后置于4 ℃冰箱保存备用。
Spider 液体培养基:灭菌纯水200 mL,YNB 1.34 g,葡萄糖4 g 分别单独溶解,混合在一起后置于4 ℃冰箱保存备用。
卵黄琼脂培养基:2 g 葡萄糖、4 g 蛋白胨、2 g 琼脂粉、4.64 g NaCl、0.006 9 g CaCl2至100 mL 纯水,121 ℃湿热灭菌15 min,冷却至45~55 ℃,加入15 mL 新鲜蛋黄悬液(蛋黄与生理盐水等体积混匀)轻轻混匀。
2.2 灯台叶总碱体外抗真菌活性筛选 采用CLSI-M27-A3微量稀释法[4]测定灯台叶总碱对SC5314 和临床分离株的最小抑菌浓度(minimum inhibitory concentration,MIC)。菌株在沙氏琼脂培养基中传至第二代,收集菌细胞用沙氏液体培养基调整终浓度为1×105CFU/mL。药物质量浓度梯度设为1 000、200、40、8、1.6、0.32 μg/mL。96 孔板中每孔加入100 μL 不同质量浓度的含药培养基,再加入100 μL菌细胞悬液混匀,37 ℃恒温恒湿培养24 h,测定625 nm 波长处光密度(OD)值,以抑制率达到80%以上的药物浓度作为最小抑菌浓度。实验同时设置培养基空白对照、正常生长对照。
2.3 灯台叶总碱与氟康唑联用剂量设置 采用棋盘法测定灯台叶总碱与氟康唑联用对CA23 的MIC。96 孔板分别加入不同质量浓度的灯台叶总碱与氟康唑,药物按2 倍倍比稀释,氟康唑质量浓度梯度0 ~128 μg/mL,灯台叶总碱质量浓度梯度0~1 024 μg/mL。每孔分别加入对应的各50 μL不同质量浓度的含药培养基,操作步骤同“2.2” 项。
2.4 灯台叶总碱与氟康唑联用对耐药白念珠菌时间-杀菌曲线的影响 实验设立对照组、氟康唑组、灯台叶总碱组、氟康唑+灯台叶总碱组,每组分别加入相应药物及菌液,菌液终浓度为1×105CFU/mL,无菌过滤透气封口膜封口培养。各组分别在0、2、4、8、12、24、36、48、72 h 取样100 μL 于96 孔板中(每组设置3 个复孔),在625 nm 波长处测定OD 值。以取样时间为横坐标(X),所测OD 值为纵坐标(Y)绘制时间-杀菌曲线。
2.5 灯台叶总碱与氟康唑联用对耐药白念珠菌外排泵的影响 使用新鲜沙氏液体培养基调整CA23 终浓度为1×107CFU/mL,除对照组外,氟康唑组、灯台叶总碱组、氟康唑+灯台叶总碱组分别加入相应药物,与菌液共同摇床孵育5 h,无菌PBS 清洗3 次,10 mL PBS 重悬,摇床孵育1 h,充分消耗葡萄糖; 分别加入R6G(终浓度10 μmol/L),摇床孵育1 h,冰水浴10 min 终止吸收,PBS 清洗3 次,将上述分组再分2 个组系,一组系加入含5%葡萄糖的PBS,另一组系加入无菌PBS 继续孵育,并于0、0.5、1.0、1.5、2.0、2.5、3.0 h 取1 mL,离心取上清100 μL,在激发波长488 nm、发射波长525 nm 处检测荧光强度,各组每1 个时间点设3 个复孔。
2.6 灯台叶总碱与氟康唑联用对耐药白念珠菌耐药相关基因的影响
2.6.1 菌液准备 将培养16~24 h 的菌株用新鲜沙氏液体培养基重悬调整浓度为1×105CFU/mL,设立对照组、氟康唑组、灯台叶总碱组、氟康唑+灯台叶总碱组。每组总体积40 mL,分别加入菌液和对应药物混匀,无菌过滤透气封口膜封口,于恒温摇床37 ℃,150 r/min 培养16 h 后,离心弃上清并用无菌PBS 洗3 次备用。
2.6.2 总RNA 提取 采用液氮研磨法提取各组总RNA。用接种环取适量菌细胞至预冷的研钵中,把菌细胞调整为便于研磨的立体状,加入液氮快速研磨至白色粉末出现,加入TRIzol 裂解液混匀,将其转移至无菌无酶EP 管中,室温放置5 min,加入氯仿剧烈混匀,室温放置3 min,4 ℃、12 000 r/min 离心15 min,待样品分层后取上清200 μL,加入等体积异丙醇轻摇混匀,室温放置10 min,4 ℃、12 000 r/ min 离心10 min,弃上清,加入75% 乙醇洗涤沉淀2 次,弃上清,加入无酶水使RNA 沉淀完全溶解。
2.6.3 cDNA 制备 按Promega Go Script 反转录试剂盒,20 μL 总体系,冰上进行cDNA 逆转。加样结束后,低速离心机使之沉降混匀,进行逆转录,反应条件为42 ℃15 min,70 ℃15 min,4 ℃10 min。
2.6.4 引物设计及合成 引物由上海生工生物工程技术服务有限公司合成,序列见表1。

表1 引物序列(Ⅰ)
2.6.5 实时荧光定量PCR 反应 按照试剂盒制备反应体系,总体系20 μL。加样结束后,低速离心机使之沉降混匀,反应条件为预变性95 ℃120 s; 扩增定量程序40 个循环,循环参数为95 ℃变性120 s,95 ℃退火15 s,72 ℃延伸60 s。每个样品设置3 个复孔,重复实验3 次。
2.7 灯台叶总碱与氟康唑联用对耐药白念珠菌形态转化的影响 菌丝诱导液体培养基Spider/SD 调整菌株终浓度为1×105CFU/mL,实验分为对照组、氟康唑组、灯台叶总碱组、氟康唑+灯台叶总碱组。每组总体积4 mL,分别加入菌液和相应药物混匀,每孔1 mL,接种于24 孔板,37 ℃下恒温恒湿孵育,分别在2、4、6 h 于显微镜下观察白念珠菌形态转化情况并拍照。
2.8 扫描电镜观察耐药白念珠菌菌丝形态 菌丝诱导液体培养基Spider/SD 调整菌株终浓度为1×105CFU/mL,实验分为对照组、氟康唑组、灯台叶总碱组、氟康唑+灯台叶总碱组。每组总体积4 mL,分别加入菌液和相应药物混匀,每孔1 mL,接种于24 孔板,37 ℃下恒温恒湿孵育6 h,离心收集菌细胞,用预冷无菌PBS 洗涤并重悬,调整适量浓度。各组取10 μL 垂直滴在细胞爬片上,37 ℃室温放置30 min,加入20 μL 5%戊二醛,避光固定过夜。无菌PBS 清洗固定好的细胞爬片,乙醇梯度脱水,干燥后将样品贴在带双面胶纸带的样品台上,经真空蒸镀仪喷金20 min,于扫描电镜下观察并拍照。
2.9 灯台叶总碱与氟康唑联用对耐药白念珠菌菌丝相关基因的影响
2.9.1 引物设计及合成 引物由北京擎科生物科技股份有限公司合成,序列见表2。
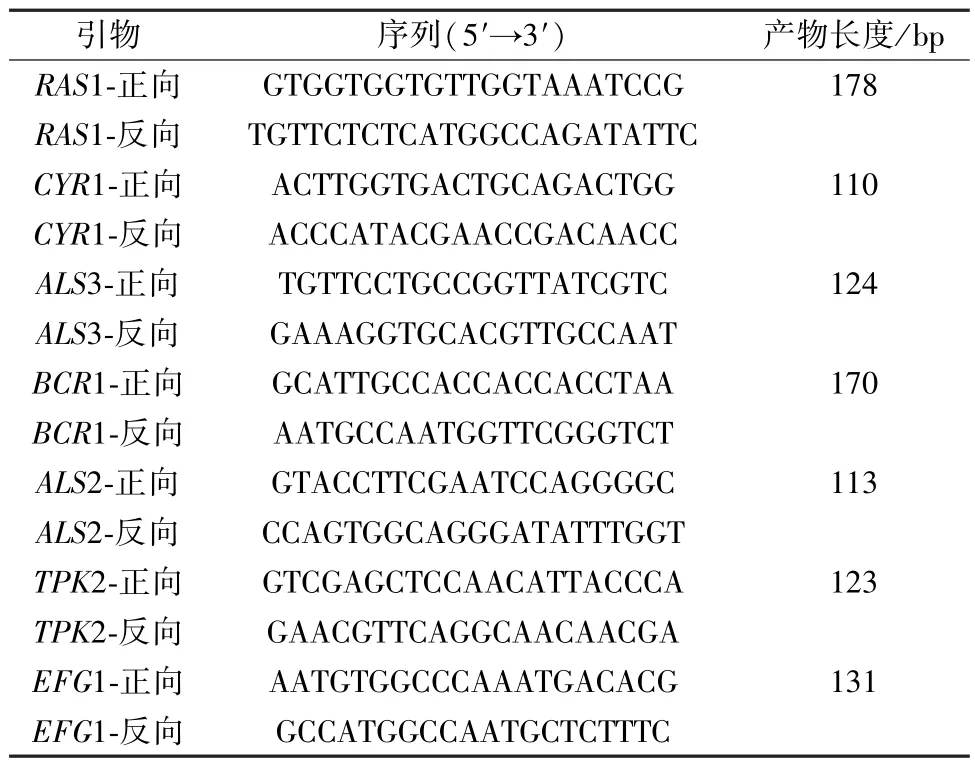
表2 引物序列(Ⅱ)
2.9.2 实时荧光定量PCR 按照试剂盒制备反应体系,总体系20 μL。加样结束后,低速离心机使之沉降混匀,反应条件为95 ℃预变性600 s; 扩增定量程序45 个循环,循环参数为95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s。每组样品设置3 个复孔,重复实验3 次。
2.10 外源性cAMP 添加实验 使用菌丝诱导液体培养基Spider/SD 调整菌株浓度为1×105CFU/mL,实验分为对照组、氟康唑+灯台叶总碱组、添加db-cAMP 的对照组和添加db-cAMP 的氟康唑+灯台叶总碱组。每组总体积4 mL,分别加入菌液、相应药物和db-cAMP 混匀,每孔1 mL,接种于24 孔板,37 ℃恒温恒湿孵育,于显微镜下观察白念珠菌形态转化情况并拍照。
2.11 灯台叶总碱与氟康唑联用对耐药白念珠菌胞外磷脂酶活性的影响 使用新鲜沙氏液体培养基调整CA23 终浓度为1×105CFU/mL,实验分为对照组、氟康唑组、灯台叶总碱组、联用Ⅰ组(1/4MIC)、联用Ⅱ组(1/2MIC)、联用Ⅲ组(1MIC)、联用Ⅳ组(2MIC)、联用Ⅴ组(4MIC)。每组体积10 mL,加入菌液和相应药物,37 ℃恒温摇床150 r/min培养16~24 h 后,离心弃上清并用无菌PBS 清洗3 次,PBS 重悬调整浓度为1×107CFU/mL,每组取10 μL滴加于卵黄琼脂培养皿上,37 ℃恒温恒湿培养箱中培养72 h,游标卡尺测量沉淀圈及菌落直径,计算Pz 值,公式为Pz=菌落直径/沉淀圈直径,以Pz 值的大小表示磷脂酶的活性。每组平行3 次,实验重复3 次。
2.12 统计学分析 通过Graphpad Prism 8.0 软件进行处理,计量资料以(±s)表示,组间正态分布资料采用t检验,多组间差异比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 灯台叶总碱体外抗真菌活性 如表3 所示,除SC5314、CA4574 外,其余菌株均为氟康唑耐药株。灯台叶总碱单用对氟康唑耐药株及敏感株均无抑菌作用; 灯台叶总碱与氟康唑联用时,对敏感株有抑制作用,但无协同增效作用,但对所有氟康唑耐药株均表现为显著协同抑菌作用,其联合指数FICI 在0.006~0.11 范围。

表3 氟康唑与灯台叶总碱对白念珠菌的抑菌活性(x±s,n=3)
3.2 灯台叶总碱与氟康唑最佳联用浓度测定 棋盘法测定灯台叶总碱与氟康唑对临床白念珠菌CA23 联用时的药物质量浓度,以两药联用能达到的最小抑菌浓度为标准,主要对应抑制率达80%以上的药物质量浓度,具体对应灯台叶总碱质量浓度32 μg/mL,氟康唑质量浓度16 μg/mL,结果见表4。
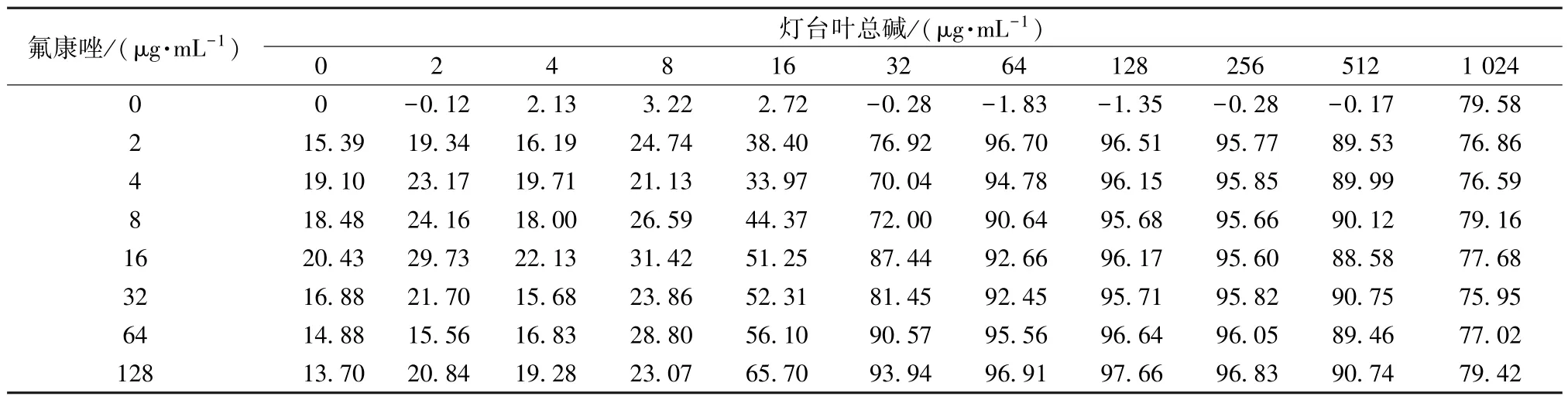
表4 灯台叶总碱与氟康唑不同联用剂量的抑菌情况(n=3)
3.3 灯台叶总碱与氟康唑对耐药白念珠菌时间-杀菌曲线的影响 如图1 所示,单用氟康唑(16 μg/mL)对CA23有轻微抑制作用,单用灯台叶总碱(32 μg/mL)则无明显抑制作用; 灯台叶总碱联合氟康唑作用4 h 后,表现出抑制作用,尤其是药物处理12 h 时(P<0.01)。
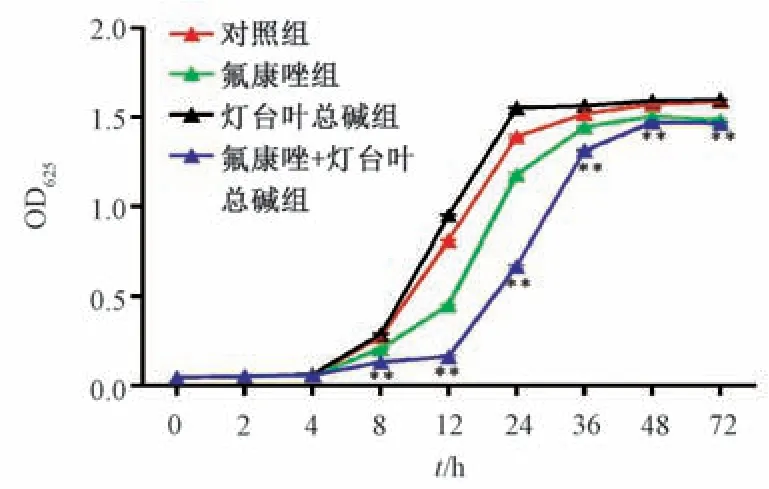
图1 灯台叶总碱与氟康唑对CA23 时间-杀菌曲线的影响(n=3)
3.4 灯台叶总碱与氟康唑对耐药白念珠菌外排水平的影响 与对照组比较,未加葡萄糖组,在灯台叶总碱和氟康唑+灯台叶总碱分别处理3 h 内,均对菌株的外排无抑制,见图2A。与对照组比较,加葡萄糖组,氟康唑和氟康唑+灯台叶总碱分别处理3 h 内,均于第0.5 小时后开始抑制菌株的外排,并持续至第3 小时(P<0.05,P<0.01); 但与氟康唑组比较,氟康唑+灯台叶总碱组并无明显变化,见图2B。

图2 灯台叶总碱与氟康唑对CA23 外排水平的影响(±s,n=3)
3.5 灯台叶总碱与氟康唑对耐药白念珠菌耐药相关基因表达的影响 如图3 所示,与对照组比较,氟康唑+灯台叶总碱组仅下调MDR1 mRNA 表达(P<0.01),但与氟康唑组比较并无明显变化。

图3 灯台叶总碱与氟康唑对CA23 耐药相关基因表达的影响(±s,n=3)
3.6 灯台叶总碱与氟康唑对耐药白念珠菌形态转化的影响 如图4 所示,CA23 在SD 和Spider 液体培养基培养6 h均能形成错综复杂、细长盘绕的菌丝。给药处理后,灯台叶总碱组对菌丝并无抑制作用,氟康唑组在2、4 h 均有抑制作用,6 h 略有轻微抑制作用; 而灯台叶总碱和氟康唑联合组在2、4、6 h 均能抑制菌丝的生长,且与氟康唑组比较,抑制作用持续,菌丝长度较短,菌丝数量也减少。

图4 灯台叶总碱与氟康唑对CA23 形态转化的影响(×20)
3.7 扫描电镜下观察灯台叶总碱与氟康唑对耐药白念珠菌菌丝形态的影响 如图5 所示,扫描电镜下,氟康唑与灯台叶总碱联用能够抑制CA23 菌株在2 种菌丝诱导培养基中的菌丝生长,而氟康唑与灯台叶总碱分别单用处理下依然存在菌丝交错。
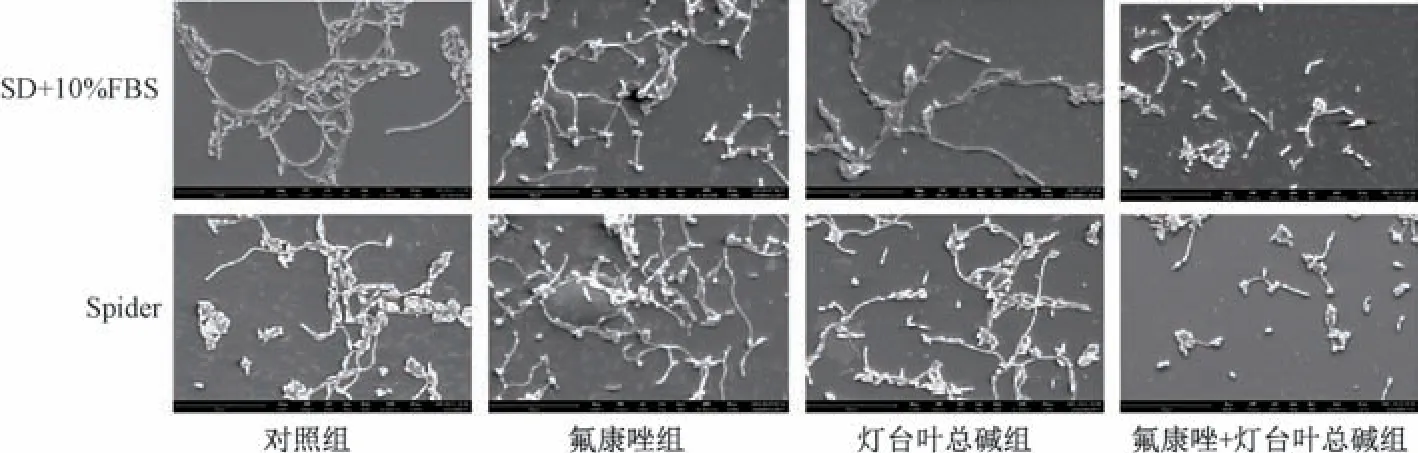
图5 扫描电镜下灯台叶总碱与氟康唑对CA23 形态转化的影响(×3 000)
3.8 灯台叶总碱与氟康唑对耐药白念珠菌菌丝相关基因表达的影响 与对照组比较,灯台叶总碱组和氟康唑+灯台叶总碱组菌丝相关基因RAS1、CYR1、BCR1、EFG1、ALS2、ALS3、TPK2 mRNA 表达降低(P<0.01),氟康唑组RAS1、BCR1、EFG1、ALS2、ALS3、TPK2 mRNA 表达降低 (P<0.01); 与氟康唑组比较,氟康唑+灯台叶总碱组RAS1、CYR1、BCR1、ALS2、ALS3、TPK2 mRNA 表达降低 (P<0.01),而EFG1 mRNA 表达无明显变化(P<0.01),见图6。
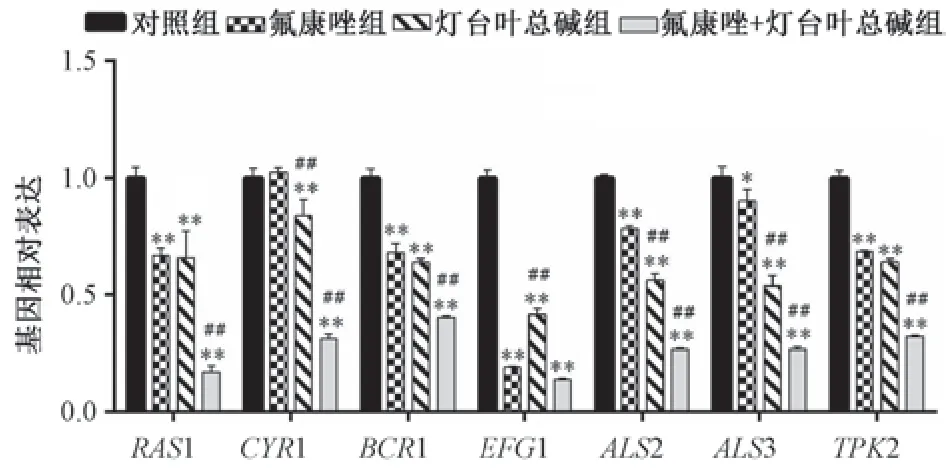
图6 灯台叶总碱与氟康唑对CA23 菌丝相关基因表达的影响(±s,n=3)
3.9 添加外源性cAMP 对灯台叶总碱与氟康唑作用于CA23 的影响 如图7 所示,cAMP 类似物的加入可以减轻部分氟康唑与灯台叶总碱联用引起的菌株形态变化,尤其是在SD 液体培养基中,可以看出添加外源性cAMP 后,氟康唑与灯台叶总碱联用组菌菌丝更密集。

图7 外源性cAMP 对灯台叶总碱与氟康唑作用于CA23 的影响(×20)
3.10 灯台叶总碱与氟康唑对耐药白念珠菌胞外磷脂酶活性的影响 磷脂酶活性分为阴性(Pz =1)、极低(Pz =0.90 ~0.99)、低 (Pz =0.80 ~0.89)、高 (Pz =0.70 ~0.79)、极高(Pz =0.60 ~0.69)。如表5 所示,CA23 有极高的磷脂酶活性,灯台叶总碱处理后并无明显变化(P>0.05),氟康唑处理对磷脂酶活性有略微抑制作用,但磷脂酶活性依然高(P<0.05),氟康唑与灯台叶总碱联用能降低磷脂酶活性(P<0.01),且对灯台叶总碱呈现剂量依赖性。

表5 灯台叶总碱与氟康唑对CA23 胞外磷脂酶活性的影响(x±s,n=3)
4 讨论
灯台叶是夹竹桃科鸡骨常山属糖胶树的干燥叶[5],具有镇痛止咳、抗氧化、抗肿瘤等广泛的药理活性[6]。研究显示,灯台叶提取物对部分细菌和真菌均具有良好的抑菌活性[7-8],还具有一定的抗病毒作用[9],但对白念珠菌相关研究报道甚少。本实验发现,灯台叶总碱与氟康唑联用仅对白念珠菌氟康唑耐药株表现出协同作用,其FICI 在0.006~0.11。
白念珠菌对唑类耐药的原因是多方面的[10],一方面是外排泵活力增强,主要表现膜转运蛋白增加,如CDR1p、CDR2p、MDR1p[11]; 另一方面是ERG11 基因的过表达或突变[12]。本课题组就此进行研究,发现灯台叶总碱的增敏作用与耐药基因表达无关,而与毒力因子相关。
白念珠菌从共生菌转变为病原体的过程中伴随毒力因子的释放,如粘附素的表达、生物膜的形成、水解酶的分泌、形态的改变以及其代谢适应性等[13]。白念珠菌形态转变是其主要毒力因子之一。白念珠菌能够在宿主体内以酵母、假菌丝和菌丝生长形式间进行可逆转换[14]。通过菌丝的形成、伸长、拉伸能最终杀死巨噬细胞[15],抵抗免疫系统,增加致病风险。在2 种诱导菌丝生长的液体培养基中均观察到临床耐药株CA23 形成密集、盘绕的菌丝,加入氟康唑和灯台叶总碱后,菌丝长度较短且数量减少,从而抑制菌丝生长。
白念珠菌依赖Ras1/cAMP/PKA 信号通路,参与调节形态转换和毒力特性。缺失RAS1 基因会导致菌丝生长缺陷,同时降低系统性感染模型小鼠的毒力[16]。而TPK2 基因的缺失,使PKA 活性降低为野生型的10%,伴随菌丝生长受阻[17]。转录调控因子EFG1 及BCR1,在调节菌丝方面发挥重要作用[18]。凝集素样序列基因家族 (agglutinin-like sequence,ALS)是白念珠菌粘附的主要成员,ALS3 高表达白念珠菌更易导致对唑类药物的耐药性增加[19]。本实验结果显示,氟康唑和灯台叶总碱联用降低了RAS1、CYR1、TPK2、BCR1、ALS2 和ALS3 mRNA 表达,但对EFG1 mRNA表达的影响与氟康唑单用并无明显变化,说明两药联用对Ras1/cAMP/PKA 通路可能是通过中央调控因子BCR1 来调节的。加入db-cAMP,再次验证两药联用对菌丝的抑制是通过Ras1/cAMP/PKA 途径实现的。
磷脂酶作为白念珠菌中另一重要的毒力因子,主要通过分解宿主细胞膜,增加膜通透性,提高入侵宿主的能力[20]。本研究发现,氟康唑和灯台叶总碱联用对白念珠菌的抑制作用可能与抑制胞外磷脂酶活性有关,且抑制效果与灯台叶总碱剂量呈正相关。
综上所述,灯台叶总碱与氟康唑联用对白念珠菌临床耐药株表现出良好的协同作用,其可能是通过抑制菌丝和磷脂酶活性,调节Ras1/cAMP/PKA 途径影响白念珠菌毒力因子而引起的。这表明灯台叶总碱有成为氟康唑增敏剂的潜力,但灯台叶总碱对临床耐药株深入的作用机制及其在体内抗真菌的作用机制还有待研究。
