紫苏叶抗急性肝损伤活性组分筛选及机制研究
2024-01-29王琪瑶张艳蕾龚张斌李医明朱维良
王琪瑶,张艳蕾,龚张斌,张 勇,贾 琦,李医明,朱维良
(1.上海中医药大学中药学院,上海 201203; 2.中国科学院上海药物研究所,上海 201203; 3.上海中医药大学基础医学院,上海 201203; 4.中国科学院大学,北京 100049)
紫苏为唇形科紫苏属植物紫苏Perillafrutescens的带叶嫩枝,属于药食同源中药,味辛,性温,归肺、脾经[4]。紫苏叶、梗、果实可分别入药,其中紫苏叶是其最常用入药部位,《名医别录》 始载其功效,谓能“下气,除寒中”[5],具有解表散寒、行气和胃功效,主治风寒感冒、恶心呕吐、鱼蟹中毒等症[6]。现代研究表明,紫苏叶具有抗炎[7]、抗氧化[8]、抑菌[9]、抗肿瘤[10]和保肝等生理活性。现有文献报道,紫苏叶水提物和多糖对急性化学性肝损伤有保护作用并且可以改善2 型糖尿病大鼠肝损伤[11-13]。但上述研究并未系统比较紫苏叶水煎液各组分之间的保肝活性差异,同时也未见紫苏叶水煎液中总黄酮的保肝活性相关报道。本研究旨在探讨紫苏叶传统水煎液不同组分对四氯化碳(CCl4)诱导的小鼠急性化学性肝损伤的保护作用,筛选最佳活性组分并探究其作用机制。
1 材料
1.1 动物 SPF 级C57BL 雄性小鼠,6 周龄,体质量(20.0±2.0)g,购自上海西普尔-必凯实验动物有限公司[实验动物生产许可证号SCXK (沪)2018-0006],饲养于上海中医药大学实验动物中心[实验动物使用许可证号SYXK (沪)2020-0009],环境温度25 ℃,相对湿度45% ~55%,光暗周期12 h/12 h,自由进食饮水。动物实验经上海中医药大学实验动物伦理委员会批准 (伦理号PZSHUTCM201218014),符合3R 原则。
1.2 药物与试剂 干燥紫苏叶(批号200111,安徽旭松中药饮片有限公司)。芦丁对照品(批号ST03950120,纯度>98%,上海诗丹德生物技术有限公司); 奥贝胆酸(批号20052315,纯度98%,上海士锋生物科技有限公司)。95% 乙醇、CCl4、氯仿、异丙醇 ( 批号 20210514、20210901、20110419、20171121,国药集团化学试剂有限公司); SOD、MDA 检测试剂盒 ( 批号 20211115、20211020,南京建成生物工程研究所有限公司); TGF-β1、TNF-α、IL-6、IL-1β 检测试剂盒 ( 批号 A98110545、A28210852、A20610936、A201BH20133,杭州联科生物技术股份有限公司); RNAiso Plus 试剂、PrimeScript® RT Master Mix 试剂盒、SYBR®Premix Ex TaqTM试剂盒(批号AA7102-1、RR036A、RR820A,日本TaKaRa 公司)。
1.3 仪器 安捷伦1260 型高效液相色谱仪、DAD 检测器(美国Agilent 公司); FD-1000 冷冻干燥机(东京理化器械株式会社); 旋转蒸发仪(瑞士Buchi 公司); 7020 型全自动生化分析仪(日本日立公司); Synergy2 型多功能酶标仪(美国BioTek 公司); 5804R 型冷冻离心机增仪 (德国Eppendorf 公司); D3024R 型高速冷冻离心机 (美国Scilogex 公司); 电子天平[赛多利斯科学仪器(北京)有限公司]; SCIENTZ-48 高通量组织研磨机(宁波新芝生物科技股份有限公司); 实时荧光定量PCR 仪(瑞士Roche公司); 超微量紫外分光光度计(美国赛默飞公司); 光学显微镜(德国Carl Zeiss 公司)。
2 方法
2.1 紫苏叶各组样品制备 取干燥紫苏叶150 g,加入20倍量去离子水,在100 ℃下浸提1 h,提取2 次,用纱布粗滤,合并得到浸提液2.5 L,将浸提液蒸发浓缩至200 mL,向浓缩液中加入600 mL 95%乙醇,静置过夜,将上清液和固体部分冷冻干燥,得到上清液干燥样品(14.1 g)与固体干燥样品(25.0 g)。再取紫苏叶醇沉固体20 g 通过大孔树脂D101,依次以蒸馏水、10%乙醇为洗脱液进行梯度洗脱,并按照不同体积分数乙醇浓缩合并得到多糖(7.4 g)和水溶性总黄酮(2.5 g)。
2.2 紫苏叶上清液、固体及总黄酮组中黄酮含量测定
2.2.1 标准曲线绘制 精确称取芦丁对照品5.3 mg 于25 mL 量瓶中,60%乙醇稀释至刻度,摇匀,得到质量浓度为0.212 mg/mL 的芦丁对照品溶液,再精密量取该芦丁对照溶液0、1、1.5、2、3、4、5 mL,分别置于25 mL 量瓶中,加入0.3 mol/L 三氯化铝溶液3.0 mL,再加入1.0 mol/L 醋酸钠4.0 mL,用去离子水稀释并定容至25 mL,摇匀,放置16 min,在344 nm 波长处测定吸光度,以质量浓度为横坐标(X),吸光度为纵坐标(Y)绘制标准曲线[14]。
图1为薏米添加量对产品品质的影响。根据图1所示薏米的添加量不能过多也不能过少,添加量过少会使薏米鸡肉饼色泽较浅没有薏米香味;而添加量过多会使薏米鸡肉饼的颜色深且薏米的味道过重,掩盖肉香味。所以可以确定薏米的添加量在20%左右适宜。
2.2.2 样品含量测定 精确称取固体、上清液干燥样品及水溶性总黄酮各3.5 mg,分别置于10 mL 量瓶中,固体和总黄酮加去离子水定容至刻度,上清液加60%乙醇稀释至刻度,摇匀得到质量浓度为0.35 mg/mL 的供试品,再各取1 mL 供试品分别置于25 mL 量瓶中,加入0.3 mol/L 三氯化铝溶液3.0 mL,再加入1.0 mol/L 醋酸钠4.0 mL,用去离子水稀释并定容至25 mL,摇匀,得到质量浓度为14 μg/mL 的供试品。按照“2.2.1” 项下条件测定吸光度。根据标准曲线得出总黄酮含量。
2.3 动物分组、给药及造模 将小鼠随机分为正常组、模型组、阳性对照组(30 mg/kg 奥贝胆酸)、紫苏叶水煎液组(120 mg/kg)、紫苏叶水提醇沉上清液组(120 mg/kg)、固体组(120 mg/kg)、水溶性总黄酮组(120 mg/kg)及紫苏叶多糖组(120 mg/kg),每组8 只。自造模前1 周起,分别灌胃给予相应剂量药物(20 mL/kg),每天1 次,连续7 d; 正常组和模型组灌胃给予等体积PBS。末次给药2 h后,正常组腹腔注射花生油(10 mL/kg),其他各组小鼠腹腔注射0.5% CCl4(10 mL/kg)进行造模。
2.4 血清生化指标检测 造模完成后禁食不禁水23 h,麻醉小鼠后摘除眼球取血,3 500 r/min 离心15 min,分离得血清,全自动生化分析仪检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)活性和总胆红素(TBIL)水平。
2.5 小鼠肝脏指数计算 将小鼠脱颈椎处死,迅速摘除肝脏置于生理盐水中清洗,滤纸吸干水分、称重,计算肝脏指数,公式为肝脏指数=肝脏质量/小鼠体质量。
2.6 肝组织病理学检查 迅速取出小鼠右叶肝脏组织,置于4%多聚甲醛溶液中固定,石蜡包埋,制备切片,梯度乙醇脱水,二甲苯透明,苏木素-伊红(HE)染色,中性树胶封固,于光镜下观察肝组织病理变化。
2.7 肝组织脂质过氧化水平及炎性因子水平检测 称取肝组织100 mg,加入9 倍量0.9%氯化钠溶液,研磨,制备成10%肝组织匀浆,按照试剂盒说明书检测超氧化物歧化酶(SOD)活性和丙二醛(MDA)水平,以及转化生长因子-β1 (TGF-β1)、肿瘤坏死因子-α (TNF-α)、白细胞介素-6(IL-6)和白介素-1β (IL-1β)水平。
2.8 RT-qPCR 法检测肝组织NLRP3、caspase-1、IL-1βmRNA 表达 称取各组肝组织各25 mg,抽提总RNA,测定RNA 浓度,定量,逆转录反应制备cDNA。在PCR 八连管中加入各样本,设置2 个复孔,向各cDNA 加样本中加入相关引物和检测试剂,上机反应。反应条件为95 ℃预变性30 s; 95 ℃变性5 s,60 ℃退火35 s,70 ℃延伸60 s,共循环45 次。以2-ΔΔCT法计算各目的基因mRNA 相对表达。引物由生工生物工程(上海)股份有限公司合成,序列见表1。

表1 引物序列
2.9 统计学分析 通过SPSS 22.0 软件进行处理,数据以(±s)表示,组间均数比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 紫苏叶上清液、固体和总黄酮中黄酮的含量 回归方程为Y=0.004 5X+0.244 9 (R2=0.999 2),在8.48~42.40 μg/mL 范围内线性关系良好。
紫苏叶上清液、固体和水溶性总黄酮中的黄酮含量如表2 所示,表明紫苏叶水提醇沉固体组分中不仅含有多糖,还含有部分水溶性总黄酮。通过该水提醇沉方法得到紫苏叶总黄酮的提取率为6.26%,并且通过大孔吸附树脂分离能得到黄酮含量较高的水溶性总黄酮组分。
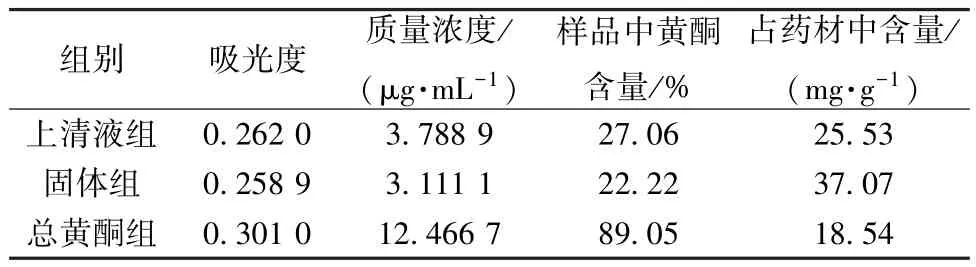
表2 紫苏叶上清液、固体和总黄酮中黄酮的含量
3.2 紫苏叶各组分对急性肝损伤小鼠肝脏指数的影响 如表3 所示,与正常组比较,模型组小鼠肝脏指数升高(P<0.01); 与模型组比较,阳性对照组和各给药组小鼠肝脏指数降低(P<0.05,P<0.01),以总黄酮组效果最为显著。
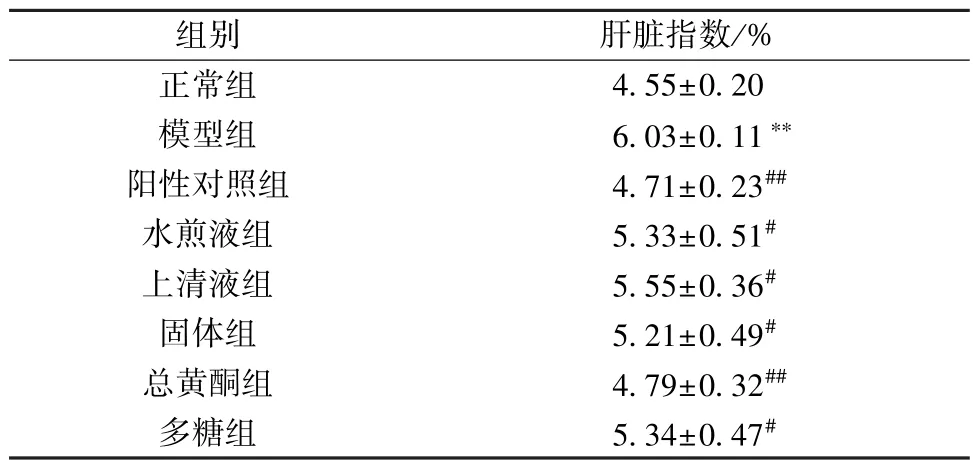
表3 紫苏叶各组分对急性肝损伤小鼠肝脏指数的影响(x±s,n=8)
3.3 紫苏叶各组分对急性肝损伤小鼠血清ALT、AST 活性和TBIL 水平的影响 如图1 所示,与正常组比较,模型组小鼠血清ALT、AST 活性和TBIL 水平均升高(P<0.01),表明CCl4致小鼠急性肝损伤模型建立成功; 与模型组比较,阳性对照组、固体组和总黄酮组ALT、AST 活性和TBIL 水平均降低(P<0.05,P<0.01),以总黄酮组效果最优,水煎液组ALT、AST 活性均降低(P<0.05)。

图1 紫苏叶各组分对急性肝损伤小鼠血清ALT、AST 活性和TBIL 水平的影响(±s,n=8)
3.4 紫苏叶各组分对急性肝损伤小鼠肝组织病理学的影响 如图2 所示,正常组肝小叶完整,轮廓清晰,肝细胞排列整齐,细胞核结构清晰,细胞无肿胀、炎性浸润,无坏死; 模型组肝细胞显著变性,细胞索紊乱,肝细胞肿胀,胞浆疏松,可见多数细胞坏死,细胞核固缩消失,汇管区可见大量炎性细胞浸润; 阳性对照组肝损伤程度降低,肝小叶结构基本完整,肝细胞排列较规则,肝组织内炎性浸润程度明显减轻; 紫苏叶各组分组均可不同程度地减轻肝组织病变,以水溶性总黄酮的改善效果最明显,肝小叶清楚可见,肝细胞排列整齐,细胞肿胀、坏死、炎性细胞浸润等病理现象明显改善。以上结果表明,紫苏叶的水溶性总黄酮对肝脏的保护效果最为显著,其次为固体组,且效果与阳性对照组无明显差异。因此选用固体组和总黄酮组对保肝作用机制作进一步研究。

图2 各组小鼠肝组织HE 染色(×200)
3.5 紫苏叶固体和总黄酮对急性肝损伤小鼠肝组织氧化应激、炎症及转化生长因子水平的影响 如图3 所示,与正常组比较,模型组小鼠肝组织TNF-α、IL-6、IL-1β 和MDA水平升高(P<0.01),SOD 活性和TGF-β1 水平降低(P<0.01); 与模型组比较,固体组和总黄酮组小鼠肝组织TNFα、IL-6、IL-1β 和MDA 水平均降低(P<0.05,P<0.01),SOD 活性和TGF-β1 水平均升高(P<0.05,P<0.01),且总黄酮组效果更优,阳性对照组小鼠肝组织TNF-α、IL-6、IL-1β 水平降低(P<0.05),SOD 活性升高(P<0.05)。

图3 紫苏叶固体和总黄酮对急性肝损伤小鼠肝组织氧化应激、炎症及转化生长因子水平的影响(±s,n=6)
3.6 紫苏叶固体和总黄酮对急性肝损伤小鼠肝组织NLRP3、caspase-1 和IL-1βmRNA 表达的影响 如图4 所示,与正常组比较,模型组小鼠肝组织NLRP3、caspase-1 和IL-1βmRNA 表达升高(P<0.01); 与模型组比较,阳性对照组、固体组和总黄酮组小鼠肝组织NLRP3、caspase-1 和IL-1βmRNA 表达均降低(P<0.05,P<0.01),且三组效果基本相当。

图4 紫苏叶固体和总黄酮对急性肝损伤小鼠肝组织NLRP3、caspase-1 和IL-1β mRNA 表达的影响(±s,n=6)
4 讨论
CCl4诱导的小鼠急性肝损伤属于化学性肝损伤,是保肝药物筛选研究中的经典模型。目前认为CCl4诱导肝损伤的主要机制与其自由基代谢产物有关。当CCl4进入机体后,在肝脏内通过CYP450 酶代谢产生大量CCl3-电子自由基,再与氧结合生成CCl3O2-氧自由基,导致重要的抗氧化酶SOD 活性降低[15],氧化终产物MDA 异常升高,引起肝细胞膜脂质过氧化,使细胞膜通透性增加,细胞质内的ALT 和AST 进入血液[16]。
炎性小体是由NLRP3、凋亡相关微粒蛋白及caspase-1组成的多蛋白复合物,在炎症反应的调节中发挥关键作用,与肝脏疾病的发生密切相关[17]。当肝脏受到CCl4刺激后,NLRP3 被激活,进而活化前体caspase-1 (pro-caspase-1)转变成有活性的caspase-1,在此基础上通过剪切前体IL-1β(pro-IL-1β)激活有炎性作用的IL-1β 的成熟和分泌[18],同时刺激TNF-α 和IL-6 等炎性因子的释放,产生炎症级联反应[19]。TNF-α 能与肝细胞膜上跨膜型TNF (mTNF)受体结合进而损伤肝细胞[20-21],与肝细胞的脂质过氧化形成相互促进的恶性循环[22]; IL-1β 可以诱导肝细胞产生更多的炎性因子,进一步加重肝脏的炎性损伤[23]; 随后IL-6 在受到TNF-α 和IL-1β 刺激后会进一步对其他细胞因子进行调控从而扩大肝细胞的免疫病理反应[19]。而TGF-β1 是一种多功能的细胞因子,它在肝脏长期受损的情况下可以促进纤维化的形成,但在早期炎性反应中它具有负性免疫调节的作用[24-25],可抑制多种免疫细胞的分化及细胞因子如TNF-α、IL-6 的分泌从而发挥抗炎的作用[26]。当机体发生细胞因子风暴时,多种促炎因子的释放会导致TGF-β1 的大量损耗从而加重肝脏的炎症反应。因此,TNF-α、IL-6、IL-1β 以及TGF-β1 的水平能反映肝脏早期炎性损伤的程度。
本研究对中药紫苏叶水煎液不同组分的黄酮含量进行了分析,发现紫苏叶水提醇沉固体中不仅含有多糖成分,还含有一定浓度的水溶性总黄酮组分,在紫苏叶药材中的含量为37.07 mg/g,且用该水提醇沉工艺方法,可使紫苏叶总黄酮的提取率达到6.26%。
本实验进一步采用了CCl4诱导的小鼠急性肝损伤模型研究紫苏叶各组分对肝损伤的保护效应,初步探讨可能的分子机制。研究结果表明,紫苏叶各组分均能不同程度地降低小鼠血清ALT、AST 活性和TBIL 水平,其中以紫苏叶水溶性总黄酮的效果最佳,能增加肝组织SOD 活性,降低MDA 水平,同时升高TGF-β1 水平,并抑制促炎性因子TNF-α、IL-6 和IL-1β 的释放。进一步研究发现,水溶性总黄酮还可以降低急性肝损伤小鼠肝组织NLRP3、caspase-1、IL-1βmRNA 表达。结果提示紫苏叶水溶性总黄酮可能通过抑制NLRP3/caspase-1 信号活化,减少炎性因子的释放,从而减轻CCl4急性肝组织炎性损伤,达到保肝的作用。
综上所述,紫苏叶中水溶性总黄酮是紫苏叶发挥保肝降酶作用的关键组分,抑制NLRP3/caspase-1 炎性小体信号通路可能是其抗CCl4急性肝损伤的作用机制之一。
