基于质量标志物-有效对照提取物模式的黑骨藤质量评价
2024-01-29安兰兰周环娟王瑞鑫刘育辰孙庆文张永萍
刘 刚,安兰兰,周环娟,付 艳,王瑞鑫,刘育辰,孙庆文,张永萍
(贵州中医药大学,贵州 贵阳 550025)
中药质量是中药有效性和安全性的反映和表征[1],目前中药质量标准多是通过使用对照品测定一种或多种成分的含量评价中药质量,而部分对照品不易获得,检测成本高,且与传统功效的关联性不强,难以反映中药质量与疗效的关系[2-4]。鉴于此,国内学者相继提出了“对照提取物”[5]、“ 中药质量标志物 ( quality markers,Qmarkers)”[6]中药质量评价方法,为中药质量控制研究带来了新思路,已被应用于多种中药的质量评价[7-9]。对照提取物法可同时测定样品(包括药材、中成药和提取物等)中的多个指标性成分,且可大大降低检验成本,但其指标与功效关联性不强,因此,在确认其Q-Marker 的基础上,以Q-Marker 作为指标性成分更为科学,这种对照提取物称为“有效对照提取物”。
黑骨藤为萝藦科植物黑龙骨PeriplocaforrestiiSchltr.的干燥全株[10],其乙醇提取物乙酸乙酯部位为其抗类风湿性关节炎(rheumatoid arthritis,RA)的有效部位[11],本研究采用药理学与化学相结合的方法,以黑骨藤为研究对象,制备其抗RA 的有效对照提取物,明确其Q-Marker,建立基于有效对照提取物-中药质量标志物模式的黑骨藤质量评价体系,尝试构建能体现中医药特色且与临床疗效相关联的中药质量评价新模式,为进一步完善中药质量评价体系提供新思路。
1 材料
1.1 仪器 Agilent 1290 InfinityⅡ超高效液相色谱仪,配置二元梯度泵、高能自动进样器、DAD 检测器和色谱工作站(美国Agilent 公司); FA2204B 型电子天平(万分之一,上海天美天平仪器有限公司); MS205DU 型电子天平[十万分之一,梅特勒-托利多仪器(中国)有限公司]; DZ-2BCIV 型真空干燥箱 (天津市泰斯特仪器有限公司);TD5A-WS 型离心机 (湖南湘立科学仪器有限公司);JE1002 型电子天平(上海浦春计量仪器有限公司); MNT-150 型数显卡尺 (浙江德清信泰电子科技有限公司);Rayto RT-6100 酶标分析仪(深圳雷杜生命科学股份有限公司); CX22 光学显微镜(日本Olympus 公司); RM2235 石蜡切片机、DM1000 徕卡显微成像系统(德国Leica 公司)。
1.2 试剂与药物 黑骨藤经贵州中医药大学药学院刘育辰教授鉴定为萝藦科杠柳属植物黑龙骨PeriplocaforrestiiSchltr.,具体见表1。雷公藤多苷片(批号1450003,贵州汉方药业有限公司)。新绿原酸(批号CHB190217)、绿原酸 (批号 BD33230、CHB190121)、隐绿原酸 (批号CHB180905)、绿原酸甲酯(批号CHB190117)、异绿原酸B (批号CHB180923)、异绿原酸A (批号CHB180921)、异绿原酸C (批号CHB180925)均购于成都克洛玛生物科技有限公司,纯度均大于98%。PRP-512B 型树脂(北京聚福树脂厂); 牛Ⅱ型胶原溶液(批号200297)、弗氏完全佐剂(批号200200)、弗氏不完全佐剂(批号200336)均购于美国Chondrex 公司。EDTA 脱钙液(型号B0317-11,四川杨克斯特科技有限公司); 7122 苏木素、伊红(美国Thenrmo Fisher Scientific 公司)。乙腈 (色谱纯,美国TEDIA 公司); 其余试剂均为分析纯; 水为纯净水(杭州娃哈哈集团有限公司)。SPF 级SD 大鼠,体质量(200±20 g),购于湖南省长沙市天勤生物技术有限公司,实验动物生产许可证号SCXK (湘)2019-0014,实验动物使用许可证号SYXK (黔)2021-0005,于室温下适应性饲养7 d。实验经贵州中医药大学实验动物伦理委员会批准(审批号20210161)。

表1 样品信息
2 方法与结果
2.1 对照提取物制备 取黑骨藤粗粉适量置于圆底烧瓶中,加入25 倍量70%乙醇,加热回流提取3 次,每次1 h,合并提取液,减压浓缩至无醇味,加水混悬,依次用等量石油醚、三氯甲烷、乙酸乙酯萃取,各3 次,合并乙酸乙酯萃取液,减压浓缩,真空干燥,即得乙酸乙酯萃取部位。
精密称取黑骨藤乙酸乙酯萃取部位10 g,加等量PRP-512B 型树脂拌样,装柱。依次用20%、30%、50% 甲醇梯度洗脱,每个梯度4 000 mL。其中,20% 甲醇洗脱段前1 000 mL 合并为第1 段(a1),中间2 500 mL 合并为第2 段(a2),后500 mL 为第3 段(a3),30%、50% 甲醇洗脱段各自合并,分别为a4、a5。精密称取a5 段2 g,用等量PRP-512B 型树脂拌样,装柱,依次用20%、30%、50% 甲醇梯度洗脱,各自合并为b1 段、b2 段、b3 段。将以上a2段和b3 段按一定比例合并,即得黑骨藤对照提取物。
2.2 对照提取物抗类风湿性关节炎有效性验证
2.2.1 造模、分组和给药 56 只大鼠随机选取8 只作为空白对照组,其余48 只参考文献[12]方法建立CIA 药理模型,并随机分成6 组,分别为雷公藤多苷(TG)对照组(10 mg/kg)、模型组、对照提取物给药低剂量组(36 mg/kg)、对照提取物给药高剂量组(144 mg/kg)、对照品(按对照提取物中各成分所占比例混合配制)给药低剂量组、对照品给药高剂量组,每组8 只。各药物用生理盐水溶液分散,空白对照组和模型组给予生理盐水溶液,给药体积均为10 mL/kg,灌胃28 d,每天1 次。
2.2.2 一般指标检测 从造模前1 d 及造模成功后第7 天开始,每7 d 测量各组大鼠右足趾、左足趾厚度,两者厚度差值作为肿胀度,并记录体质量变化。
2.2.3 关节炎指数(arthritis index,AI)评分 从造模成功后的第7 天开始,每天观察并详细记录各组大鼠全身的关节病变程度,按照5 级评分法评价[13],将4 个关节的积分进行累计,即为每只大鼠的AI。
2.2.4 血清因子测定、滑膜病理变化观察 大鼠给药第28天后禁食12 h 以上,不禁水,用麻醉剂麻醉,腹主动脉取血,迅速将血液于冰浴上静置30 min,置于离心机中离心20 min (转速4 000 r/min),取上清液,置于-80 ℃冰箱中备用。根据ELISA 试剂盒说明书操作,大鼠取血后麻醉脱颈处死,去除左后足踝关节皮毛,用动物骨剪取下踝关节,置于4%多聚甲醛中性固定液中固定,常规脱钙后包埋组织块于石蜡中,切成5 μm 薄片,脱蜡后伊红染色,显微镜下观察组织病理学变化。
2.2.5 统计学分析 采用SPSS 24.0、Graphpad Prism 8.0.2 软件进行分析及作图,数据以(±s)表示,再进行单因素方差分析,方差齐时组间两两比较采用LSD 检验,方差不齐时组间两两比较采用Tamhance’s T2 检验。以P<0.05 为差异具有统计学意义。
2.2.6 药理实验结果
2.2.6.1 黑骨藤对照提取物对CIA 大鼠的影响 (1)对CIA 大鼠后足足趾厚度的影响。给药前,与模型组比较,各给药组对后足足趾厚度的影响无显著性差异(P>0.05),空白对照组有极显著差异(P<0.01),给药第28 天后仍有极显著性差异(P<0.01),说明造模成功,模型相对稳定;给药第28 天后,与模型组比较,TG 组、对照提取物给药低剂量组、对照提取物给药高剂量组对右后足足趾厚度的影响均有极显著性差异(P<0.01); 同样给药第28 天后,与模型组比较,TG 组、对照提取物给药低剂量组、对照提取物给药高剂量组对左后足足趾厚度的影响也均有极显著性差异(P<0.01)。
(2)对CIA 大鼠AI 值的影响。给药前,与模型组比较,各给药组无显著性差异(P>0.05); 给药第28 天后,与模型组比较,对照提取物给药低剂量组、高剂量组和TG组均有极显著性差异(P<0.01); 模型组第0~28 天无显著性差异(P>0.05); 对照提取物给药高剂量组在给药第13天之后有极显著差异(P<0.01),TG 组与对照提取物给药低剂量组在给药第20 天后有极显著性差异(P<0.01)。
(3)对CIA 大鼠血清促炎细胞因子表达的影响。与模型组比较,对照提取物给药低剂量组大鼠血清中TNF-α 水平降低(P<0.01),对照提取物给药高剂量组大鼠血清中TNF-α 水平降低(P<0.05),TG 组大鼠血清中TNF-α 水平降低(P<0.05); 与空白对照组比较,模型组大鼠血清中TNF-α 水平升高(P<0.01),TG 组TNF-α 水平升高(P<0.05)。
2.2.6.2 对照品对CIA 大鼠的影响
(1)对照品对CIA 大鼠后足足趾厚度的影响。给药前,与模型组比较,各药物组无统计学意义(P>0.05),空白对照组有极显著差异(P<0.01),给药28 d 后仍有极显著性差异(P<0.01),说明造模成功,模型相对稳定; 给药28 d 后,与模型组比较,对照品低、高剂量组和TG 组对右后足足趾厚度的影响均具有统计学意义(P<0.01); 同样给药第28 天后,与模型组比较,TG 组、对照品低剂量组、高剂量组对左后足足趾厚度的影响也均有统计学意义(P<0.01)。
(2)对照品对CIA 大鼠AI 值的影响。给药前,与模型组比较,各药物组无明显差异(P>0.05); 给药第28 天后,与模型组比较,对照品低剂量组、高剂量组和TG 组有统计学意义(P<0.01)。
(3)对照品对CIA 大鼠血清促炎细胞因子表达的影响。与模型组比较,对照品低剂量组大鼠血清中TNF-α 水平降低(P<0.05),对照品高剂量组大鼠血清中IL-6、IL-1β、TNF-α 水平降低(P<0.01); 与TG 组比较,对照品高剂量组大鼠血清中IL-6、IL-1β、TNF-α 水平降低(P<0.01);与对照品低剂量比较,对照品高剂量组大鼠血清中IL-6、IL-1β、TNF-α 水平降低(P<0.01); 与空白对照组比较,模型组大鼠血清中TNF-α 水平升高(P<0.01),TG 组和对照品低剂量组大鼠血清中TNF-α 水平升高(P<0.05)。
2.3 对照提取物成分含量测定 采用UPLC 法。
2.3.1 色谱条件 ZORBAX Eclipse plus C18色谱柱(2.1 mm×100 mm,1.8 μm); 流动相0.1% 甲酸(A)-乙腈(B),梯度洗脱 (0 ~3.4 min,7% ~9% B; 3.4 ~5.4 min,9% ~11% B; 5.4 ~7 min,11% ~13% B; 7 ~8.3 min,13% ~13.5% B; 8.3 ~10 min,13.5% ~15% B; 10 ~14.5 min,15% ~15.1% B; 14.5~15 min,15.1% ~16% B;15~17 min,16% ~18% B; 17~21 min,18% ~21% B; 21~23 min,21% ~26% B; 23 ~25 min,26% ~100% B); 体积流量0.2 mL/min; 柱温30 ℃; 检测波长327 nm; 进样量2 μL。色谱图见图1。

图1 对照品(A)、黑骨藤对照提取物(B)UPLC 色谱图
2.3.2 对照品溶液制备 分别精密称取对照品新绿原酸5.06 mg、绿原酸25.05 mg、隐绿原酸8.04 mg、绿原酸甲酯5.05 mg,异绿原酸B 5.02 mg,异绿原酸A 5.00 mg,异绿原酸C 7.05 mg,置于50 mL 量瓶中,50%甲醇溶解并稀释至刻度,得对照品溶液①,摇匀,精密吸取1 mL,置于100 mL 量瓶中,50%甲醇稀释至刻度,摇匀,得对照品溶液②。
2.3.3 供试品溶液制备 精密称取黑骨藤对照提取物14 mg,置于10 mL 量瓶中,加50% 甲醇2 mL,超声处理1 min,冷却至室温,50%甲醇稀释至刻度,摇匀,0.22 μm微孔滤膜过滤,取续滤液,即得。
2.3.4 方法学考察
2.3.4.1 线性关系考察 精密吸取不同体积对照品溶液适量,在“2.3.1” 项色谱条件下进样测定。以对照品进样量为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表2,可知各成分在各自范围内线性关系良好。

表2 各成分线性关系(Ⅰ)
2.3.4.2 精密度试验 对照品溶液①在“2.3.1” 项色谱条件下进样测定6 次,测得新绿原酸、绿原酸、隐绿原酸、绿原酸甲酯、异绿原酸B、异绿原酸A、异绿原酸C 峰面积RSD 分别为 0.07%、0.10%、0.08%、0.09%、0.11%、0.15%、0.15%,表明仪器精密度良好。
2.3.4.3 重复性试验 精密称取对照提取物6 份,按“2.3.3” 项下方法制备供试品溶液,在“2.3.1” 项色谱条件下进样测定,测得新绿原酸、绿原酸、隐绿原酸、绿原酸甲酯、异绿原酸B、异绿原酸A、异绿原酸C 含量RSD分别为1.09%、0.34%、0.51%、1.22%、1.10%、1.21%、2.13%,表明该方法重复性良好。
2.3.4.4 稳定性试验 按“2.3.3” 项下方法制备供试品溶液1 份,于0、2、4、8、12、20、24 h 在“2.3.1” 项色谱条件下进样测定,测得新绿原酸、绿原酸、隐绿原酸、绿原酸甲酯、异绿原酸B、异绿原酸A、异绿原酸C 峰面积RSD 分别为 0.35%、0.14%、0.39%、0.28%、2.26%、0.34%、0.20%,表明溶液在24 h 内稳定性良好。
2.3.4.5 加样回收率试验 精密称定各成分含量已知的对照提取物6 份,每份7 mg,按100%水平加入对照品溶液,按“2.3.3” 项下方法制备供试品溶液,在“2.3.1” 项色谱条件下进样测定,计算回收率。结果,新绿原酸、绿原酸、隐绿原酸、绿原酸甲酯、异绿原酸B、异绿原酸A、异绿原酸C 平均加样回收率 (RSD)分别为102.51%(0.68%)、100.85% (1.27%)、99.05% (1.45%)、97.84%( 2.37%)、100.33% ( 1.55%)、99.49%( 1.53%)、97.70% (1.32%)。
2.3.5 样品含量测定 取3 批对照提取物,按“2.3.3”项下方法制备供试品溶液,在“2.3.1” 项色谱条件下进样测定,计算含量。结果,新绿原酸、绿原酸、隐绿原酸、绿原酸甲酯、异绿原酸B、异绿原酸A、异绿原酸C 含量总和分别为51.81%、53.30%、52.46%,表明该方法重复性良好,可用于制备对照提取物。
2.4 对照提取物在黑骨藤质量控制中的应用
2.4.1 对照提取物溶液制备 精密称取黑骨藤对照提取物40.03 mg,置于5 mL 量瓶中,加50%甲醇2 mL,超声处理1 min,放冷至室温,50% 甲醇定容至刻度,摇匀,溶解,制成新绿原酸、绿原酸、隐绿原酸、绿原酸甲酯、异绿原酸B、异绿原酸A、异绿原酸C 质量浓度分别为0.205 0、2.958 8、0.763 3、0.455 2、0.016 8、0.031 3、0.059 2 mg/mL 的溶液A,再分别稀释10、100、250 倍,作为溶液B、C、D。
2.4.2 供试品溶液制备 精密称取药材粉末16.0 g,按“2.1” 项下方法制备醇提物乙酸乙酯萃取部位(HGT-C),精密称取25 mg,置于10 mL 量瓶中,2 mL 甲醇溶解并定容,0.22 μm 微孔滤膜过滤,取续滤液,即得。
2.4.3 色谱条件 同“2.3.1” 项,色谱图见图2。
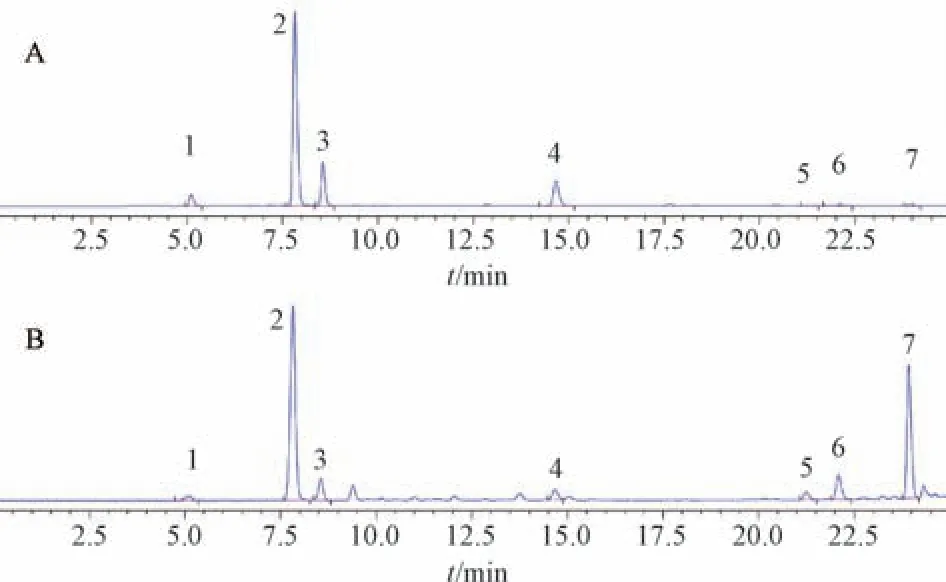
图2 对照提取物(A)、黑骨藤(B)UPLC 色谱图
2.4.4 方法学考察
2.4.4.1 线性关系考察 精密吸取“2.4.1” 项下对照提取物溶液适量,在“2.4.3” 项色谱条件下进样测定。以对照品进样量为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表3,可知各成分在各自范围内线性关系良好。
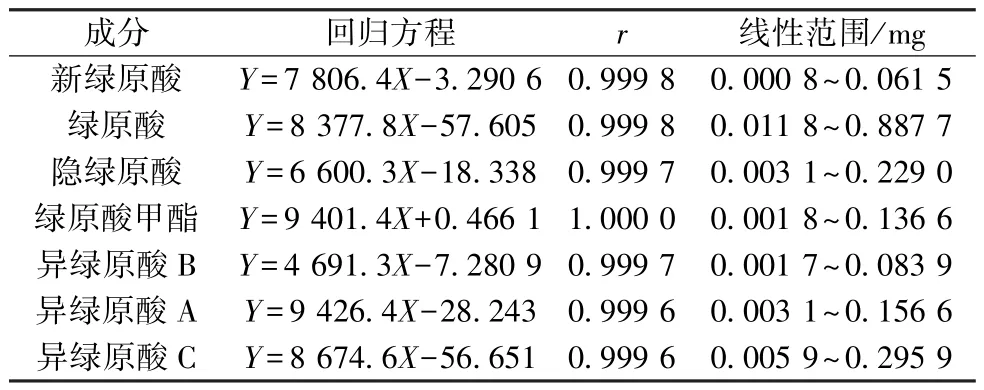
表3 各成分线性关系(Ⅱ)
2.4.4.2 方法学考察 表4 显示,该方法仪器精密度、方法重复性、稳定性、准确性均良好,可用于含量测定。

表4 方法学考察结果
2.4.5 样品含量测定 取12 批药材,按“2.4.2” 项下方法制备供试品溶液,在“2.4.3” 项色谱条件下进样测定,分别采用对照提取物法、单体对照品法计算含量,结果见表5。

表5 各成分含量测定结果(mg/g)
3 讨论
3.1 药理实验研究 通过药理学实验验证,发现黑骨藤对照提取物和含有7 种咖啡酰基奎宁酸类成分的对照品可有效缓解足趾肿胀,减小关节炎评分,并且有效减少了CIA大鼠血清中的促炎细胞因子水平,尤其是TNF-α,表明黑骨藤乙酸乙酯部位所含的咖啡酰基奎宁酸类成分具有良好的抗RA 活性。
3.2 黑骨藤抗RA 质量标志物辨识 RA 是一种自身免疫性疾病,它导致滑膜组织和关节慢性炎症,导致关节功能障碍,最终导致残疾[14]。CIA 模型与人RA 具有共同的免疫学和病理学特征,因此常用于新药或其他治疗药物的初步药理学研究[15]。体内外实验结果显示[16-21],黑骨藤中咖啡酰基奎宁酸类成分具有较好的抗类风湿性关节炎活性。本研究通过药理学实验证实对照提取物组和咖啡酰基奎宁酸类成分对照品,都具有一定的抗RA 作用,进一步验证了黑骨藤中的7 个咖啡酰基奎宁酸类成分是其抗RA 的药效物质基础。黑骨藤有效对照提取物中7 种咖啡酰基奎宁酸类成分是黑骨藤中固有的化学成分,具有明确的化学结构式,药理实验验证其与黑骨藤抗RA 功效密切相关,同时可进行定量测定,均满足Q-marker 的基本条件。因此,上述7 种咖啡酰基奎宁酸类成分可作为黑骨藤抗RA 的Qmarker。
3.3 含量测定色谱条件筛选 通过DAD 检测器对7 种成分的单一对照品溶液进行全波长扫描,以327 nm 为最大吸收波长。并对流动相、柱温、进样量及体积流量进行考察。结果表明,流动相为乙腈-0.1%甲酸时色谱峰峰形最好,分离效果最佳; 柱温为30 ℃时色谱峰分离度最好; 进样量为1、3 μL 时色谱峰出现拖尾现象,2 μL 时色谱峰峰形最佳;体积流量为0.2 mL/min 时分离效果好,并且可节约试剂。3.4 有效对照提取物法验证 本研究分别采用了对照提取物法和对照品法对黑骨藤中绿原酸等7 种咖啡酰基奎宁酸类成分进行了含量测定分析,结果显示2 种方法所得结果基本一致,说明对照提取物法可以用于黑骨藤的质量控制,检测成本更低,方法更简单,更符合中药多成分的特色[22],同时也解决了此类成分不稳定、难以制备的难题。上述结果为明确黑骨藤抗RA 的药效物质基础和建立全面科学的相关质量评价体系提供了理论基础。
