岩白菜素纳米结构脂质载体制备及其体内药动学研究
2024-01-29张艳慧马春芬
丁 玉,张艳慧,辛 娟,崔 琳,马春芬
(1.黄河科技学院,河南 郑州 450006; 2.河南中医药大学第一附属医院,河南 郑州 450046; 3.河南省中医院,河南 郑州 450002)
岩白菜素主要存在于落新妇、岩白菜等虎耳草科植物中,具有抗肿瘤、抗糖尿病、镇痛、消炎、抗HIV、镇咳等作用[1-2],可通过STAT3 信号通路等机制来对宫颈癌细胞产生明显的抑制活性,并且基本无不良反应[2-3],具有开发成妇科新药的潜力[4],但该成分在25、75 ℃水中的溶解度分别仅为1.24、7.18 mg/mL,肠道中稳定性差[5-6],口服生物利用度仅为4.83%[7],不利于药效发挥和临床应用。目前,已有固体分散体[8]、磷脂复合物[6]、自微乳[9]等岩白菜素新型制剂的报道,但固体分散体和磷脂复合物不能有效改善该成分肠道稳定性问题,而自微乳需用到大量表面活性剂,具有安全隐患。
纳米结构脂质载体采用固态、液态脂质共同作为载体,增加了载药能力,具有较高的包封率和载药量,可有效改善中药活性成分的溶解性,同时载体的包裹作用可增加药物稳定性,为其生物利用度的提高奠定基础[10-14]。本实验制备岩白菜素纳米结构脂质载体,并考察其体内药动学,以期为该制剂后续开发利用提供参考。
1 材料
Agilent 1200 型高效液相色谱仪(美国Agilent公司); ZRS-6ST 型智能溶出仪(上海新诺仪器集团有限公司); HN10-260B 型超声仪(上海汗诺仪器有限公司); FA2004B 型电子天平(上海精科科学仪器有限公司); HTH-BX-115L 型超低温冰箱(东莞市汇泰机械有限公司); 99-3 型磁力搅拌器(苏州威尔实验用品有限公司); SNLG-10N 型真空冻干机(天津市顺诺仪器科技有限公司); MS2000型粒度分析仪(珠海欧美克仪器有限公司)。
岩白菜素原料药 (批号20201011,纯度98.0%,四川滇虹药业有限公司); 岩白菜素对照品(批号200905,纯度98.9%,成都克洛玛生物科技有限公司); 对乙酰氨基酚对照品 (批号200516,纯度99.1%,上海伊卡生物技术有限公司)。山嵛酸甘油酯(批号WHDJ57R)、泊洛沙姆188 (批号WPEE587E)(德国巴斯夫公司); 磷酸(批号C12747030,麦克林生化科技有限公司):PC98 型磷脂 (批号20200812)、油酸 (批号20200517)[辅必成(上海)医药科技有限公司]。模拟胃液(含胃蛋白酶,批号201216)、模拟肠液(含胰蛋白酶,批号201105)(东莞恒信生物科技有限公司)。
SD 雌性大鼠,体质量220 ~240 g,购自河南省实验动物中心,动物生产许可证号SCXK (豫)2020-0001。
2 方法与结果
2.1 纳米结构脂质载体制备 前期研究发现,岩白菜素在75 ℃下保存0.5 h 后含量基本不变,表明在该条件下稳定性良好,故本实验采用熔融法[15]制备纳米结构脂质载体。取岩白菜素原料药30 mg 至圆底烧瓶中,加入固态脂质(含80 mg 磷脂)、液态脂质,75 ℃水浴加热熔融,600 r/min磁力搅拌得到澄清熔融液,取表面活性剂适量,加到50 mL 蒸馏水中,加热至75 ℃,将水相缓慢加到熔融液中,1 000 r/min 磁力搅拌10 min,在200 W下超声(每工作2 s 间隔2 s)处理15 min,补加蒸馏水至50 mL,置于-10 ℃冰箱中20 min 固化,过0.45 μm 微孔滤膜,即得。
2.2 岩白菜素含量测定 采用HPLC 法。
2.2.1 色谱条件 Diamonsil C18色谱柱(150 mm×4.6 mm,5 μm); 流动相甲醇-水(45 ∶55,稀磷酸调节pH 至2.5); 体积流量1.0 mL/min; 柱温30 ℃; 检测波长275 nm; 进样量10 μL。
2.2.2 供试品溶液制备 取1 mL 纳米结构脂质载体至50 mL 量瓶中,加二氯甲烷超声处理5 min 破坏,流动相定容,精密移取5 mL 至10 mL 量瓶中,流动相稀释定容,即得。
2.2.3 线性关系考察 称取岩白菜素对照品10.80 mg,置于100 mL 量瓶中,甲醇超声溶解后定容,得质量浓度为108 μg/mL 的贮备液,流动相依次稀释至10.8、5.4、1.08、0.216、0.043 2 μg/mL,在“2.2.1” 项色谱条件下进样测定。以对照品峰面积为纵坐标(Y),质量浓度为横坐标(X)进行回归,得方程为Y=26.187 0X-0.618 3(r=0.999 8),在0.043 2~10.80 μg/mL 范围内线性关系良好。
2.2.4 方法学考察 取纳米结构脂质载体混悬液适量,按“2.2.2” 项下方法平行制备6 份供试品溶液,在“2.2.1” 项色谱条件下进样测定,测得岩白菜素含量RSD 为1.73%,表明该方法重复性良好。取供试品溶液适量,于0、2、4、8、12、24 h 在“2.2.1” 项色谱条件下进样测定,测得岩白菜素含量RSD 为1.45%,表明溶液在24 h 内稳定性良好。取0.043 2、1.08、10.8 μg/mL 对照品溶液适量,在“2.2.1” 项色谱条件下各进样测定6 次,测得岩白菜素含量RSD 分别为0.66%、0.09%、0.22%,表明仪器精密度良好。取9 份供试品溶液,每份0.5 mL,置于50 mL 量瓶中,分为低、中、高3 组,分别加入“2.2.3” 项下贮备液1.5、3、4.5 mL,按“2.2.2” 项下方法制备供试品溶液,在“2.2.1” 项色谱条件下进样测定,测得平均加样回收率分别为101.76%、99.68%、100.46%,RSD 分别为0.68%、0.92%、0.45%。
2.3 粒径、Zeta 电位测定 取纳米结构脂质载体混悬液0.1 mL,加入4 mL 蒸馏水稀释,混匀后取适量测定Zeta 电位、粒径、PDI。
2.4 包封率、载药量测定 取1 mL 纳米结构脂质载体混悬液,置于超滤管中(截留分子量8 000 ~12 000 Da),0 ℃、12 500 r/min 离心30 min,取续滤液,在“2.2.1” 项色谱条件下进样测定游离药物含量m游离; 另取1 mL,按“2.2.2” 项下方法制备供试品溶液,在“2.2.1” 项色谱条件下进样测定岩白菜素总含量m总,计算包封率、载药量,公式分别为包封率= [(m总-m游离)/m总]×100%、载药量= [(m总-m游离)/W总]×100%,其中W总为药物、脂质总量。
2.5 处方优化 采用单因素试验。
2.5.1 固态脂质种类 固定岩白菜素投药量30 mg,液态脂质大豆油,固液脂质比3 ∶1,脂药比10 ∶1,泊洛沙姆188 浓度1.5%,考察固态脂质种类对包封率、载药量、粒径的影响,结果见表1。由此可知,山嵛酸甘油酯制得的纳米结构脂质载体包封率、载药量最高,虽然粒径大于单硬脂酸甘油酯制得的,但不明显,故选择山嵛酸甘油酯作为固态脂质。
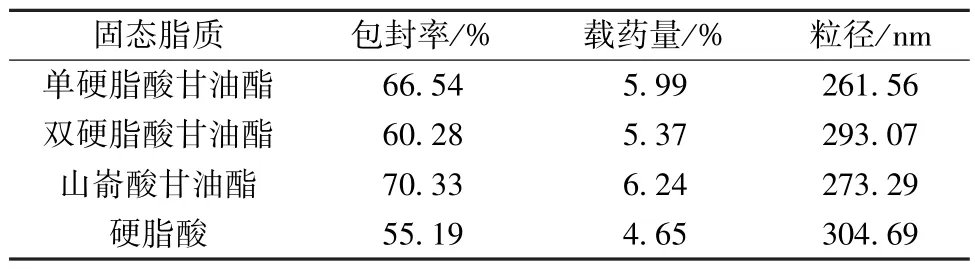
表1 固态脂质种类对包封率、载药量、粒径的影响(n=3)Tab.1 Effects of solid lipid type on encapsulation efficiency,drug loading and particle size (n=3)
2.5.2 液态脂质种类 固定岩白菜素投药量30 mg,固态脂质山嵛酸甘油酯,固液脂质比3 ∶1,脂药比10 ∶1,泊洛沙姆188 浓度1.5%,考察液态脂质种类对包封率、载药量、粒径的影响,结果见表2。由此可知,油酸制得的纳米结构脂质载体包封率、载药量最高,其次为油酸乙酯、蓖麻油制得的,大豆油制得的最低,可能与原料药在不同液态脂质中的溶解度差异有关[9],故选择油酸作为液态脂质。

表2 液态脂质种类对包封率、载药量、粒径的影响(n=3)Tab.2 Effects of liquid lipid type on encapsulation efficiency,drug loading and particle size (n=3)
2.5.3 固液脂质比 固定岩白菜素投药量30 mg,固态脂质山嵛酸甘油酯,液态脂质油酸,脂药比10 ∶1,泊洛沙姆188 浓度1.5%,考察固液脂质比对包封率、载药量、粒径的影响,结果见表3。由此可知,液态脂质比例过大时可能被挤出纳米载药体系[16],从而影响载药; 过小时可能使脂质载体形成晶体缺陷空间效果,也会影响载药能力[16-17],两者比例为4 ∶1 时包封率、载药量最高,粒径较小,故选择4 ∶1 作为固液脂质比。

表3 固液脂质比对包封率、载药量、粒径的影响(n=3)Tab.3 Effects of solid-liquid lipid ratio on encapsulation efficiency,drug loading and particle size (n=3)
2.5.4 脂药比 固定岩白菜素投药量30 mg,固态脂质山嵛酸甘油酯,液态脂质油酸,固液脂质比4 ∶1,泊洛沙姆188 浓度1.5%,考察固液脂质比对包封率、载药量、粒径的影响,结果见表4。由此可知,随着脂药比增加包封率逐渐升高,超过10 ∶1 后基本不变,但载药量逐渐降低,粒径逐渐增大,故选择10 ∶1 作为脂药比。经考察,30 mg岩白菜素可完全溶于温度75 ℃、用量300 mg 的脂质熔融液中(固液脂质比4 ∶1)。

表4 脂药比对包封率、载药量、粒径的影响(n=3)Tab.4 Effects of lipid-drug ratio on encapsulation efficiency,drug loading and particle size (n=3)
2.5.5 泊洛沙姆188 浓度 固定岩白菜素投药量30 mg,固态脂质山嵛酸甘油酯,液态脂质油酸,固液脂质比4 ∶1,脂药比10 ∶1,考察泊洛沙姆188 浓度对包封率、载药量、粒径的影响,结果见表5。由此可知,当泊洛沙姆188 浓度为1% ~2.5%时,包封率、载药量逐渐升高,粒径逐渐减小,为2.5%时前两者反而降低,后者增大,故选择2.0%作为泊洛沙姆188 浓度。

表5 泊洛沙姆188 浓度对包封率、载药量、粒径的影响(n=3)Tab.5 Effects of poloxamer 188 concentration on encapsulation efficiency,drug loading and particle size (n=3)
2.6 验证试验 根据“2.5” 项下结果,确定最优处方为岩白菜素投药量30 mg,固态脂质山嵛酸甘油酯,液态脂质油酸,固液脂质比4 ∶1,脂药比10 ∶1,泊洛沙姆188 浓度2.0%。按上述优化处方平行制备3 批样品,按“2.3” “2.4” 项下方法测得平均包封率为(84.16±1.57)%,载药量为(7.73±0.27)%,粒径为 (215.53±18.04)nm,PDI 为0.109±0.012,Zeta 电位为- (37.56±2.03)mV,其中粒径分布见图1,Zeta 电位见图2。
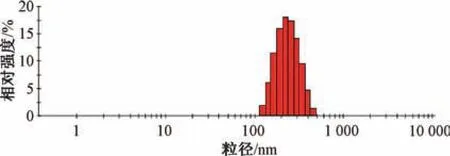
图1 岩白菜素纳米结构脂质载体粒径分布Fig.1 Particle size distribution of bergenin nanostructured lipid carriers

图2 岩白菜素纳米结构脂质载体Zeta 电位Fig.2 Zeta potential of bergenin nanostructured lipid carriers
2.7 冻干粉制备 取纳米结构脂质载体混悬液适量,加入冻干剂振荡混匀,在-25 ℃下冷冻2 d,取出,敞口置于-25 ℃冷冻干燥机中处理2 d,即得,按表6 标准进行评价[18],结果见表7,可知5%乳糖+甘露醇(1 ∶1)评分最高,故选择其作为冻干保护剂。复溶后,测得其平均包封率为(81.32±0.95)%,粒径为(242.94±25.76)nm,PDI 为0.147±0.021,Zeta 电位为- (33.40±1.89)mV。

表6 评分标准Tab.6 Scoring criteria
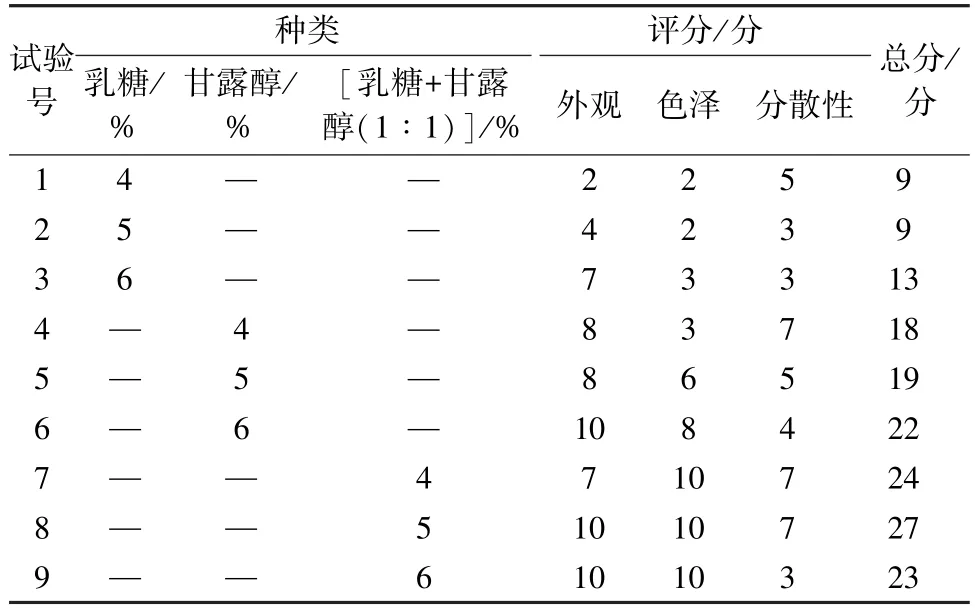
表7 评分结果(n=3)Tab.7 Results of scoring (n=3)
2.8 体外释药研究 取纳米结构脂质载体冻干粉适量(含10 mg 岩白菜素),加入3 mL 模拟胃液(含胃蛋白酶),置于透析袋中 (截留分子量12 000 Da),扎紧两端,设定释放介质为1 000 mL模拟胃液,温度为37 ℃,转速为75 r/min,取样点为0、10、30、1.5、60、90、120、180、240 min,取样量、补液量均为3 mL,过0.45 μm 微孔滤膜后测定释放度,结果见图3,同法考察在模拟肠液(含胰蛋白酶)中的释药情况,取样点为0、0.5、1、1.5、2、2.5、3、4、6、8、12、18、24、36 h,结果见图4。由此可知,原料药在模拟胃液中240 min 内累积释放度接近90%,而纳米结构脂质载体表现出明显缓释特点; 原料药在模拟肠液中前期释药也较快,但在2.5 h 后累积释放度明显降低,36 h 内为43.26%,而纳米结构脂质载体36 h内累积释放度也有所降低,但仍远高于原料药,达71.04%。
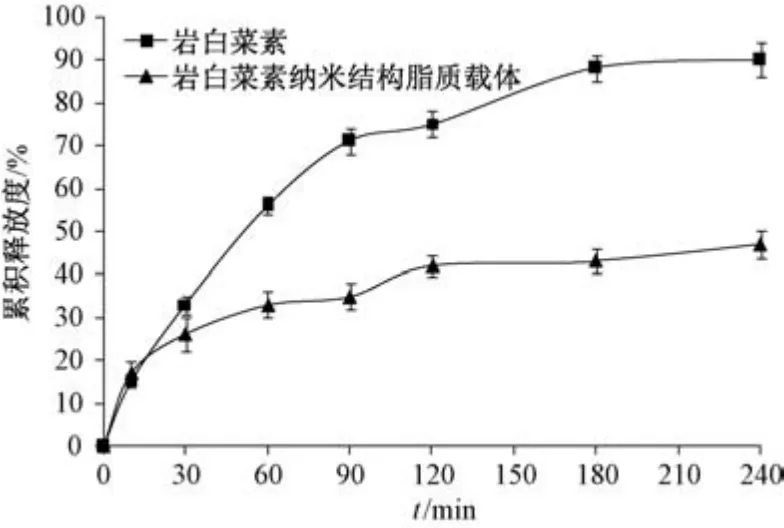
图3 模拟胃液中岩白菜素体外释药曲线(n=6)Fig.3 In vitro drug release curves for bergenin in simulated gastric fluid (n=6)

图4 模拟肠液中岩白菜素体外释药曲线(n=6)Fig.4 In vitro drug release curves for bergenin in simulated intestinal fluid (n=6)
2.9 稳定性考察 取岩白菜素及其纳米结构脂质载体冻干粉适量,置于50 mL 模拟肠液中,设定孵育温度为37 ℃,于0、2、4、6、8、10、12 h 各取样0.5 mL,过0.45 μm 微孔滤膜后测定岩白菜素含量,结果见图5。由此可知,岩白菜素在模拟肠液中易发生降解,12 h 后含量为53.76%; 纳米结构脂质载体中该成分降解缓慢,12 h 后含量仍在90%以上,表明其稳定性良好。
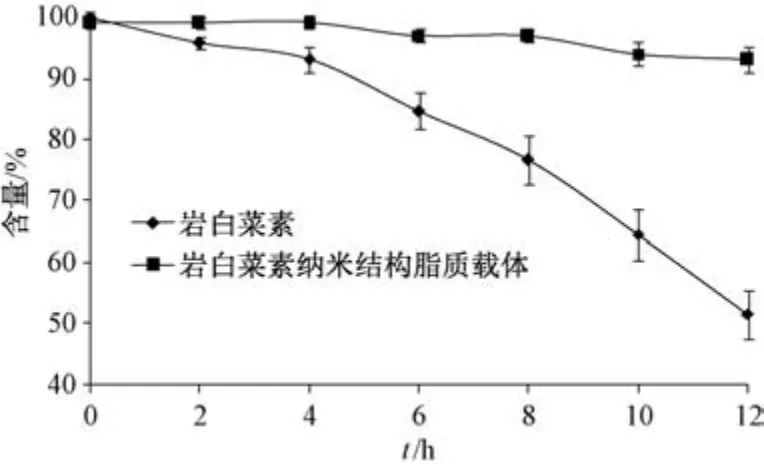
图5 不同时间点岩白菜素含量(n=6)Fig.5 Bergenin contents at different time points (n=6)
2.10 晶型分析(熔融脂质中)取岩白菜素、固液脂质(山嵛酸甘油酯∶油酸=4 ∶1,不含岩白菜素)、物理混合物(岩白菜素∶固液脂质=1 ∶10,仅作简单混合)、岩白菜素+熔融脂质冷凝后(岩白菜素∶固液脂质=1 ∶10)样品适量,进行X射线粉末衍射(XRPD)分析,设定扫描速度为5°/min,2θ为3°~45°,结果见图6。由此可知,原料药在6.9°、8.0°、11.7°、14.6°、18.2°等处晶型峰强度较强; 在物理混合物中仍可见原料药特征晶型峰; 原料药溶于熔融脂质冷凝后样品时其特征晶型峰均消失,即以无定形状态存在。
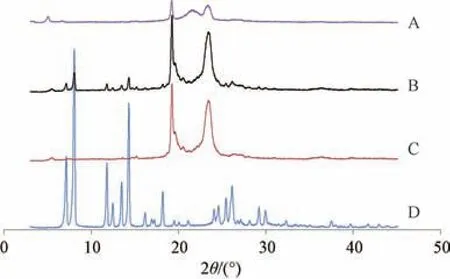
图6 岩白菜素在熔融脂质中的存在状态Fig.6 Existence states of bergenin in molten lipid
2.11 晶型分析(冻干粉中)取岩白菜素、空白辅料(比例同冻干粉,不含岩白菜素)、物理混合物(岩白菜素与辅料比例同冻干粉)、岩白菜素纳米结构脂质载体冻干粉适量,在“2.9” 项条件下进行XRPD 分析,结果见图7。由此可知,原料药特征晶型峰在物理混合物图谱中仍可观察到,但在纳米结构脂质载体冻干粉图谱中均消失,仅剩下空白辅料衍射峰,表明制成冻干粉后原料药仍以无定形状态存在于纳米结构脂质载体中。
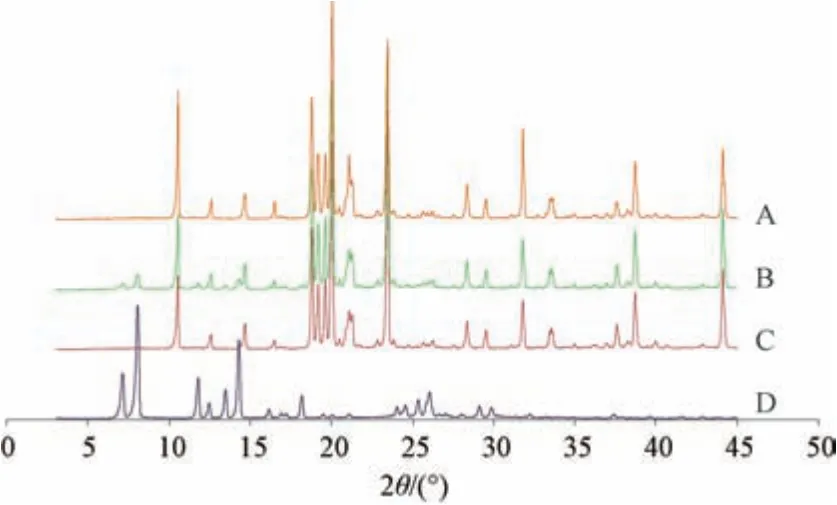
图7 岩白菜素在冻干粉中的存在状态Fig.7 Existence states of bergenin in freeze-dried powder
2.12 体内药动学研究
2.12.1 分组、给药及采血 取岩白菜素、物理混合物、岩白菜素纳米结构脂质载体冻干粉适量,加0.5%CMC-Na 溶液制成药液(岩白菜素质量浓度为8 mg/mL)。18 只大鼠随机分为3 组,称定质量后按60 mg/kg 剂量灌胃给药,于0.25、0.5、1、2、3、4、5、6、8、10、12 h 尾静脉取血各0.3 mL,置于肝素化离心管中,密封涡旋3 s,3 000 r/min 离心3 min,取上层血浆。
2.12.2 血浆样品处理 参考文献[7]报道,取对乙酰氨基酚对照品适量,甲醇制成2 000 ng/mL内标溶液。取100 μL 血浆样品至离心管中,加入20 μL 内标溶液,涡旋混合均匀,加0.5 mL 乙酸乙酯涡旋混合1 min,3 000 r/min 离心5 min,收集上清液,同法操作3 次,合并上清液,置于45 ℃水浴中氮气吹干,100 μL 甲醇复溶后3 000 r/min 离心5 min。
2.12.3 线性关系考察 取岩白菜素对照品适量,甲醇依次制成2 000、1 000、500、250、100、50 ng/mL 溶液,分别取100 μL,置于45 ℃水浴中氮气吹干,加入100 μL 空白血浆,涡旋30 s,作为血浆对照品溶液,按“2.12.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定。以对照品、内标峰面积比值为纵坐标(Y),对照品质量浓度为横坐标(X)进行回归,得方程为Y=1.961 7X+9.618 7 (r=0.995 4),在50~2 000 ng/mL 范围内线性关系良好。
2.12.4 方法学考察 取血浆样品适量,室温(温度25 ℃,相对湿度55%)下于0、2、4、8、12、24 h 在“2.2.1” 项色谱条件下进样测定,测得岩白菜素含量RSD 为9.22%,表明样品在24 h内稳定性良好。取50、1 000、2 000 ng/mL 血浆对照品溶液适量,同一天内在“2.2.1” 项色谱条件下各进样测定6 次,测得岩白菜素含量RSD 分别为10.51%、6.38%、5.44%,表明该方法日内精密度良好; 同法连续测定6 d,每天1 次,测得岩白菜素含量RSD 分别为8.15%、6.47%、3.98%,表明该方法日间精密度良好。空白血浆制成50、1 000、2 000 ng/mL 血浆样品,按“2.12.2” 项下处理,在“2.2.1” 项色谱条件下进样测定,测得平均加样回收率分别为93.89%、96.17%、91.96%,RSD 分别为5.49%、3.14%、4.56%。
2.12.5 结果分析 血药浓度-时间曲线见图8,再采用DAS2.0 软件计算主要药动学参数,结果见表8。由此可知,与原料药比较,物理混合物tmax、t1/2、Cmax、AUC0~t、AUC0~∞无明显变化 (P>0.05),表明辅料对原料药吸收的影响很小; 与原料药、物理混合物比较,纳米结构脂质载体tmax、t1/2延长(P<0.01),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度与原料药相比增加至6.08 倍。
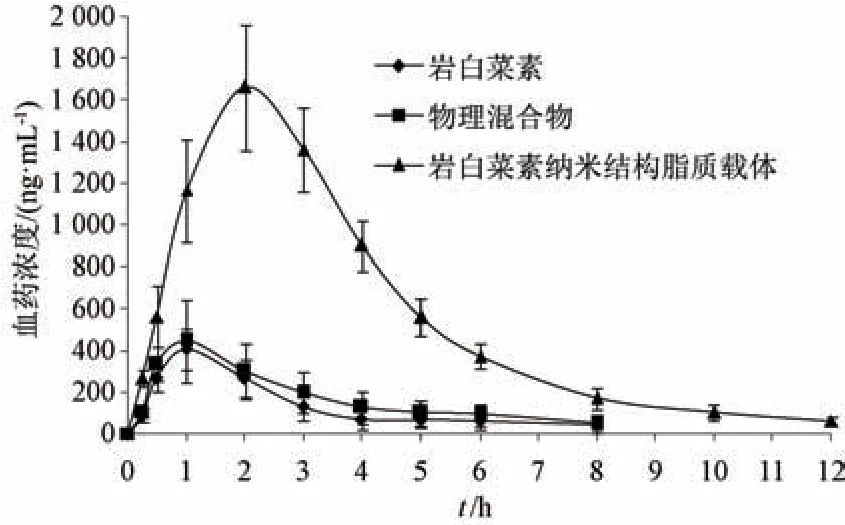
图8 岩白菜素血药浓度-时间曲线(n=6)Fig.8 Plasma concentration-time curves for bergenin (n=6)
表8 岩白菜素主要药动学参数(±s,n=6)Tab.8 Main pharmacokinetic parameters for bergenin (±s,n=6)
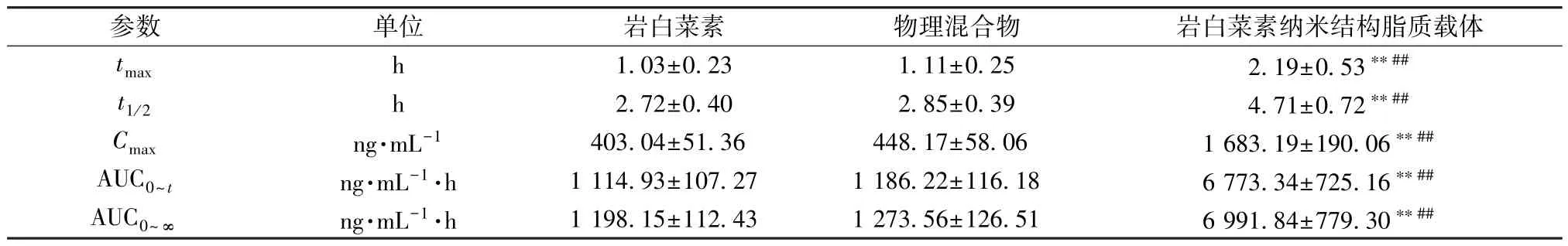
表8 岩白菜素主要药动学参数(±s,n=6)Tab.8 Main pharmacokinetic parameters for bergenin (±s,n=6)
注:与岩白菜素比较,**P<0.01; 与物理混合物比较,##P<0.01。
参数单位岩白菜素物理混合物岩白菜素纳米结构脂质载体tmaxh1.03±0.231.11±0.252.19±0.53**##t1/2h2.72±0.402.85±0.394.71±0.72**##Cmaxng·mL-1403.04±51.36448.17±58.061 683.19±190.06**##AUC0~tng·mL-1·h1 114.93±107.271 186.22±116.186 773.34±725.16**##AUC0~∞ng·mL-1·h1 198.15±112.431 273.56±126.516 991.84±779.30**##
3 讨论
冻干粉的保护机制主要有玻璃态假说和水替代假说[19],前者是指在冻干时由于水分逐渐减少,体系浓度增加,从而形成高黏度的玻璃态来阻止纳米结构发生变化,一般以糖类保护剂为代表,但制得的冻干粉容易出现塌陷现象; 后者是指在冻干过程中冻干剂分子结构中的OH-等基团可与纳米表面形成氢键[17,19],在脱水过程中与水分子进行交换,从而起到保护作用,一般以甘露醇为代表,并且支撑作用较好,可弥补糖类保护剂的不足。
模拟肠液体外释药研究结果显示,岩白菜素3 h后累积释放度呈下降趋势,可能是由于该成分在pH 较高时容易发生降解[5]; 虽然纳米结构脂质载体36 h 内累积释放度也出现类似情况,但程度明显低于原料药,表明它对包裹的后者起到了一定的保护作用。体内药动学研究结果显示,岩白菜素纳米结构脂质载体tmax延长,可能是由于载体对原料药的包裹而延缓了其释放[13],影响了其吸收速度;Cmax升高,表明纳米结构脂质载体有效促进了药物吸收,增加了进入血液循环的量; 相对生物利用度增加,其原因[10-11,13]可能是①较小的粒径增加了与胃肠道的接触面积,有利于药物吸收; ②降低了原料药在肠道中的降解几率,增加了稳定性,使其进入体循环的量增加;③提高了原料药累积释放度,解决了吸收瓶颈[7]; ④处方中的辅料(如磷脂、泊洛沙姆188等)本身具有促进药物吸收的作用[20]。今后,将对岩白菜素纳米结构脂质载体药效学等方面进行深入研究,以期为其进一步开发利用提供更全面的资料。
