电刺激C2C12细胞构建运动损伤修复模型
2024-01-28郑娅雯袁梦刘秀娟张欣
郑娅雯 袁梦 刘秀娟 张欣
(1.南京体育学院研究生部;2.南京体育学院运动健康学院 江苏南京 210014)
电脉冲刺激(Electrical Pulse Stimulation,EPS)应用于细胞系和培养的原代骨骼肌细胞的骨骼肌肌管已被证明是研究收缩诱导运动性适应的主要工具[1],其中C2C12细胞是体外研究骨骼肌内部机制的常用细胞模型[2],可以表达各种成熟骨骼肌中存在的标志蛋白,因此为体外研究成肌细胞增殖和分化的首选模型[3]。用电脉冲刺激模拟神经元刺激激活体外培养的骨骼肌细胞,从而促进骨骼肌细胞收缩达到模拟运动的效果。已有研究表明,人体肌管的体外EPS(急性、高频和慢性、低频)可用于研究运动的效果,目前有关的电脉冲刺激骨骼肌细胞构建生物实验模型的实验逐渐增多,电刺激方案中可变换的维度较多,故产生了模拟各类运动类型的电刺激骨骼肌细胞模型,例如:急性或慢性抗阻运动模型、耐力运动模型[4]、向心运动模型等,其依据是许多研究发现EPS能够诱发骨骼肌细胞相关基因表达和代谢特征的变化[5],在骨骼肌内,各类运动类型变化包括基因(例如GLUT4表达增加)、代谢(例如葡萄糖摄取增加)和形态学变化(例如肥大)。因此,体外运动实验模型必须证明在该模型中观察到转录、信号传导或代谢变化等方面的运动效应,才可以做出实验模型的刺激强度可以类比锻炼程度的结论。例如选用IL-6(白细胞介素6)、P38 丝裂原活化蛋白激酶(P38)作为骨骼肌细胞收缩指标[6-7]。此外,在小鼠在体实验中肌酸激酶(CK)、乳酸脱氢酶(LDH)可作为骨骼肌损伤指标[8],而将CK和LDH作为骨骼肌损伤指标的细胞实验鲜有,以此为创新点之一。选用CK、LDH 作为骨骼肌损伤指标,探究可行的电脉冲刺激方案,本研究着重探究不同电压(10 V、23 V、40 V)刺激条件下的EPS对C2C12 细胞收缩与损伤的影响,试图建立由EPS 诱发的C2C12细胞离心运动损伤模型。
1 材料与方法
1.1 实验试剂与器材
细胞培养基(gibco:DMEM培养基)、青霉素链霉素溶液(biosharp)、胰蛋白酶(gibco)、胎牛血清、马血清、PBS(中乔新舟)、鼠尾胶原蛋白Ⅰ型(欣友生物技术有限公司)、六孔细胞培养板(costar)、培养瓶(CORNING)、肌酸激酶(CK)测定试剂盒(南京建成)、乳酸脱氢酶(LDH)测定试剂盒(货号A020-2)、RIPA 裂解液(碧云天)、蛋白酶/磷酸酶抑制剂(碧云天)混合溶液、Loading Buffer(生工)、P38 一抗(巴傲得)、二抗(巴傲得)、离心管(15ml/50ml)、电刺激仪、细胞培养箱(调至37℃、5%CO2饱和湿度)、超净台、显微镜、离心机、细胞刮刀、0.5 mlEP 管、细胞计数器、电泳仪、转印机、发光机(Bio-Rad Laboratories)
1.2 细胞培养
在细胞培养前做好高压灭菌耗材以及试剂准备工作,之后进行细胞复苏、细胞换液、细胞传代,待细胞传代至实验所需细胞量,将细胞平均种于六孔板中,细胞计数后进行分化,分化经过5至8天,细胞分化为肌管,进行后续实验。
1.3 实验方法
1.3.1 电刺激
将电刺激仪分别调至10 V、23 V、40 V 的刺激强度,刺激时间40 min,频率1 Hz、20 ms,随后将电刺激板插入六孔板,确保电极接触细胞培养基,将六孔板连带电刺激板放入细胞培养箱,之后开始电刺激。
1.3.2 形态学观察
每天在显微镜40倍物镜下观察分化期间的C2C12细胞形态学变化。经过观察发现,随着分化时间的延长,细胞间距逐渐缩小,形态逐渐拉长形成肌管,彼此之间纵横交错,相互融合。
1.3.3 Western Blot检测P38蛋白变化
将六孔板中的蛋白经过PBS 冲洗后刮下收于EP管中,加入适量细胞裂解液,经过裂解、吸取上清、蛋白定量和蛋白变性后,用于WB检测,最后使用Image Lab分析软件对其进行定量分析
1.3.4 比色法检测CK活力
吸取细胞培养液测量CK 活力。依照肌酸激酶(CK)测定试剂盒说明书进行,之后使用分光光度计在波长660 nm 下读取吸光度,根据标准曲线查找CK 酶活力。
1.3.5 ELISA法检测LDH活性
吸取细胞培养液测量LDH活性。依照乳酸脱氢酶(LDH)测定试剂盒说明书进行,之后使用酶标仪在波长450 nm处测定吸光度值,经过计算得出LDH活性。
1.3.6 统计学分析
数据以平均值±标准差表示,采用 SPSS 26.0 统计软件进行单因素方差分析。显著水平取P<0.05,极显著水平取P<0.01,作图软件采用Excel 和GraphPad Prism 6。
2 实验结果
2.1 电刺激强度对C2C12细胞P38蛋白表达的影响
如图1所示,V1组细胞经10 V、20 ms、1 Hz、40 min的电脉冲刺激后,与C组相比,刺激结束后4 h、8 h、24 h后的H4、H8、H24 组细胞内P38 蛋白含量呈极显著性增加。
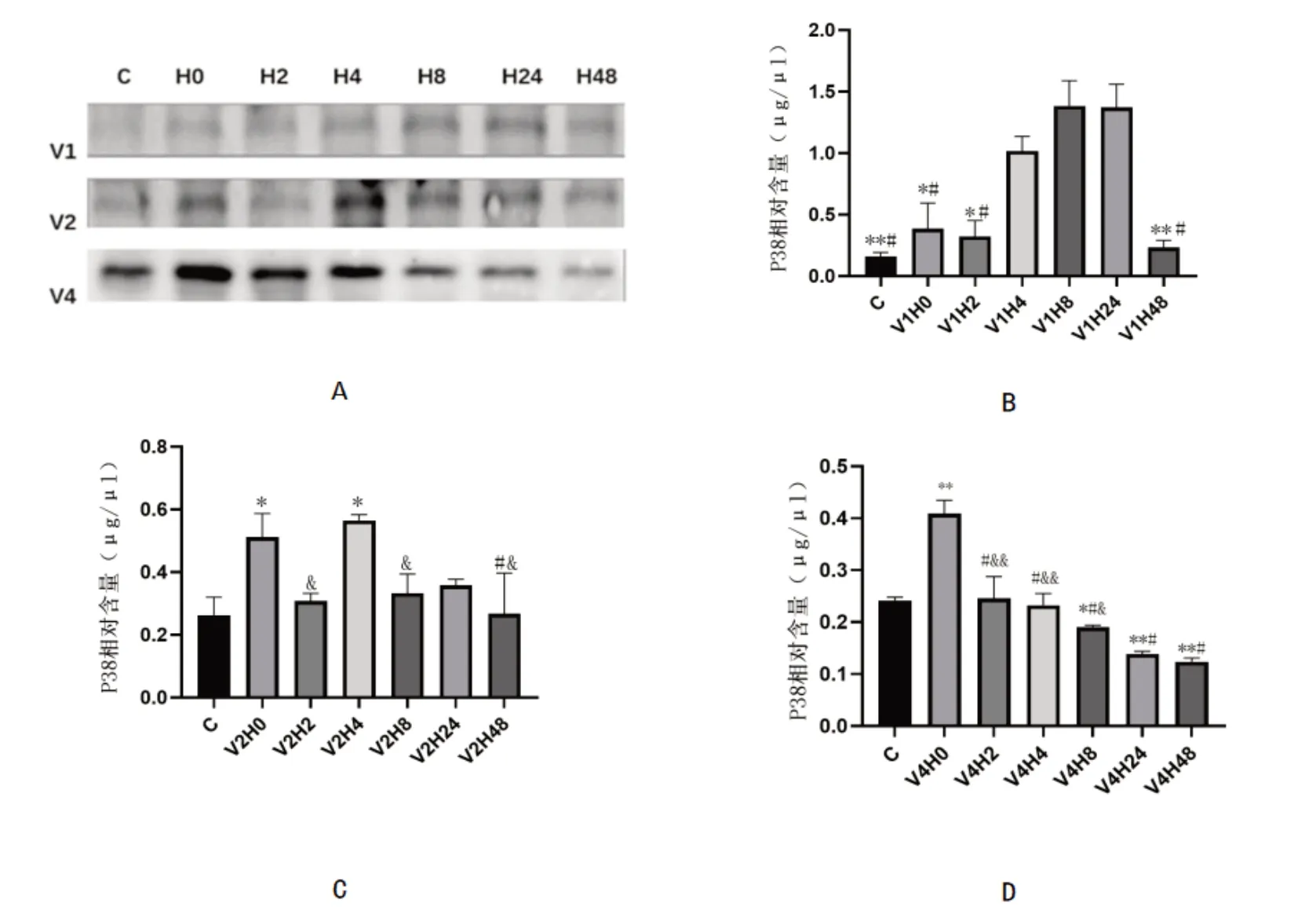
图1 各组C2C12细胞内P38蛋白相对含量
V2组细胞经23 V、20 ms、1 Hz,40 min的电脉冲刺激后,与C 组相比,H0、H4 组细胞内P38 蛋白含量呈显著性增加;与H0组相比,H48组细胞内P38蛋白含量呈显著性下降;与H4 组相比,H2、H8、H48 组细胞内P38含量显著性下降。
V4组细胞经40 V、20 ms、1 Hz、40 min的电脉冲刺激后,与C组相比,H0组细胞内P38蛋白含量呈极显著性增加,H24、H48 组呈极显著性下降,H8 组呈显著性下降;与H0 组相比,H2、H4、H8、H24、H48 组细胞内P38蛋白含量呈极显著性下降。
2.2 电刺激强度对C2C12细胞CK活力的影响
如图2所示,V4组细胞经40 V、20 ms、1 Hz,40 min的电脉冲刺激后,与C 组相比,H0、H2、H4、H8 组细胞内CK 活力呈极显著性增加,H24 组呈显著性增加;与H0 组相比,H8 组细胞内CK 活力呈显著性增加,H8 组呈显著性下降,H24组呈极显著性下降;与H8组相比,H2、H24 和H48 组细胞内CK 活力呈极显著性下降,H4组呈显著性下降。

图2 V4组C2C12细胞培养基内肌酸激酶(CK)活性
2.3 电刺激强度对C2C12细胞LDH活性的影响
如图3所示,V4组细胞经40 V、20 ms、1 Hz、40 min的电脉冲刺激后,与C组相比,H0、H2组细胞内LDH活性呈显著性增加;与H0 组相比,H24 组呈极显著性下降,H48 组呈显著性下降;与H4 组相比,H24 组呈极显著性下降,H48组呈显著性下降。

图3 V4组C2C12细胞培养基内乳酸脱氢酶(LDH)活性
3 结论
本实验分别以10 V、23 V、40 V的电压,及20 ms、1 Hz的频率持续40 min刺激C2C12细胞,发现在这3种电压强度下,P38 蛋白均有不同程度的增加,证明这3 种电压均可引起C2C12 细胞收缩。选择增加幅度最大、恢复趋势最稳定的V4组进行进一步的损伤指标检测,发现经40 V电脉冲刺激方案的刺激后,细胞液中的CK极显著增加,LDH显著增加,进一步证明该电刺激方案不仅能够引起细胞收缩,并且能够导致细胞损伤。综上所述,用40 V、20 ms、1 Hz、40 min的电脉冲刺激C2C12细胞可以构建骨骼肌离心运动损伤模型,且随着指标的恢复进程发现,这种损伤在4~8 h内得以恢复。
4 不足与展望
电刺激方案可变换与可探究的维度还有许多,本研究以电压强度为变量,探究出了可以建立运动损伤修复细胞模型的电刺激方案,但由于实验设计存在不足,一方面,忽略了电刺激频率的影响,未来可以设计更加精确的电脉冲刺激时间与刺激频率的方案,进而构建出更多、更精确的实验模型;另一方面,指标的选择也有待进一步优化,排除不可控的代谢干扰,进一步弥补组织培养和分离技术逐渐显露的弊端,能够有助于利用细胞实验模型解决更多科学问题。
