肿瘤微环境中免疫细胞自身调控及中药成分对其调控的研究进展
2024-01-27曹寒冰龚政艳代秉玲张彦民
呼 宇,曹寒冰,龚政艳,朱 曼,代秉玲,张彦民
西安交通大学医学部药学院,西安 710061
肿瘤微环境(tumor microenvironment, TME)由肿瘤细胞、免疫细胞、肿瘤相关成纤维细胞、周围的血管及细胞外基质组成[1]。随着肿瘤的恶化,肿瘤微环境也随之发生动态变化,尤其是免疫微环境。TME中的免疫细胞功能被抑制,从而使肿瘤细胞得到保护,实现了免疫逃逸,进一步促进肿瘤的生长和转移。TME 中浸润的免疫细胞在肿瘤的生长和恶化过程中起着举足轻重的作用。因此,了解TME 中免疫细胞的变化、改善免疫抑制、增强抗肿瘤免疫治疗已成为抗肿瘤研究的重要方向之一,而免疫治疗也成为继手术、放疗、化疗外的又一种重要的抗肿瘤治疗手段。
随着对中医探索的不断深入,越来越多的研究证实了中药在肿瘤免疫治疗方面起着重要的作用,中药成分如多糖类、黄酮类等化合物抗肿瘤免疫调节机制也逐渐得到明确。中药的优势是可以提高患者的生活质量、提高患者机体的免疫力、降低药物毒性和不良反应等[2]。因此,在临床中中药作为抗肿瘤辅助用药已经得到了广泛应用。本文对肿瘤微环境中免疫细胞活化和调控进行归纳、总结,并阐述中药对免疫细胞的调节作用,为中药抗肿瘤机制研究提供依据。
1 免疫细胞在肿瘤微环境中调控机制的研究
1.1 T 淋巴细胞活化和功能调控的研究
TME 中T 细胞亚群种类繁多,包括细胞毒性T 细胞(cytotoxic T cell, CTL)、调节性T 细胞(regulatory T cells, Tregs)、辅助性T 细胞(helper T cell, Th)等。Th1 和Th2 细胞能分泌众多细胞因子,分别参与到细胞免疫和体液免疫中,Th17 细胞具有双重作用,既可以抗肿瘤又能在某些特定情况下促进肿瘤发展[3]。但在肿瘤微环境中发挥肿瘤杀伤作用的主要是CTL。在肿瘤微环境中CTL 主要通过释放颗粒酶和穿孔素、激活Fas/Fas蛋白配体(Fas ligand, FasL)通路以及分泌细胞毒性因子这3种方式杀伤肿瘤细胞[4]。
T 细胞的活化需要抗原递呈细胞(antigen presenting cell, APC)呈递抗原,并在抗原分化簇28(cluster of differentiation 28, CD28)、信号淋巴细胞激活分子(signalling lymphocyte activation molecular,SLAM)和肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily, TNFRSF)等共刺激分子以及相关细胞因子的共同作用下激活信号,通过下游磷脂酰肌醇3- 激酶(phosphatidyl inositol3-kinase,PI3K)、Ras 蛋白、蛋白激酶B(alkaline protein kinases,Akt)、细胞分裂周期42 蛋白(cell division cycle 42,CDC42)等通路调控核内细胞外调节蛋白激酶(extracellular signal-regulated kinase 1/2, ERK1/2)、衔接蛋白1/衔接蛋白2(adaptor protein, AP1/AP2)、雷帕霉素靶蛋白(mammal target of rapamycin, mTOR)、核因子κB(nuclear factor-κB, NF-κB)、活化T 细胞核因子(nuclear factor of activated T cell, NFAT)等蛋白作用,刺激细胞生长、激活效应器功能并维持细胞存活[5-6]。CD8+T 细胞活化过程中胞内的代谢变化会影响抗肿瘤功能。未成熟的CD8+ T 细胞遇到抗原活化后转为糖酵解代谢方式以维持效应器功能。但胃癌中肿瘤表面的CD155 与CD8+T 细胞表面的T 细胞免疫球蛋白和ITIM 结构域(T cell immunoglobulin and ITIM domain, TIGIT)受体结合后会抑制T 细胞葡萄糖摄取和代谢,降低Akt 和mTOR 的磷酸化,使T细胞功能衰竭[7]。然而,高度糖酵解又会影响CD8+T 细胞抗肿瘤功能和长期记忆细胞的形成,而在2-脱氧葡萄糖(2-deoxy-D-glucose, 2DG)处理后,T 细胞可以分泌更多的干扰素-γ(interferon-γ, IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α),促进叉头框蛋白O1(forkhead box O1, Foxo1)向核转移,加快记忆CD8+ T 细胞的形成。在这一过程中与葡萄糖摄取和糖酵解相关的途径受到影响,腺苷酸活化的蛋白激酶(AMP activated proteinkinase,AMPK)的磷酸化增强,缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)表达下调[8]。见图1。糖酵解代谢的转换也会影响细胞内氨基酸的代谢从而影响T 细胞的增殖和效应器功能。当胞内的天冬酰胺(asparagine, Asn)耗尽时CD8+T 细胞的活化会被抑制。Asn 可以结合SRC 家族蛋白酪氨酸激酶LCK,并在Tyr 394 和Tyr 505 处协调LCK 磷酸化,从而导致LCK 活性增强和T 细胞受体信号转导[9]。CD8+T 细胞的抗免疫功能失效包含多方面的原因,如:抗原递呈细胞的能力减弱无法刺激T 细胞分化,或者是肿瘤通过免疫检查点程序性死亡受体配体1(programmed cell death ligand-1, PD-L1)、细胞毒T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)、T 淋巴细胞免疫球蛋白黏蛋白分子3(T cell immunoglobulin domain and mucin domain-3, TIM-3)、淋巴细胞活化基因-3(lymphocyte activation gene-3, LAG3)、TIGIT 等作用最终逃脱了T 细胞的监控和杀伤[10]。以阻断PD-L1 和CTLA-4 为代表的免疫检查点阻断治疗方案开启了肿瘤免疫治疗的新篇章,但其在临床上的治疗效果并不理想,应用范围有限。因此,急需寻找新的免疫检查点,增强抗肿瘤治疗效果和治疗范围。
在肿瘤微环境中Tregs 可以调节机体免疫。Tregs 虽然是预防自身免疫疾病必不可少的,但它会抑制抗肿瘤免疫效应。CD8+T 细胞功能也会直接或间接受到Tregs 的影响。
Tregs 可根据其表面标志物不同细分为不同亚型,表现出强免疫抑制功能的Tregs 表型为CD4+CD25+Foxp3+[11]。Foxp3 即叉头翼状螺旋转录因子,其是CD4 CD25 Treg,特异性分子标志物,可调控Tregs 的功能,当Foxp3 持续表达才能维持完整的Tregs 的抑制能力[12]。Tregs 在肿瘤微环境中主要通过以下几种方式发挥免疫抑制作用:分泌抑制性细胞因子,如TGF-β、白细胞介素(interleukin, IL)-10、IL-35 等抑制CD8+T 细胞和树突状细胞(dendritic cells, DCs),降低抗肿瘤免疫[13];通过颗粒酶B 和穿孔蛋白裂解效应T 细胞;剥夺肿瘤微环境中的IL-2,减少效应T 细胞对其的摄取,抑制效应细胞增殖[14];胞外分泌大量酶促进腺苷生成,结合效应T 细胞表面的腺苷 A2A 受体(adenosine A2A receptor,A2AR)发挥抑制作用[15];通过免疫检查点调控肿瘤微环境中其他免疫细胞,如通过CTLA-4 和LAG3下调DC 功能,或经由程序性死亡受体1(programmed death-1,PD-1) / PD-L1 和CD80 / CTLA-4 轴与髓源性抑制细胞(myeloid-derived suppressor cells, MDSC)协同增强抑制作用[12]。因此,阻断以上Tregs 的作用途径就可以有效逆转其免疫抑制功能。另外,目前研究表明,激活Tregs 表面Toll 样受体8(Toll-like receptor 8, TLR8)信号会调节Tregs细胞中的mTOR-HIF1α轴及其下游糖酵解程序,导致Tregs 抑制功能的逆转[16]。以上研究结果表明,能量代谢也可以成为靶向Tregs 的抗肿瘤免疫治疗的切入点。
1.2 巨噬细胞极化和功能调控的研究
巨噬细胞作为固有免疫的一部分,同时也承担着递送抗原的功能。在肿瘤微环境中巨噬细胞被多种信号募集并活化,参与调控肿瘤的发生、发展和转移等阶段。肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)是TME 的重要组成部分,影响肿瘤的进一步发展。巨噬细胞的极化方向有极化为M1 表型发挥抗肿瘤作用或者极化为M2 表型发挥促肿瘤作用。在肿瘤微环境中巨噬细胞通常是极化为M2 型,促进组织重塑和血管形成,与肿瘤发展和患者预后不良密切相关。因此,调控肿瘤微环境中M1/M2 平衡有利于抗肿瘤治疗。
Toll 样受体(Toll-like receptor, TLR)配体和IFN-γ在M1 型巨噬细胞极化过程中发挥着重要的调节作用。IFN-γ和TLR 可以激活干扰素调节因子(interferon regulatory factor, IRF)/信号转导和转录激活子(signal transducer and activator of transcription, STAT)信号通路,这是巨噬细胞极化的核心通路。TLR 接收到信号后,由髓样分化蛋白-88(myeloid differentiation factor 88, MyD88)和β干扰素TIR 结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β, TRIF)介导下游信号,最后激活核因子NF-κB、转录因子STAT1,促使肿瘤相关巨噬细胞向M1 型极化,并调节TNF-α、IL-1β、环氧合酶-2(cyclooxygenase-2, COX-2)、IL-6 等炎性因子的表达[17-18]。STAT4、STAT5 通路也可以参与到巨噬细胞极化中。研究表明,激活的Janus 激酶2(janus kinase 2, JAK2)和酪氨酸激酶2(tyrosine kinase, TyK2)会使STAT4 磷酸化,促使M1 型极化的发生[19]。通过抑制STAT5 的磷酸化以及CrkLSTAT5 复合物的形成可有效减少巨噬细胞的M1 型极化[20]。巨噬细胞的极化易受到环境的影响,肿瘤环境中普遍缺氧,因此,HIF 也会调控TAM 的极化。HIF-1α是丙酮酸转化为乳酸盐这一过程的重要参与者,会影响巨噬细胞内糖酵解代谢过程,这与巨噬细胞M1 型极化密切相关,通过HIF-1α/丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase 4, PDK4)轴能影响M1 型极化[17,21]。
M2 型极化主要受IL-3 和IL-4 的调控,通过胞内众多信号分子,如STAT、过氧化物酶增殖激活受体(peroxisome proliferator-activated receptor, PPAR)、cMyc 等影响巨噬细胞功能。IL-3 和IL-4 会激活STAT3、STAT6,通过下游的Kruppel 样因子4(Kruppel-like factor 4, KLF-4)抑制NF-κB / HIF-1α依赖性转录从而增强M2 型极化[18]。PPAR 则控制了M2巨噬细胞的活化和代谢,如PPAR-γ会被TAM 中的S100A4 蛋白激活,促使TAM 代谢重编程,使其向M2型转化[22]。cMyc 会受到由IL-4 激活的丝裂原激活蛋白激酶5(MEK5)/细胞外信号调节激酶5(ERK5)通路或者经典的wnt/β-catenin通路调控,最终诱导M2样巨噬细胞形成[23-24]。见图2。

图2 巨噬细胞M1/M2 极化的调控机制Fig.2 Regulation mechanism of M1/M2 polarization in macrophages
1.3 树突状细胞分化和功能调控的研究
树突状细胞(dendritic cells,DCs)是适应性免疫调节的关键因子,是强大的APC,能够调节T 细胞免疫。DCs 包括众多亚型:常规树突状细胞(conventional dendritic cells,cDCs,包含cDC1 和cDC2,浆样树突状细胞(plasmacytoid dendritic cell, pDC),单核细胞源性 DC(monocyte-derived dendritic cell,moDC)等[25]。
cDCs 在肿瘤微环境中发挥重要的抗肿瘤免疫作用。肿瘤微环境中cDC1 可以向CD8+ T 细胞提供肿瘤特异性抗原,调节T 细胞的增殖、活化和免疫效应,cDC2 则可以调控CD4+ T 细胞。cDC 的发育依赖于碱性亮氨酸拉链ATF 样转录因子3(basic leucine zipper ATF-like transcription factor 3, BATF3)、IRF8、IRF4、DNA 结合抑制因子(inhibitor of DNA binding 2, ID2)和树突状细胞生长因子FLT3L 等转录因子的调控[26],而在其成熟和活化过程中Toll 样受体与其下游信号通路发挥重要作用,如在小鼠的DC 中TLR 的激活影响了PI3K/Akt 通路促使DC 从氧化磷酸化到糖酵解代谢的转变,促使DC 的成熟[27]。在cDC1 细胞表面可以特异性地表达趋化因子受体XCR1 和凝集素受体DNGR-1/CLEC9A。DNGR-1(CLEC9A)是一种死细胞感应受体,可以抑制浸润的cDC1,当DNGR-1 被阻断时,特别是在cDC1 个体所需的生长因子Flt3L 存在时,与cDC1 激活相关的基因如NFκB-TNFα信号通路,炎症反应等基因被富集[28];且cDC1 中CCL5 的表达上调,增强了抗肿瘤免疫反应。在DC 表面,一些免疫检查点分子的激活会抑制DC 的功能,例如:PD-L1 和信号调节蛋白α(signal regulatory proteinsα, SIRPα)。在双特异性阻断 PD-L1-SIRPα后,激活 DC 中STING-IFN-γ通路,增强DC 吞噬作用和递呈抗原能力,从而增强 T 细胞的肿瘤杀伤作用[29-30]。见图3。有研究发现,在一簇共表达免疫调节基因(Cd274, Pdcd1lg2 and Cd200)和成熟基因(Cd40,Ccr7 and Il12b)的cDC(mature DCs enriched in immunoregulatory molecules, mregDCs)中受体酪氨酸激酶ALX 能够诱导检查点分子PD-L1 上调,并且这类细胞受到IL-4 的负性调控,影响IL-12 的表达,会降低cDC 尤其是cDC1 的功能[31]。
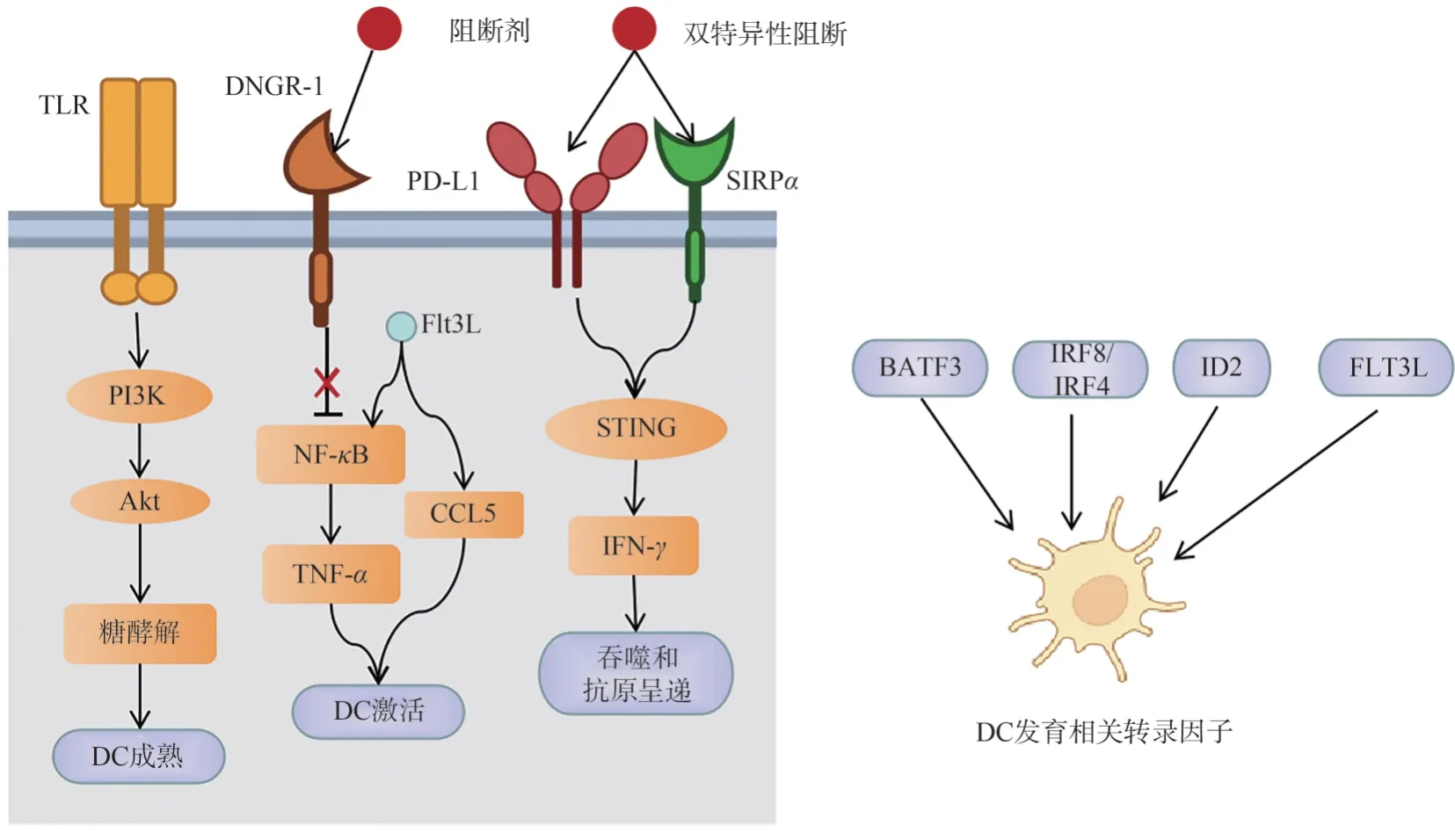
图3 cDC 细胞发育、成熟、激活、免疫功能的调控机制Fig.3 Regulatory mechanisms of cDC cell in development, maturation, activation, and immune function
pDC 是异质细胞,其在肿瘤免疫中的功能较为复杂,会产生双重效果。pDC 发挥免疫抑制作用可能是通过诱导共刺激分子及其配体(ICOS/ICOSL)或吲哚胺-2,3-双加氧酶(IDO)依赖性途径从而诱导Tregs实现的;但在人结肠癌中,pDC 的高浸润可以增强抗肿瘤免疫力,且有可能通过产生可溶性分子[例如I 型IFN 和颗粒酶B(GrzB)]以及刺激GrzB CD8 T 细胞来促进有效的抗肿瘤反应[32]。有研究证实,pDC 活化可有效增强NK 和T 细胞的抗肿瘤功能[33]。
MoDC 是从单核细胞在体外经过粒细胞-巨噬细胞集落刺激因子(GM-CSF)和IL-4 刺激下生成的衍生DC,其分化与cDC2 一致,依赖于IRF4[34]。MoDC可以表达TNF 和iNOS,与体内的炎性DC 相似。MoDC 的分化受到TLR 和STAT6 通路调控,MoDC可以诱导Tregs,下调HLA-DR、CD80、CD86、CD83和CD40 等与抗原呈递和淋巴细胞激活相关的重要分子,抑制免疫功能,促使肿瘤进一步恶化[35]。
2 肿瘤微环境中免疫细胞新靶点调控的研究
临床应用较为普遍的肿瘤免疫治疗方案包括免疫检查点抑制剂、过继性细胞转移疗法、肿瘤DC 疫苗、嵌合抗原受体T 细胞疗法等,治疗效果显著,不良反应小。但存在免疫治疗的对象范围较窄、效果个体差异大以及耐药性等问题[36]。因此,探索新的免疫治疗靶点,研究肿瘤微环境中新靶点的免疫调控机制,提出新的抗肿瘤免疫治疗方法以及双靶点乃至多靶点联合治疗方案,有望改善抗肿瘤免疫治疗方案现有的不足。
2.1 YTH N6-甲基腺苷RNA 结合蛋白1
N-6 甲基腺苷(N6-methyladenosine,M6A)修饰是目前研究较为广泛的RNA 修饰。其中YTH N6-甲基腺苷RNA 结合蛋白1(methyladenosine RNAbinding protein 1, YTHDF1)作为M6A 系统中的“读码器”分子之一,在肿瘤组织中普遍呈高表达状态,促进肿瘤的发生、发展。肿瘤免疫相关研究发现,YTHDF1 影响肿瘤浸润免疫细胞、肿瘤微环境、肿瘤新抗原呈递等多个方面[37]。
HAN D 等[38]研究发现,在YTHDF1 基因敲除小鼠的经典树突状细胞中,YTHDF1 的缺失会导致溶酶体蛋白酶的翻译受限,影响DCs 的交叉呈递抗原能力,增强肿瘤免疫调控这一新机制。YTHDF1缺失的肿瘤组织会募集更多的成熟DCs,增加肿瘤浸润淋巴细胞中T 细胞的比例;并激活肿瘤细胞内JAK/STAT1 信号通路,增强肿瘤免疫监控[39]。众多研究者通过对临床病例样本以及TCGA 数据库和GEO 数据库的数据整理分析发现,在胃癌、肺癌、泌尿生殖系统癌症中,YTHDF1 的表达与肿瘤免疫浸润性细胞存在显著相关性,YTHDF1 的扩增与高表达可以降低免疫细胞的浸润,在肿瘤免疫调控中发挥重要作用[39-41],通过基因富集分析推测其下游靶点可能与MYC 通路和T 细胞分化相关[42]。虽然相关机制研究较少,但YTHDF1 有望成为潜在的肿瘤免疫治疗新靶点。
2.2 唾液酸结合免疫球蛋白样凝集素
唾液酸结合免疫球蛋白样凝集素(sialic acidbinding immunoglobulin lectin 15,Siglec-15)是主要在人的树突状细胞和巨噬细胞表达的一种跨膜蛋白,在脊椎动物中高度保守,其在正常的巨噬细胞中表达较低,但在肿瘤细胞和肿瘤相关巨噬细胞中呈高表达。Siglec-15 可以通过双特异性磷酸酶1(dual-specificity phosphatase-1, DUSP1)/MAPK 通路或者诱导细胞自噬、EMT 等影响肿瘤的增殖和转移[43-44]。
Siglec-15 作为一种免疫受体可以在肿瘤微环境中发挥重要的免疫调节作用。WANG J 等[45]研究发现,Siglec-15 与PD-L1 有30%的氨基酸序列同源,同样可以抑制T 细胞,但其作用机制与PD-L1 并不相同。因此,Siglec-15 可以作为抗肿瘤免疫治疗的新靶点,并有可能在抗PD-L1/PD-1 治疗无效的肿瘤患者中显示良好的治疗效果。LIU Y 等[46]研究发现,Siglec-15 是miR-7109 的直接靶标,抑制miR-7109,会促使肿瘤细胞表面Siglec-15 的高度表达,形成免疫抑制。Siglec-15 抗体能调节TME 中的巨噬细胞极化从而抑制肺腺癌[47];肿瘤相关巨噬细胞能通过Siglec-15-SYK/ERK 通路的级联作用影响其功能,但针对该条通路具体下游分子的调控机制仍需进一步研究[48]。
2.3 脂肪酸转运蛋白2
脂肪酸转运蛋白2 (fatty acid transport protein 2, FATP2)影响正常细胞内膜的合成、能量代谢、生物合成、信号转导等多个方面,对肿瘤细胞脂质代谢的作用也十分显著。在肿瘤细胞中脂质的代谢会发生改变,进一步影响肿瘤细胞的增殖、迁移、免疫逃逸、耐药性和肿瘤内血管生成等过程。因此,抑制癌细胞或者肿瘤相关免疫细胞的脂质供给可以抑制肿瘤的进一步发展。
FATP2 主要表达于肝脏细胞中,其能调节肝细胞脂肪酸摄取,常作为脂肪肝治疗的靶点[49]。但随着研究的深入,该靶点在肿瘤免疫调控方面的重要作用逐渐被明确。 VEGLIA F 等[50]研究发现,肿瘤微环境中的多形核髓源性抑制细胞(polymorphonuclear myeloid-derived suppressor cells, PMN-MDSC)存在FATP2 过表达情况,增加了PMN-MDSC 对花生四烯酸的摄取和利用,促进了前列腺素E2 的合成,抑制肿瘤组织中CD8+ T 细胞的能力,有利于肿瘤生长。进一步研究发现,FATP2 对MDSCs 脂肪酸堆积的调节还会影响细胞内ROS 的产生。有研究报道,当MDSCs 内ROS 增加时会促使MDSCs 对T 细胞免疫抑制的增强,并抑制MDSCs 向其他髓系细胞分化[51]。FATP2 的表达是由GM-CSF 作用于STAT3或STAT5 通路,因此GM-CSF-STAT3/STAT5-FATP2 信号轴对髓源性抑制细胞的免疫抑制作用十分重要[50-51]。此外,阻断MDSCs 的FATP2 能增强抗PD-L1 肿瘤免疫治疗的效果[50]。综上所述,FATP2不仅可以成为肿瘤免疫治疗的新靶点,同时提供了一个增强抗PD-L1 免疫治疗效果的联合治疗方法。
3 中药对肿瘤微环境中免疫细胞的调节作用
在临床抗肿瘤治疗中,中药作为放疗、化疗的辅助用药而被广泛应用,例如:养正合剂能发挥减毒增敏的作用,缓解放疗、化疗引起的不良反应,改善患者的不适症状,特别是可以改善免疫抑制,增强患者的免疫力[52]。众多研究表明,中药中多糖、黄酮、生物碱、皂苷等种类的单成分物质都具有抗肿瘤免疫调节作用,可以影响肿瘤微环境中T 细胞、巨噬细胞、DC、NK 细胞等众多免疫细胞的分化和功能,影响肿瘤微环境的免疫状态。
3.1 多糖类成分对免疫细胞的调节作用
多糖类成分作为研究最为广泛的具有免疫调节的中药成分之一,可以作用于多种免疫细胞,整体改善患者肿瘤微环境中的免疫抑制状态。
香菇多糖能促进T 细胞分泌TNF-γ,提高对肿瘤细胞的杀伤效果[53]。黄芪多糖可以作用于DC,激活TLR4,促使DC 分泌IL-12p70 发挥抗肿瘤免疫功效[54]。在灵芝三萜的协同作用下灵芝多糖表现出更强的Tregs 抑制效果,减少肿瘤微环境中Tregs 的数量[55]。蛹虫草多糖可以结合肿瘤巨噬细胞表面的Toll 样受体,引起细胞内的Ca2+释放,激活p38、Akt-NF-κB/ERK 通路,促使肿瘤相关巨噬细胞发生转化,从M2 型向M1 型极化,并抑制巨噬细胞与T 淋巴细胞之间PD-L1/PD-1 的相互作用[56]。车前草种子中的多糖成分PLP-2 与TLR4 结合,能激活下游与MAPK 相关的3 条途径:p38、ERK1/2 和JNK 途径,促使MHC Ⅱ、CD86 等分子在DC 细胞膜上的表达,促使DC 发育成熟[57]。枸杞多糖可以作用于TLR4及其相关下游通路促使DC 细胞成熟[58],其脂质体能诱导共刺激分子上调,激活未成熟的DC 发育并产生IL-12p40、TNF-α等细胞因子,调控TLR4、MyD88、TRAF6、NF-κB 的基因和蛋白表达,增强抗原摄取和呈递[59]。地黄多糖、葛根多糖、桔梗多糖等也可以增加DCs 表面特征分子的表达以及重要细胞因子的生成和分泌,促进DCs 进一步成熟[60]。针对抑制性的免疫细胞,竹荪多糖则能诱导MDSC 的凋亡,逆转免疫环境的抑制状态[61]。
3.2 黄酮与异黄酮类成分对免疫细胞的调节作用
异黄酮类化合物刺芒柄花素在多种中药中都存在,其可以提高T 淋巴细胞中PI3K、Akt 等重要蛋白的表达和T 细胞的细胞因子分泌水平,阻断PD-1/PD-L1 信号通路和活化PI3K/Akt 信号等协同作用,改善T 淋巴细胞的免疫抑制状态[62]。
黄酮类化合物淫羊藿素可以上调T 细胞内周期相关基因表达,促进T 细胞增殖;显著抑制肿瘤微环境中MDSC 上的PD-L1 表达[63],改善免疫抑制状态。木犀草素可以作为佐剂调控DC 细胞中PI3KAkt 通路中关键蛋白的表达,促进APC 表达IL-12,并改善其抗原递呈功能[64]。芹菜素则可以抑制DC表面PD-L1 的表达,调节DC 的功能[65]。
双黄酮类化合物穗花杉双黄酮可以激活PPARα/PPAPγ促进巨噬细胞M2 型极化[66]。
3.3 生物碱类成分对免疫细胞的调节作用
生物碱类成分龙葵碱可以减少肝癌肿瘤微环境中与Tregs 相关免疫抑制性细胞因子的分泌[67]。玫瑰树碱则可通过上调肿瘤细胞主要组织相容性复合体Ⅰ类链相关蛋白A/主要组织相容性复合体Ⅰ类链相关蛋白B(MICA/MICB)等分子表达,增强NK 细胞对肿瘤细胞的识别能力[68]。苦参碱能缓解肿瘤患者化疗后的白细胞减少情况,提高荷瘤小鼠外周血Th/Treg 的细胞比值,具有显著的肿瘤抑制和免疫调节功能[69]。小檗碱作为中药黄连的主要成分,可以发挥抑制肿瘤细胞表面PD-L1 的表达、抑制IDO1的合成、促进体外肿瘤细胞对T 细胞的敏感性、增加肿瘤组织中浸润性CTL 和NK 的活性并减弱MDSC和Tregs 的活化等多方面协同作用,恢复肿瘤微环境免疫监视和肿瘤清除功能[70-71]。
3.4 其他类成分对免疫细胞的调节作用
青蒿素的衍生物双氢青蒿素属于含过氧化基团的倍半萜内酯化合物,可通过抑制巨噬细胞内M2 型分子的表达、STAT3 的磷酸化来抑制M2 型极化,并通过Akt/mTOR 通路促进M1 型极化[72-73]。
皂苷类化合物人参皂苷作为人参的主要活性成分,可发挥抗肿瘤、抗氧化、免疫调节等多种作用。人参皂苷Rg1可以通过NF-κB 通路促进DC 的活化[74]、增强T 细胞的增殖、强化NK 细胞的杀伤作用等整体改善肿瘤微环境[75]。
苷类化合物红景天苷可以影响DCs 的ERK 通路,进一步调节重要细胞因子IL-12p70 的分泌,促进DC 成熟并激活T 细胞的免疫功能[76]。
非黄酮类多酚白藜芦醇会影响NK 细胞活性,能上调IL-2 活化的NK 细胞表面CD107a、NKp30 和NKG2D 分子表达,并增强IFN-γ的分泌[77]。
羟基蒽醌类化合物大黄素与玫瑰树碱调控NK细胞的机制相似,可强化NK 细胞对肿瘤细胞的识别能力和杀伤作用[68,78]。
香豆素类化合物秦皮乙素在抑制肿瘤生长的同时,可有效下调TME 中Tregs 细胞内标志性分子Foxp3 的表达水平,增强重要细胞因子IL-10 的表达和分泌,从而抑制Tregs 细胞的分化,减少肿瘤免疫逃逸[79]。
3.5 中药组方对免疫细胞的调节作用
大多数中药单体成分的药物作用效果较弱,复方中药的调控作用更为显著。
丹参和人参的协同使用可以影响MDSC 内STAT3 和NOD 样受体3(nod-like receptor protein3, NLRP3)通路,从而减少肿瘤微环境中MDSC的数量[80]。西黄丸组分中药可以通过调控Tregs 细胞中PI3K、Akt 的mRNA 水平和蛋白水平的表达,改善Tregs 细胞的肿瘤免疫抑制作用[81]。养正合剂是目前临床上应用的化疗辅助用药,其与化疗药物联用可以提高癌症患者在化疗后血液中CD4+ T 细胞亚群的比例[82],可以显著改善放疗、化疗导致的骨髓DNA 含量降低[83],增强骨髓造血功能,并提高外周血中白细胞数量[82],促进大鼠脾细胞IL-2 的产生[84]。中药方剂温阳散结汤可以通过调控巨噬细胞内NFκB 等信号通路而影响巨噬细胞M1 型极化,作用于TGF-β信号通路抑制M2 型极化,增强免疫监控[85]。复方中药鳖甲煎丸可以下调HIF-1α/NF-κB 信号通路发挥M1 型极化的抑制效果,缓解缺氧环境下巨噬细胞的损伤,延缓肝纤维化[86]。
希望中药研究可以实现以几种主要有效成分的配伍组合替代复杂且庞大的中药组方体系,并期望保持相似、乃至相同的治疗效果。但一种组方中药包含了多种药材,含有成千上万种成分,多种成分之间的相互作用为中药的药效物质基础研究带来了极大的困难。
4 总结与展望
肿瘤微环境的免疫抑制状态为肿瘤细胞提供了良好的生长环境,了解免疫细胞的分化、激活、功能及其相关调控途径有助于认识并改善肿瘤微环境的免疫抑制。DC 和巨噬细胞作为抗原呈递细胞,能够识别肿瘤特异性抗原并激活CTL、杀伤肿瘤细胞。因此,增加cDC 在肿瘤微环境中的募集、调控巨噬细胞极化、减少M2 型的比例、增加T 细胞的浸润和功能、减少免疫抑制细胞的浸润等方法都可以逆转肿瘤微环境的抑制状态。但现有的抗肿瘤免疫治疗存在耐药性及单一免疫治疗方案应用范围狭窄等缺陷,因此,需要发现新的靶点,增加新的抗肿瘤免疫治疗方法和联合治疗方案。
中药对肿瘤免疫的调节作用具有很大的优势,中药通过多途径协同作用,提高机体的免疫能力,改善肿瘤微环境的免疫机制,发挥抗肿瘤功效。正如前文所述,以枸杞多糖为例,不仅可以调控DC、巨噬细胞极化,还可以影响T 淋巴细胞的功能,减少Tregs 细胞浸润,增强NK 细胞活性。这些研究结果表明,中药的抗肿瘤免疫调控功能是多靶点、多途径协同作用的结果。但正是因为中药复杂广阔的调控网络,导致对中药抗肿瘤的深入机制的探索十分困难。因此,中药的研究不能仅限于一条通路的研究,要找到每种中药单体成分所调控每一条通路之间的关系,构建出中药免疫调控机制的网络。而新靶点的发现也将为中药复杂的免疫调控机制网络的完善提供新的“编织点”,这对中药的抗肿瘤免疫调控研究既是新的挑战、亦是新的机遇。对中药抗肿瘤和抗肿瘤免疫的新机制的探索将为中药在临床抗肿瘤治疗方案上的应用提供更加坚实、先进的理论支持。
