阴香叶乙醇提取物的化学成分鉴定及其抗菌抗炎活性
2024-01-27苏馨科金静维黄俊明李冬利
苏馨科,姚 敏,杨 磊,吴 鹏,金静维,熊 平,黄俊明*,李冬利
(1. 五邑大学生物科技与大健康学院, 广东 江门 529000;2. 华南农业大学制药工程系,广东 广州 510642)
阴香Cinnamomumburmanni是樟科樟属乔木,又名阴草,主要分布于广东、广西、云南及福建等地,可治寒湿腹泻、腹痛痢疾、风湿骨痛等。阴香叶主要化学成分是萜类、酰胺类、甾体类、黄酮类、苯丙素类等化合物[1],具有抗菌[2]、防蛀等功效。但目前对于阴香化学成分的研究集中在挥发油成分鉴定,对分离鉴定出的化合物结构报道较少;对其生物活性研究多是针对阴香提取物进行筛选,对单体化合物的研究较少。作者选取广东梅州种植的阴香为研究对象,对其叶的乙醇提取物进行分离纯化,并进行结构鉴定,筛选具有抗菌和抗炎活性的物质,为阴香叶的开发应用提供参考。
1 材料与方法
1.1 材料与主要试剂仪器
阴香叶于2021 年4 月采自广东省梅州市。由广东江门中医药职业学院郑小吉教授鉴定,凭证标本藏于五邑大学生物科技与大健康学院。
柱色谱用硅胶(100~200 目、200~300 目),青岛海洋化工厂;小孔树脂,日本三菱化学公司;C18反向硅胶,日本富士化学;D101 型大孔吸附树脂,北京索莱宝科技有限公司;乙腈、甲醇,色谱纯,安耐吉化学有限公司;甲醇、二氯甲烷、乙酸乙酯、石油醚,分析纯或工业纯,上海泰坦化学有限公司。金黄色葡萄球菌(ATCC 6538)、大肠杆菌(CMCC 44102),广东省微生物菌种保藏中心;营养肉汤培养基,广东环凯微生物科技有限公司;二甲基亚砜(分子生物级),德国Biofroxx;DMEM 培养基,美国 Gibco;胎牛血清 FB,美国 BI;PBS 缓冲液,美国 Gibco;噻唑蓝(MTT),美国 Sigma-Aldrich;Gresis Reagent Kit,美国 Biotium。
Bruker AVANCE NEO 500 型核磁共振波谱仪,德国Bruker 公司;BUCHI R-300 型旋转蒸发仪,瑞士步琦公司;Waters 1525 型半制备高效液相色谱仪,美国沃特世公司。MLS-3781L-PC 型高压蒸汽灭菌锅,江阴滨江医疗设备厂;SPX-250B 型生化培养箱,上海虔钧科学仪器有限公司;Infinite 200 多功能酶标仪,赛默飞世尔科技公司;Series 8000WJ二氧化碳培养箱,美国 Thermo scientific。
1.2 化学成分提取与分离
取晒干粉碎的阴香叶13.5 kg,用95%乙醇常温浸提3 次,每次7 d;合并提取液,减压浓缩得浸膏1837.5 g。将浸膏分散于适量水中,依次用石油醚、乙酸乙酯、正丁醇进行萃取;选取乙酸乙酯部分减压浓缩得到浸膏208.5 g,经D101 型大孔吸附树脂分离,以30%、50%、70%、90%、100%乙醇-水梯度洗脱,TLC 监测合并相似组分,得到5 个组分Fr.A~E。Fr.C 经MCI 小孔树脂分离,以30%、50%、70%、90%、100%乙醇-水梯度洗脱,TLC 监测合并相似组分,得到4 个组分Fr.C1~C4。分别对4 个组分采用正反向硅胶、凝胶、半制备液相等分离技术进一步分离纯化,最后从Fr.C1 (15.5 g)中得到化合物2 (476.5 mg)、3 (26.5 mg)、6 (5.6 mg)、11 (10.3 mg)、20 (9.3 mg)和21 (3.6 mg),从Fr.C2 (22.5 g)中得到化合物1 (530.9 mg)、4 (1051.8 mg)、5 (304.5 mg)、7 (10.8 mg)、8 (2.3 mg)、10 (9.2 mg)、13 (14.4 mg)、18 (1164.4 mg)、19 (3.1 mg)、22 (8.0 mg)、23 (3.9 mg)、24 (64.3 mg)和25 (1.5 mg),从Fr.C3 (7.5 g)中得到化合物9 (3.2 mg)、12 (10.1 mg)、15 (30.3 mg)、16 (4.1 mg)、17 (2.3 mg)和18 (335.9 mg),从Fr.C4(1.4 g)中得到化合物14 (2.8 mg)。
通过理化鉴别、1H NMR 和13C NMR 等波谱学手段,确定了25 个单体化合物的化学结构,结构式如图1 所示。
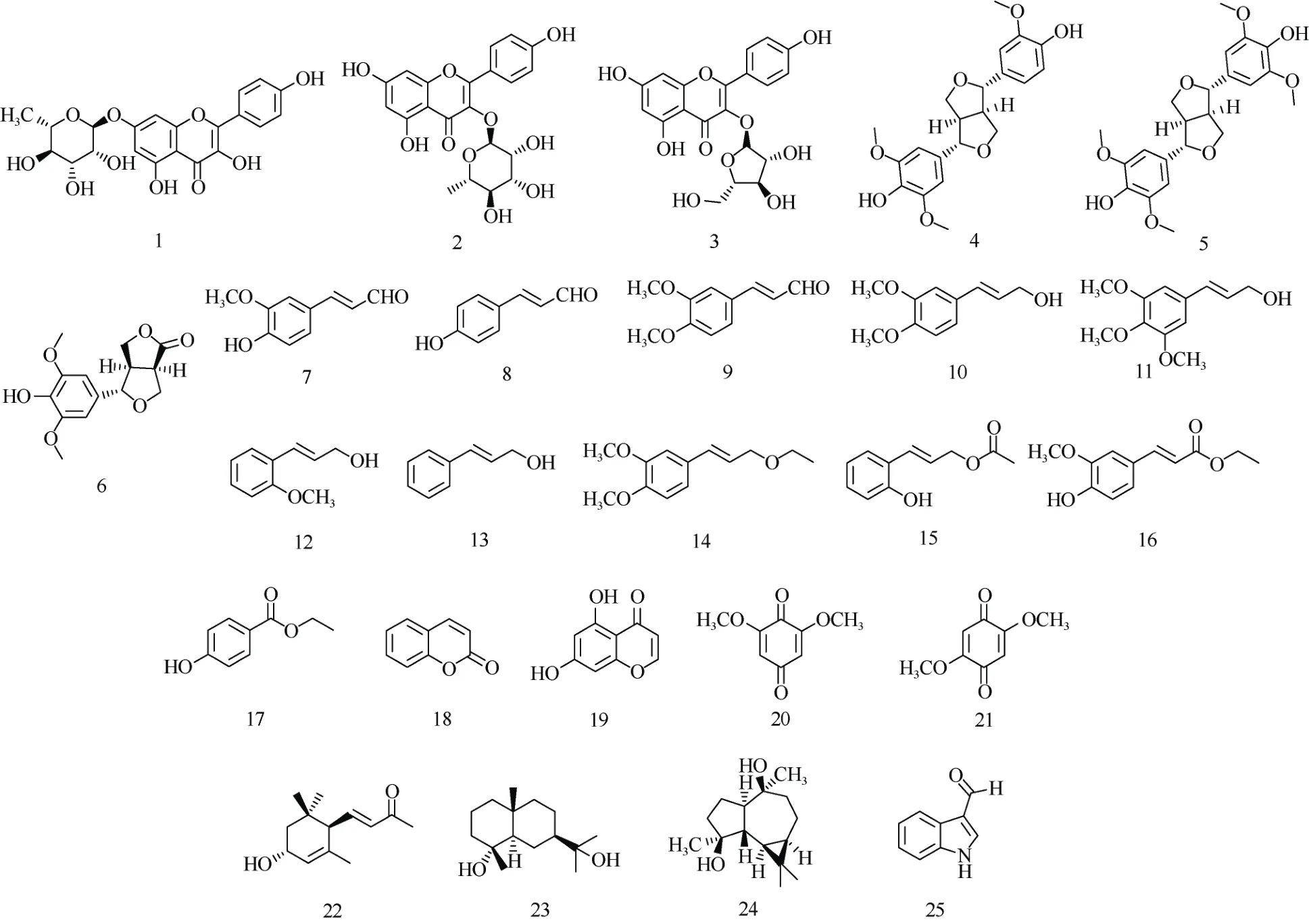
图1 25 个化合物的结构Fig. 1 Structures of 25 compounds isolated from Cinnamomum burmanni leaves
1.3 抗菌活性测定
采用微孔板法检测分离得到的所有化合物对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度(MIC)[3]。同时,在此基础上进一步测试最小杀菌浓度(MBC)和抑菌动力学。
1.4 抗炎活性测定
以脂多糖(LPS)诱导的小鼠小胶质细胞(BV2)产生的一氧化氮(NO)的量为指标,检测分离得到的所有化合物的抗炎活性。用Greiss 试剂测定NO 含量,阳性药为地塞米松。同时,采用MTT 法检测化合物对BV2 细胞的毒性。
2 结果与分析
2.1 结构鉴定数据
化合物1:绿色粉末。ESI-MS m/s:431.2[M-H]-。分子式C21H20O10。1H NMR (500 MHz, Pyridine-d5): δ 8.55 (2H, d,J= 8.8 Hz, H-2′′, 6′), 7.38 (2H, d,J= 8.8 Hz, H-3′, 5′), 7.08 (1H, d,J= 2.0 Hz, H-8), 6.83 (1H, d,J= 2.0 Hz, H-6), 6.30 (1H, s, H-1′′), 4.75 (1H, s, H-5′′),4.69 (1H, dd,J= 9.2, 3.3 Hz, H-3′′), 4.41 (1H, t,J=9.3 Hz, H-2′′), 4.31 (1H, dd,J= 9.3, 6.2 Hz, H-4′′),1.65 (3H, d,J= 6.1 Hz, H-6′′);13C NMR (126 MHz,Pyridine-d5): δ 177.93 (C-4), 163.01 (C-5), 162.43(C-7), 161.45 (C-4′), 157.27 (C-9), 148.72 (C-2),138.67 (C-3), 131.17 (C-2′, 6′), 123.57 (C-1′), 116.94(C-3′, 5′), 106.53 (C-10), 100.50 (C-1′′), 100.22 (C-6),95.18 (C-8), 74.08 (C-4′′), 72.93 (C-3′′), 72.18(C-2′′), 71.95 (C-5′′), 19.14 (C-6′′)。该化合物数据与文献[4]报道基本一致,故鉴定为kaempferol-7-Oα-L-rhamnopyranoside。
化合物2:黄色粉末。ESI-MS m/s:431.2[M-H]-。分子式C21H20O10。1H NMR (500 MHz, CD3OD): δ 7.65 (2H, d,J= 8.7 Hz, H-2′, 6′), 6.83 (2H, d,J= 8.7 Hz, H-3′, 5′), 6.24 (1H, d,J= 1.9 Hz, H-8), 6.08 (1H, d,J= 1.9 Hz, H-6), 5.29 (1H, s, H-1′′), 4.16 (1H, dd,J=3.0, 1.6 Hz, H-5′′), 3.64 (1H, dt,J= 6.2, 3.3 Hz, H-2′′),3.26 - 3.24 (2H, m, H-3′′, 4′′), 0.84 (3H, d,J= 5.0 Hz,-CH3);13C NMR (126 MHz, CD3OD): δ 179.48 (C-4),165.89 (C-7), 163.08 (C-5), 161.46 (C-9), 159.14 (C-4′),158.42 (C-2), 136.15 (C-3), 131.87 (C-2′, 6′), 122.58(C-1′), 116.45 (C-3′, 5′), 105.82 (C-1′′), 103.43 (C-10),99.84 (C-6), 94.77 (C-8), 73.17 (C-2′′), 72.06 (C-5′′),71.96 (C-4′′), 71.88 (C-3′′), 17.63 (C-6′′)。该化合物数据与文献[5]报道基本一致,故鉴定为kaempferol-3-O-α-L-rhamnoside。
化合物3:黄色粉末。ESI-MS m/s:417.1[M-H]-。分子式C20H18O10。1H NMR (500 MHz, CD3OD): δ 7.91 (2H, d,J= 8.7 Hz, H-2′, 6′), 6.87 (2H, d,J= 8.7 Hz, H-3′, 5′), 6.35 (1H, s, H-8), 6.17 - 6.14 (1H, m,H-6), 5.44 (1H, s, H-1′′), 4.28 (1H, d,J= 2.3 Hz,H-2′′), 3.86 (1H, dd,J= 5.0, 3.0 Hz, H-3′′), 3.75 (1H, q,J= 4.5 Hz, H-4′′), 3.45 - 3.43 (2H, m, H-5′′);13C NMR (126 MHz, CD3OD): δ 179.89 (C-4), 166.07(C-7), 163.07 (C-5), 161.56 (C-4′), 159.36 (C-9),158.55 (C-2), 134.91 (C-3), 131.98 (C-2′, 6′), 122.76(C-1′), 116.50 (C-3′, 5′), 109.60 (C-1′′), 105.62 (C-10),99.88 (C-6), 94.80 (C-8), 87.99 (C-4′′), 83.34 (C-2′′),78.61 (C-3′′), 62.51 (C-5′′)。该化合物数据与文献[6]报道基本一致,故鉴定为 kaempferol-3-O-α-Larabinofuranoside。
化合物4:白色粉末。ESI-MS m/s:387.1[M-H]-。分子式C21H24O7。1H NMR (500 MHz, CD3OD): δ 6.95 (1H, d,J= 1.8 Hz, H-2′), 6.81 (1H, dd,J= 8.2,1.8 Hz, H-6′), 6.76 (1H, d,J= 8.1 Hz, H-5′), 6.65 (2H,s, H-2, 6), 4.71 (2H, d,J= 4.4 Hz, H-7, 7′), 4.24 (2H,dtd,J= 9.1, 4.7, 2.4 Hz, H-9a, 9′a), 3.88 - 3.86 (2H, m,H-9b, 9′b), 3.85 (3H, s, 3′-OCH3), 3.84 (6H, s, 3,5-OCH3), 3.14 (2H, q,J= 4.7 Hz, H-8, 8′);13C NMR(126 MHz, CD3OD): δ 149.34 (C-3, 5), 149.12 (C-3′),147.32 (C-4′), 136.16 (C-4), 133.77 (C-1′), 133.13(C-1), 120.05 (C-6′), 116.06 (C-5′), 110.95 (C-2′),104.46 (C-2, 6), 87.66 (C-7), 87.48 (C-7′), 72.73 (C-9),72.62 (C-9′), 56.78 (3, 5-OCH3), 56.38 (3′-OCH3),55.56 (C-8), 55.33 (C-8′)。该化合物数据与文献[7]报道基本一致,故鉴定为(+)-medioresinol。
化合物5:浅黄色晶体(甲醇)。ESI-MS m/s:417.3[M-H]-。分子式C22H26O8。1H NMR (500 MHz,CD3OD): δ 6.65 (4H, s, H-2, 2′, 6, 6′), 4.71 (2H, d,J=4.1 Hz, H-7, 7′), 4.26 (2H, dd,J= 8.9, 6.8 Hz, H-9a,9′a), 3.87 (2H, dd,J= 9.1, 3.3 Hz, H-9b, 9′b), 3.84(12H, s, 3, 3′, 5, 5′-OCH3), 3.14 (2H, q,J= 4.5 Hz,H-8, 8′);13C NMR (126 MHz, CD3OD): δ 149.33 (C-3,3′, 5, 5′), 136.16 (C-4, 4′), 133.11 (C-1, 1′), 104.46(C-2, 2′), 87.62 (C-7, 7′), 72.75 (C-9, 9′), 56.78 (C-3,3′, 5, 5′-OCH3), 55.51 (C-8, 8′)。该化合物数据与文献[8]报道基本一致,故鉴定为(+)-syringaresinol。
化合物6:白色晶体(甲醇)。ESI-MS m/s:280.2[M]+。分子式C14H16O6。1H NMR (500 MHz,Pyridine-d5): δ 6.95 (2H, s, H-2, 6), 4.85 (1H, d,J= 6.7 Hz, H-7), 4.50 (1H, dd,J= 9.5, 6.6 Hz, H-12a), 4.45(1H, dd,J= 6.9, 2.7 Hz, H-9a), 4.42 (1H, d,J= 8.6 Hz,H-12b), 4.37 (1H, dd,J= 9.0, 3.7 Hz, H-9b), 3.84 (6H,s, 3, 5-OCH3), 3.65 (1H, td,J= 8.7, 3.6 Hz, H-10),3.28 (1H, dtd,J= 9.0, 6.7, 2.1 Hz, H-11);13C NMR(126 MHz, Pyridine-d5): δ 179.45 (C-14), 149.83 (C-3,5), 138.18 (C-4), 130.64 (C-1), 105.17 (C-2, 6), 87.33(C-7), 70.90 (C-12), 70.86 (C-9), 56.90 (3, 5-OCH3),49.32 (C-11), 47.14 (C-10)。该化合物数据与文献[9]报道基本一致,故鉴定为zhepiresinol。
化合物 7 : 黄色粉末。 ESI-MS m/s :177.0[M-H]-。分子式C10H10O3。1H NMR (500 MHz,CD3OD): δ 9.53 (1H, d,J= 7.9 Hz, H-9), 7.54 (1H, d,J= 15.7 Hz, H-7), 7.21 (1H, d,J= 1.8 Hz, H-2), 7.13(1H, dd,J= 8.2, 1.8 Hz, H-6), 6.82 (1H, d,J= 8.2 Hz,H-5), 6.61 (1H, dd,J= 15.7, 7.9 Hz, H-8), 3.87 (3H, s,-OCH3);13C NMR (126 MHz, CD3OD): δ 196.18(C-9), 156.35 (C-7), 152.05 (C-4), 149.57 (C-3),127.43 (C-1), 126.54 (C-8), 125.25 (C-6), 116.70(C-5), 112.05 (C-2), 56.42 (-OCH3)。该化合物数据与文献[10]报道基本一致,故鉴定为4-hydroxy-3-methoxycinnamaladehyde。
化合物8:黄色无定形粉末。ESI-MS m/s:171.2[M+Na]+。分子式C9H8O2。1H NMR (500 MHz,CD3OD): δ 9.55 (1H, d,J= 7.9 Hz, H-9), 7.59 (1H, d,J= 15.7 Hz, H-1), 7.53 (2H, d,J= 8.7 Hz, H-2, 6),6.82 (2H, d,J= 8.7 Hz, H-3, 5), 6.60 (1H, dd,J= 15.7,7.9 Hz, H-8);13C NMR (126 MHz, CD3OD): δ 196.22(C-9), 163.60 (C-4), 156.34 (C-7), 132.12 (C-2, 6),126.49 (C-1), 125.95 (C-8), 117.42 (C-3, 5)。该化合物数据与文献[11]报道基本一致,故鉴定为trans-pcoumaryl aldehyde。
化合物9:白色粉末。ESI-MS m/s:193.0[M+H]+。分子式C11H12O3。1H NMR (500 MHz, CDCl3): δ 9.67(1H, d,J= 7.7 Hz, H-9), 7.42 (1H, d,J= 15.8 Hz,H-7), 7.17 (1H, dd,J= 8.3, 1.8 Hz, H-6), 7.08 (1H, d,J= 1.8 Hz, H-2), 6.91 (1H, d,J= 8.3 Hz, H-5), 6.62(1H, dd,J= 15.8, 7.7 Hz, H-8), 3.94 (3H, s, 3-OCH3),3.93 (3H, s, 4-OCH3);13C NMR (126 MHz, CDCl3): δ 193.75 (C-9), 153.02 (C-7), 152.10 (C-4), 149.50(C-3), 127.17 (C-1), 126.85 (C-6), 123.60 (C-8),111.22 (C-2), 109.93 (C-5), 56.18 (3-OCH3), 56.07(4-OCH3)。该化合物数据与文献[12]基本一致,故鉴定为(E)-3-(3,4-dimethoxyphenyl) acrylaldehyde。
化合物 10:白色油状物。ESI-MS m/s:217.0[M+Na]+。分子式C11H14O3。1H NMR (500 MHz,CD3OD): δ 7.02 (1H, d,J= 1.8 Hz, H-2), 6.93 (1H, dd,J= 8.3, 1.9 Hz, H-6), 6.87 (1H, d,J= 8.3 Hz, H-5),6.52 (1H, d,J= 15.8 Hz, H-7), 6.23 (1H, dt,J= 15.8,5.8 Hz, H-8), 4.19 (2H, dd,J= 5.8, 1.4 Hz, H-9), 3.83(3H, s, 3-OCH3), 3.81 (3H, s, 4-OCH3);13C NMR (126 MHz, CD3OD): δ 150.51 (C-3), 150.23 (C-4), 131.77(C-1), 131.61 (C-7), 127.98 (C-8), 120.84 (C-6), 112.84(C-5), 110.61 (C-2), 63.80 (C-9), 56.42 (3-OCH3),56.39 (4-OCH3)。该化合物数据与文献[13]报道基本一致,故鉴定为3,4-dimethoxycinnamyl alcohol。
化合物 11:黄色油状物。ESI-MS m/s:225.0[M+H]+。分子式C12H16O4。1H NMR (500 MHz,CD3OD): δ 6.71 (2H, s, H-2, 6), 6.53 (1H, d,J= 15.8 Hz, H-7), 6.30 (1H, dt,J= 15.8, 5.7 Hz, H-8), 4.21(2H, dd,J= 5.7, 1.5 Hz, H-9), 3.84 (6H, s, 3, 5-OCH3),3.74 (3H, s, 4-OCH3);13C NMR (126 MHz, CD3OD):δ 154.58 (C-3, 5), 138.72 (C-4), 134.63 (C-1), 131.55(C-7), 129.61 (C-8), 104.77 (C-2, 6), 63.62 (C-9),61.14 (4-OCH3), 56.54 (3, 5-OCH3)。该化合物数据与文献[13]报道基本一致, 故鉴定 3,4,5-trimethoxycinnamyl alcohol。
化合物 12:白色油状物。ESI-MS m/s:187.0[M+Na]+。分子式C10H12O2。1H NMR (500 MHz,CD3OD): δ 7.42 (1H, dd,J= 7.6, 1.6 Hz, H-6), 7.21 -7.17 (1H, m, H-4), 6.94 - 6.86 (3H, m, H-3, 5, 7), 6.33(1H, dt,J= 16.0, 5.8 Hz, H-8), 4.20 (2H, dd,J= 5.8,1.6 Hz, H-9), 3.81 (3H, s, 2-OCH3);13C NMR (126 MHz, CD3OD): δ 158.20 (C-2), 130.19 (C-7), 129.69(C-4), 127.71 (C-8), 127.11 (C-1), 126.65 (C-6),121.63 (C-5), 112.00 (C-3), 64.18 (C-9), 55.88(2-OCH3)。该化合物数据与文献[14]报道基本一致,故鉴定为trans-2-methoxycinnamyl alcohol。
化合物 13:黄色油状物。ESI-MS m/s:157.0[M+Na]+。分子式C9H10O。1H NMR (500 MHz,CDCl3): δ 7.39 (2H, d,J= 7.4 Hz, H-3, 5), 7.32 (2H, t,J= 7.6 Hz, H-2, 6), 7.24 (1H, t,J= 7.3 Hz, H-4), 6.61(1H, d,J= 15.9 Hz, H-7), 6.37 (1H, dt,J= 15.9, 5.7 Hz,H-8), 4.32 (2H, dd,J= 5.7, 1.3 Hz, H-9);13C NMR(126 MHz, CDCl3): δ 136.78 (C-1), 131.27 (C-7),128.72 (C-3, 5), 128.61 (C-4), 127.83 (C-8), 126.59(C-2, 6), 63.85 (C-9)。该化合物数据与文献[15]报道基本一致,故鉴定为cinnamyl alcohol。
化合物14:白色油状物。分子式C13H18O3,分子量222。1H NMR (500 MHz, CD3OD): δ 7.04 (1H, d,J= 1.9 Hz, H-6), 6.94 (1H, dd,J= 8.3, 1.9 Hz, H-2),6.89 (1H, d,J= 8.3 Hz, H-5), 6.55 (1H, d,J= 15.9 Hz,H-7), 6.19 (1H, dt,J= 15.8, 6.2 Hz, H-8), 4.11 (2H, dd,J= 6.2, 1.4 Hz, H-9), 3.84 (3H, s, 3-OCH3), 3.82 (3H,s, 4-OCH3), 3.55 (2H, q,J= 7.0 Hz, -CH2-), 1.21 (3H,t,J= 7.0 Hz, -CH3);13C NMR (126 MHz, CD3OD): δ 150.56 (C-3), 150.43 (C-4), 133.63 (C-7), 131.51 (C-1),125.05 (C-8), 120.99 (C-6), 112.83 (C-5), 110.64 (C-2),72.37 (C-9), 66.58 (-CH2-), 56.43 (3-OCH3), 56.41(4-OCH3), 15.45 (-CH3)。该化合物数据与文献[16]报道基本一致,故鉴定为1,2-dimethoxy-4-(3-ethoxy-1E-propenyl)-benzene。
化合物 15:白色油状物。ESI-MS m/s:215.0[M+Na]+。分子式C11H12O3。1H NMR (500 MHz,CD3OD): δ 7.35 (1H, d,J= 6.7 Hz, H-6), 7.05 (1H, t,J= 7.0 Hz, H-4), 6.92 (1H, d,J= 16.1 Hz, H-7), 6.78(1H, d,J= 4.1 Hz, H-5), 6.76 (1H, d,J= 4.9 Hz, H-3),6.32 (1H, dt,J= 16.0, 6.5 Hz, H-8), 4.69 (2H, d,J=6.4 Hz, H-9), 2.05 (3H, s, -CH3);13C NMR (126 MHz,CD3OD): δ 172.80 (C=O), 156.22 (C-2), 130.69 (C-4),129.94 (C-6), 128.18 (C-7), 124.58 (C-8), 123.91 (C-5),120.62 (C-3), 116.57 (C-1), 66.88 (C-9), 20.89 (-CH3)。该化合物数据与文献[17]报道基本一致,故鉴定为cryptamygin-A。
化合物 16:黄色油状物。ESI-MS m/s:222.0[M]+。分子式C12H14O4。1H NMR (500 MHz,CD3OD): δ 7.59 (1H, d,J= 15.9 Hz, H-7), 7.17 (1H, d,J= 1.9 Hz, H-2), 7.05 (1H, dd,J= 8.2, 1.9 Hz, H-5),6.79 (1H, d,J= 8.2 Hz, H-6), 6.33 (1H, d,J= 15.9 Hz,H-8), 4.21 (2H, q,J= 7.1 Hz, -CH2-), 3.88 (3H, s,3-OCH3), 1.31 (3H, d,J= 7.1 Hz, -CH3);13C NMR(126 MHz, CD3OD): δ 169.35 (C-9), 151.07 (C-3),149.51 (C-4), 146.71 (C-7), 127.47 (C-1), 124.14 (C-6),116.56 (C-5), 115.41 (C-8), 111.61 (C-2), 61.41 (-CH2-),56.40 (3-OCH3), 14.64 (-CH3)。该化合物数据与文献[18]报道基本一致,故鉴定为ethyl ferulate。
化合物 17:白色粉末。ESI-MS m/s:166.1[M-H]-。分子式C9H10O3。1H NMR (500 MHz,CD3OD): δ 7.85 (2H, d,J= 8.8 Hz, H-2, 6), 6.80 (2H,d,J= 8.8 Hz, H-3, 5), 4.29 (2H, q,J= 7.1 Hz, -OCH2-),1.35 (3H, t,J= 7.1 Hz, -CH3);13C NMR (126 MHz,CD3OD): δ 168.28 (C=O), 163.65 (C-4), 132.69 (C-2,6), 122.39 (C-1), 116.17 (C-3, 5), 61.66 (-OCH2-),14.66 (-CH3)。该化合物数据与文献[19]报道基本一致,故鉴定为p-hydroxybenzoic acid ethyl ester。
化合物18:白色结晶(甲醇)。ESI-MS m/s:169.0[M+Na]+。分子式C9H6O2。1H NMR (500 MHz,CDCl3): δ 7.73 (1H, d,J= 9.5 Hz, H-4), 7.56-7.51 (1H,m, H-5), 7.50 (1H, d,J= 7.7 Hz, H-7), 7.33 (1H, d,J=8.3 Hz, H-6), 7.31-7.27 (1H, m, H-8), 6.43 (1H, dd,J= 9.5, 1.5 Hz, H-3);13C NMR (126 MHz, CDCl3): δ 160.89 (C-2), 154.08 (C-9), 143.58 (C-4), 131.91 (C-7),127.97 (C-5), 124.52 (C-6), 118.89 (C-10), 116.92(C-8), 116.71 (C-3)。该化合物数据与文献[20]报道基本一致,故鉴定为coumarin。
化合物 19:淡黄色粉末。ESI-MS m/s:177.0[M-H]-。分子式C9H6O4。1H NMR (500 MHz,CD3OD): δ 7.94 (1H, d,J= 5.9 Hz, H-2), 6.30 (1H, d,J= 2.1 Hz, H-3), 6.17 (1H, d,J= 2.1 Hz, H-8), 6.16(1H, d,J= 6.0 Hz, H-6);13C NMR (126 MHz,CD3OD): δ 183.35 (C-4), 167.87 (C-7), 163.45 (C-5),159.93 (C-9), 158.10 (C-2), 111.61 (C-3), 107.19(C-10), 100.34 (C-6), 95.16 (C-8)。该化合物数据与文献[21]报道基本一致, 故鉴定为 5,7-dihydroxychromone。
化合物 20:棕色粉末。ESI-MS m/s:169.0[M+H]+。分子式C8H8O4。1H NMR (500 MHz,CDCl3): δ 5.85 (2H, s, H-3, 5), 3.82 (6H, s, 2,6-OCH3);13C NMR (126 MHz, CDCl3):δ 186.99(C-1), 176.83 (C-4), 157.44 (C-2, 6), 107.56 (C-3, 5),56.63 (2, 6-OCH3)。该化合物数据与文献[22]报道基本一致,故鉴定为2,6-dimethoxyquinone。
化合物21:淡黄色针晶(甲醇)。ESI-MS m/s:169.0[M+H]+。分子式C8H8O4。1H NMR (500 MHz,Acetone-d6): δ 5.90 (2H, s, H-3, 6), 3.82 (6H, s, 2,5-OCH3);13C NMR (126 MHz, Acetone-d6): δ 187.51(C-1, 4), 158.50 (C-2, 5), 107.83 (C-3, 6), 56.80 (2,5-OCH3)。该化合物数据与文献[23]报道基本一致,故鉴定为2,5-dimethoxybenzoquinone。
化合物 22:黄色油状物。ESI-MS m/s:231.2[M+Na]+。分子式C13H20O2。1H NMR (500 MHz,CD3OD): δ 6.74 (1H, dd,J= 15.8, 9.6 Hz, H-7), 6.10(1H, d,J= 15.8 Hz, H-8), 5.54 (1H, s, H-4), 4.15 (1H,dd,J= 9.5, 4.8 Hz, H-3), 2.33 (1H, d,J= 9.6 Hz, H-6),2.24 (3H, s, 10-CH3), 1.62 - 1.61 (3H, m, 13-CH3),1.59 (1H, d,J= 6.7 Hz, H-2a), 1.42 (1H, dd,J= 12.9,9.9 Hz, H-2b), 0.97 (3H, s, 11-CH3), 0.87 (3H, s,12-CH3);13C NMR (126 MHz, CD3OD): δ 200.97(C-9), 150.24 (C-7), 136.05 (C-5), 133.45 (C-8),127.74 (C-4), 66.89 (C-3), 55.46 (C-6), 41.00 (C-2),35.88 (C-1), 29.57 (C-10), 27.20 (C-11), 27.00 (C-12),22.59 (C-13)。该化合物数据与文献[24]报道基本一致,故鉴定为 (3R,6R,7E)-3-hydroxy-4,7-megastigmadien-9-one。
化合物23:白色无定形粉末。ESI-MS m/s:241.2[M+H]+。分子式C15H28O2。1H NMR (500 MHz,CD3OD): δ 2.22 - 2.17 (1H, m, H-6β), 1.96 (1H, d,J=10.8 Hz, H-8α), 1.74 (1H, dd,J= 12.6, 1.5 Hz, H-3β),1.64 - 1.62 (1H, m, H-2), 1.61 (1H, d,J= 4.0 Hz,H-9β), 1.58 (1H, t,J= 3.4 Hz, H-7α), 1.55 (1H, t,J=3.2 Hz, H-1α), 1.46 (1H, d,J= 3.3 Hz, H-6α), 1.43(1H, t,J= 2.9 Hz, H-3α), 1.35 (1H, d,J= 3.0 Hz,H-5β), 1.31 (1H, d,J= 3.4 Hz, H-9α), 1.23 (1H, dd,J=12.5, 2.3 Hz, H-1β), 1.18 (3H, s, 12-CH3), 1.17 (3H, s,13-CH3), 1.09 (3H, s, 14-CH3), 1.04 (1H, d,J= 12.1 Hz,H-8β), 0.89 (3H, s, 15-CH3);13C NMR (126 MHz,CD3OD): δ 73.53 (C-11), 73.10 (C-4), 55.67 (C-5),51.26 (C-7), 46.09 (C-9), 44.15 (C-3), 42.33 (C-1),35.60 (C-10), 27.50 (C-12), 26.85 (C-13), 23.50 (C-14),22.81 (C-8), 22.48 (C-6), 21.13 (C-2), 19.23 (C-5)。该化合物数据与文献[25]报道基本一致,故鉴定为cryptomeridiol。
化合物 24:黄色固体。ESI-MS m/s:256.2[M+H2O]+。分子式C15H26O2。1H NMR (500 MHz,CDCl3): δ 1.89 - 1.55 (8H, m, H-1, 2, 3, 8, 9), 1.25 (3H,s, H-14), 1.20 (1H, d,J= 10.6 Hz, H-5), 1.17 (3H, s,H-15), 1.03 (6H, s, H-12, 13), 0.95 - 0.86 (1H, m, H-8),0.64 (1H, ddd,J= 11.1, 9.5, 6.2 Hz, H-7), 0.42 (1H, dd,J= 10.8, 9.5 Hz, H-6);13C NMR (126 MHz, CDCl3): δ 80.51 (C-4), 75.19 (C-10), 56.47 (C-1), 48.56 (C-5),44.59 (C-9), 41.27 (C-3), 28.80 (C-12), 28.37 (C-6),26.72 (C-7), 24.64 (C-14), 23.92 (C-2), 20.46 (C-15),20.32 (C-8), 19.71 (C-11), 16.62 (C-13)。该化合物数据与文献[26]报道基本一致, 故鉴定为acomadendrane-4β,10β-diol。
化合物 25:白色油状物。ESI-MS m/s:168.0[M+Na]+。分子式C9H7NO。1H NMR (500 MHz,CD3OD): δ 9.87 (1H, s, -CHO), 8.14 (1H, d,J= 7.5 Hz,H-4), 8.08 (1H, s, H-2), 7.46 (1H, d,J= 7.9 Hz, H-7),7.24 (2H, dtd,J= 20.3, 7.3, 1.1 Hz, H-5, 6);13C NMR(126 MHz, CD3OD): δ 187.42 (-CHO), 139.71 (C-2),138.94 (C-8), 125.71 (C-9), 125.00 (C-4), 123.61 (C-6),122.40 (C-5), 120.12 (C-3), 113.13 (C-7)。该化合物数据与文献[27]报道基本一致,故鉴定为1H-indole-3-carboxaldehyde。
2.2 阴香叶化学成分的抗菌活性
实验发现,除化合物20 和21 对金黄色葡萄球菌具有较好的抑制效果(最小抑菌浓度均为32 μmol·L-1)外,其余23 个化合物在测定浓度(64 μmol·L-1)下对金黄色葡萄球菌均未表现出抑菌活性;此外,在测定浓度(64 μmol·L-1)下,所有化合物对大肠杆菌均未表现出抑菌活性。化合物20 的最小杀菌浓度为64 μmol·L-1,化合物 21 的最小杀菌浓度为32 μmol·L-1,证明化合物21 具有更好的杀菌效果。图2 显示,在2 倍最小抑菌浓度、最小抑菌浓度下12 h 之后,化合物20 的吸光度值明显增高,测试菌种大量增长,而化合物21 的吸光度值变化不如化合物20 的明显,证明化合物21 具有更强的抑菌活性。

图2 化合物20(左)和21(右)的抑菌动力学曲线Fig. 2 Antibacterial kinetic curves of compounds 20 (left) and 21 (right)
2.3 阴香叶化学成分的抗炎活性
从图3 和图4 可见,与模型组对比,化合物5、6、7 浓度为20 μmol·L-1时可抑制LPS 诱导的BV2细胞的NO 生成量,具有抗炎活性,其IC50值分别为7.85 μmol·L-1、24.97 μmol·L-1、7.49 μmol·L-1,无细胞毒性。
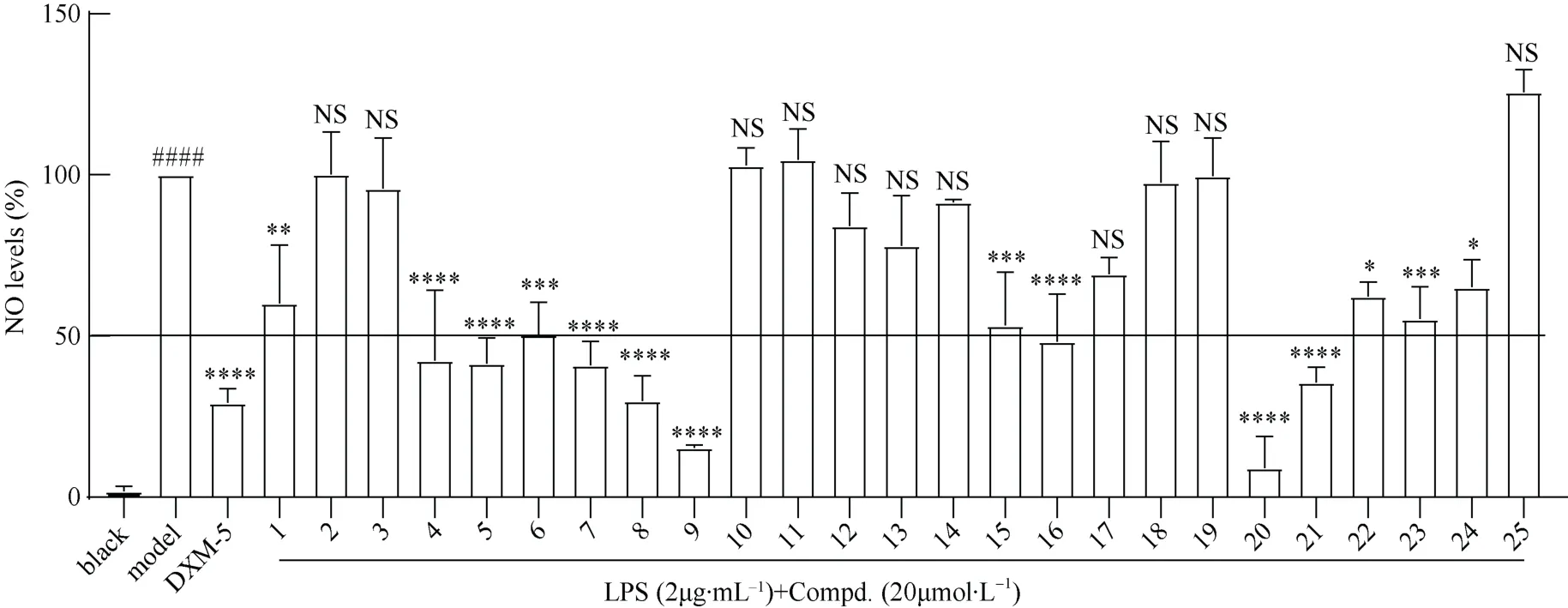
图3 化合物对LPS 诱导BV2 细胞产生NO 的影响(20 μmol·L-1)Fig. 3 Effects of compounds on LPS-induced NO production in BV2 cells (20 μmol·L-1)

图4 化合物的MTT 细胞毒性Fig. 4 MTT cytotoxicity of compounds isolated from Cinnamomum burmanni leaves
3 结论与讨论
从阴香叶的95%乙醇提取物中分离鉴定了25个化合物,包括黄酮类化合物(1~3)、木脂素类化合物(4~6)、简单苯丙素类化合物(7~16)、香豆素类化合物(18)、苯醌类化合物(20~21)、倍半萜类化合物(22~24)和一个吲哚生物碱(25)。除化合物1、2、5、18 外,其余均为首次从阴香中分离得到。
抗菌实验显示,化合物20 和21 对金黄色葡萄球菌表现出较好的抑菌活性(MIC 值)。发现含甲氧基的苯醌类化合物抗菌活性较强,对革兰氏阳性菌更有效,与文献[28]的结论一致。未见有关这两个化合物抑菌动力学的报道。
抗炎实验表明,化合物5、6、7 的IC50值分别为7.85 μmol·L-1、24.97 μmol·L-1、7.49 μmol·L-1,均可抑制LPS 诱导的BV2 细胞NO 的生成,表现出较好的抗炎活性,且无细胞毒性,与Lee 等[29]的研究基本一致。Bajpai 等[30]研究了化合物5 对LPS 诱导的RAW 264.7 细胞的抗炎机制。Jin 等[31]发现化合物7 浓度为3 μmol·L-1时仍可抑制LPS 诱导的RAW 264.7 细胞的NO、肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)的产生,且对RAW 264.7 细胞的毒性较小。Kim 等[32]发现化合物7 可通过阻断LPS 诱导的C-Jun 氨基末端激酶(JNK)和NF-κB 通路的激活,以剂量依赖的方式显著减少LPS 诱导产生的过量iNOS 和 NO,发挥抗炎作用。关于化合物6 的抗炎机制未见报道。化合物5、6 和7 对LPS 诱导的BV2细胞的抗炎机制有待进一步研究。
本研究结果丰富了阴香叶的化学成分和生物活性成分,为其开发利用提供了科学依据。
