肝动脉灌注化疗栓塞术联合信迪利单抗治疗晚期原发性肝癌近期疗效及远期生存率
2024-01-26覃雪丁莉蒋蜀梅
覃雪,丁莉,蒋蜀梅
作者单位:1资阳市人民医院肿瘤科,四川 资阳 641300;2广安市人民医院骨科,四川 广安 638000
原发性肝癌(primary liver cancer,PLC)是中老年人群较为常见的恶性肿瘤,据国家癌症中心:2022 年全国癌症报告的数据显示,PLC 的发病率占所有恶性肿瘤的第4 位,而病死率则高居第2 位[1]。手术是PLC 病人首选的治疗方式,但多数病人在确诊时没有手术指征,因此需要采取其他方案。肝动脉灌注化疗栓塞术(transarterial chemoembolisation,TACE)是对股动脉插管,导管向上走行经腹腔动脉至肝周动脉将化疗药物注入到病灶的手术疗法,具有微创、安全性高等特点[2-3]。单纯TACE 治疗无法有效杀灭病灶周围肿瘤细胞,因此病人远期预后较差。信迪利单抗是一种靶向程序性死亡受体-1(PD-1)的全人源化IgG4单克隆抗体,目前已被证实可以用于非小细胞肺癌(NSCLC)、淋巴瘤等的治疗中[4]。有研究[5]发现其在早期肝癌治疗中应用重度毒副反应风险较低,但目前尚未有晚期PLC 的临床报道。基于此,本研究主要分析TACE 联合PD-1 在晚期PLC治疗的中近远期价值,报告如下。
1 资料与方法
1.1 一般资料选取2018 年4 月至2019 年4 月资阳市人民医院收治的晚期PLC 病人82例,按照随机数字表法分成对照组与研究组,各41 例。纳入标准:①经美国肝病研究协会(AASLD)指南诊断为PLC,巴塞罗那(BCLC)分期为B 期、C 期者;②年龄范围为18~80岁,临床资料及影像学资料完整;③肝功能Child-Pugh分级A级、B级;④均为一线治疗;⑤对实验知情且自愿签署同意书者;⑥接受出院后随访调查者;⑦经资阳市人民医院伦理委员会批准实施(批号KY2018-054)。排除标准:①继发性肝癌病人;②合并严重凝血功能障碍者;③采用其他靶向药物及化疗方案的病人;④心、肾等重要脏器功能障碍者。两组病人的基线资料比较,差异无统计学意义(P>0.05)。见表1。
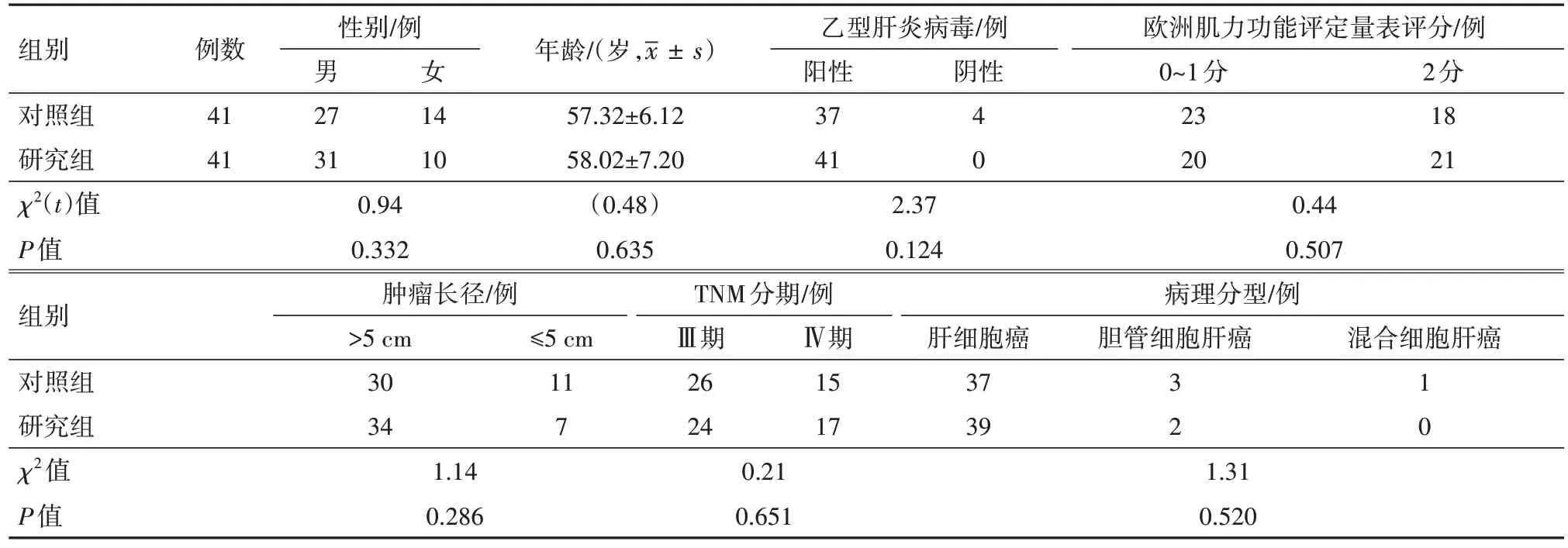
表1 原发性肝癌82例基线资料比较
1.2 方法对照组病人采用TACE术治疗。使用改良Seldinger's 技术,经皮穿刺股动脉、插管,选择腹腔动脉至肝动脉造影,明确肿瘤灶的部位、大小及血供等情况。取顺铂(齐鲁制药有限公司,批号H37021358,批次200254302)60 mg+吉西他滨(江苏豪森药业,批号H20030104)1.2 g,使用生理盐水稀释,经介入热化疗设备加热至60 ℃,以0.6 mL/s的速度经导管注入病灶供血动脉,注射时间为30 min。取吡柔比星(深圳万乐药业,批号H10930105)40 mg溶入20 mL 碘化油(40%)制作成乳剂,经导管注入。依据病人血管状态使用明胶海绵栓塞,治疗频率为3 周/次,耐受性差者调整为4 周/次,连续治疗2~3次。研究组在TACE 术后4 d 开始基础上使用信迪利单抗(信达生物制药,批号S20180016,批次DP2203004)治疗,静脉滴注信迪利单抗200 毫克/次,治疗时间同TACE疗程。
1.3 疗效评估标准分别于治疗后1 个月、3 个月时依据实体瘤疗效评价标准[6](mRECIST)对两组病人的疗效进行评估。完全缓解(complete response,CR):影像学检查显示靶病灶动脉期增强消失;部分缓解(partial response,PR):有活性的靶病灶动脉期增强显影最长径之和减小>30%;疾病进展(disease progression,PD):靶病灶动脉期增强显影最长径之和增加≥20%,或显示新癌灶;病情稳定(stable disease,SD):靶病灶最长径之和缩减标准PR,或增加幅度未达PD。肿瘤控制率(disease control rate,DCR)=(CR+PR+SD)/n×100%。
1.4 观察指标(1)肿瘤标志物水平检测:分别于治疗前、治疗后采集病人外周血液3 mL,3 000 r/min离心15 min 后取上层清液放置于试管中,保存在-20 ℃冰箱中待检。使用ELISA 法检测血清中甲胎蛋白(α-fetoprotein,AFP)、高尔基体蛋白73(golgin-73,GP-73)及甲胎蛋白异质体3(α-fetoprotein L3,AFP-L3)的水平,严格按照试剂盒说明书操作。(2)免疫功能指标检测:分别于TACE 治疗前及治疗结束后于空腹状态采集肘静脉血3 mL,使用FACSCalibur 流式细胞仪(美国BD 公司)分别测定T 淋巴细胞亚群(CD4+、CD8+、CD4+/CD8+)及肿瘤抑制分子(CD9、CD63)水平。(3)预后生存情况。术后随访36~48 个月,绘制Kaplan-Meier(K-M)曲线计算两组病人中危生存期及总生存率差异。
1.5 统计学方法采用SPSS25.0 统计学软件分析研究中的各项数据,DCR 率、生存率等计数资料用例(%)表示,组间行χ2检验;符合正态分布的计量资料用x±s表示,组间行t检验,绘制K-M 曲线分析两组病人中位生存时间及总生存率,采用Log-rank检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 两组近期疗效比较治疗后1 个月时研究组DCR 为92.68%,对照组为80.49%(χ2=2.63,P=0.105);治疗后3个月时研究组DCR为87.80%,明显高于对照组的73.17%(χ2=4.00,P=0.046),见表2。
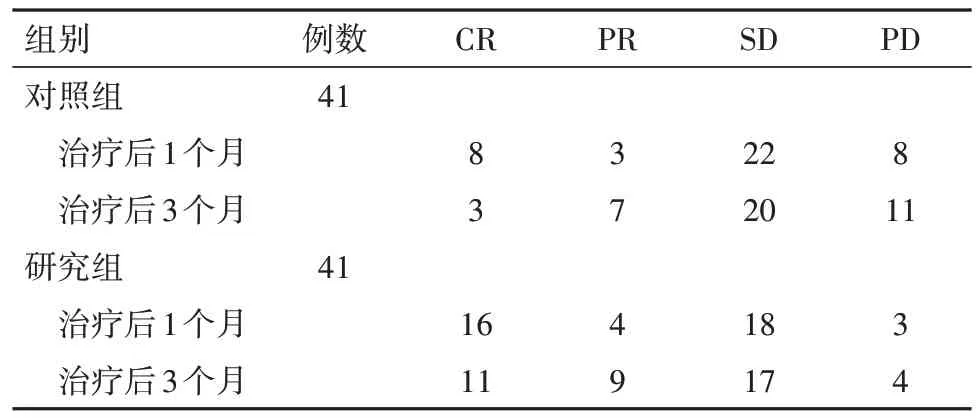
表2 原发性肝癌82例近期疗效比较/例
2.2 两组治疗前后血清肿瘤标志物水平比较治疗前,两组间血清AFP、GP-73 及AFP-L3 水平差异无统计学意义(P>0.05);治疗后两组三种指标水平均下降(P<0.05),研究组AFP、GP-73及AFP-L3项指标水平低于对照组(P<0.05)。见表3。

表3 原发性肝癌82例治疗前与治疗后血清AFP、GP-73及AFP-L3水平比较/x ± s
2.3 两组治疗前后免疫功能指标比较
2.3.1两组治疗前后T淋巴细胞亚群指标比较 治疗前,两组CD4+、CD8+、CD4+/CD8+水平差异无统计学意义(P>0.05);治疗后,研究组CD4+、CD4+/CD8+水平高于对照组,差异有统计学意义(P<0.05),CD8+水平组间差异无统计学意义(P>0.05)。见表4。
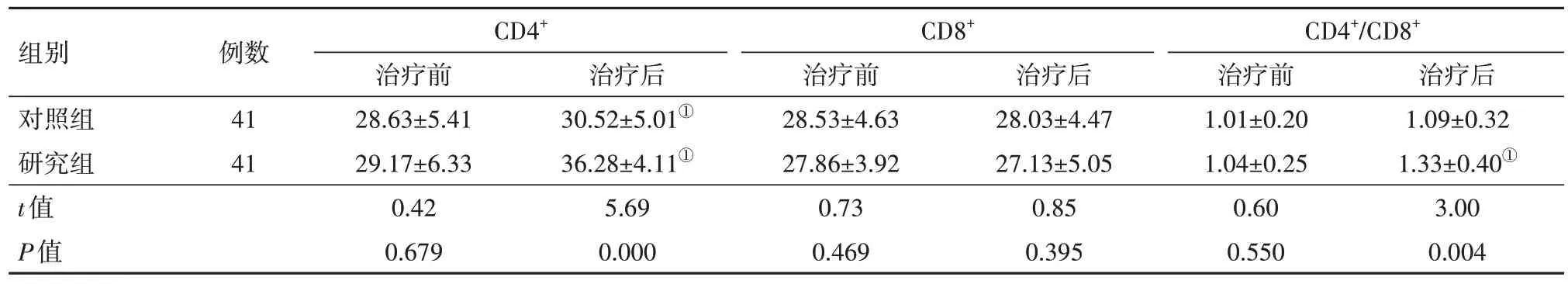
表4 原发性肝癌82例治疗前与治疗后组间免疫功能指标比较/(%,x ± s)
2.3.2两组治疗前后肿瘤促进/抑制分子水平比较 治疗前两组CD151、CD168 等肿瘤促进分子,CD9、CD63 等肿瘤抑制分子水平比较,差异无统计学意义(P>0.05),治疗后研究组肿瘤促进分子水平显著低于对照组,而肿瘤抑制分子水平则高于对照组(P<0.05)。见表5。
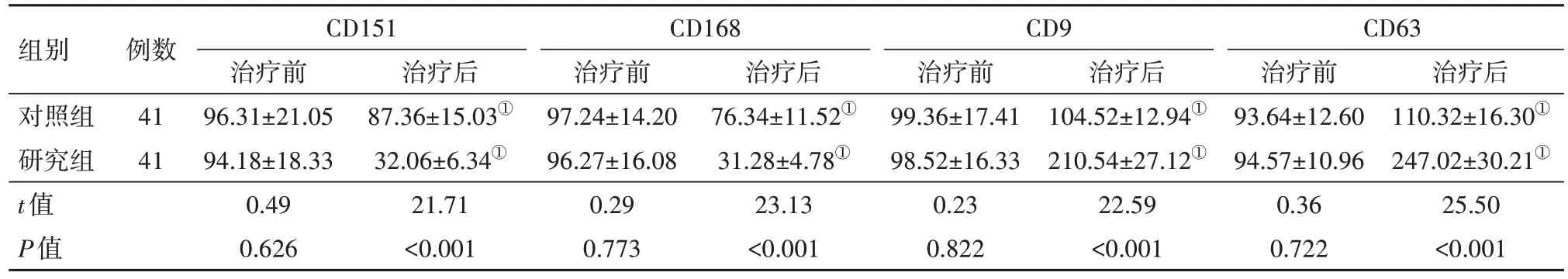
表5 原发性肝癌82例治疗前后免疫分子水平比较/(%,x ± s)
2.4 两组预后生存情况比较治疗后随访36~48个月,随访期中位数41 个月。研究组失访3 例,末次随访时研究组总生存率为47.37%(18/38);对照组失访1例,总生存率为25.0%(10/40),研究组略高于对照组(χ2=4.24,P=0.040)。
2.5 两组安全性比较截至末次随访时,发生率>10%的毒副反应包括恶心/呕吐、腹泻、高血压、食欲下降、ALT 升高及手足综合征,组间发生率比较,差异无统计学意义(P>0.05);研究组≥3 级毒副反应总发生率为13.16%,与对照组27.5%差异无统计学意义(χ2=2.46,P=0.117),见表6。
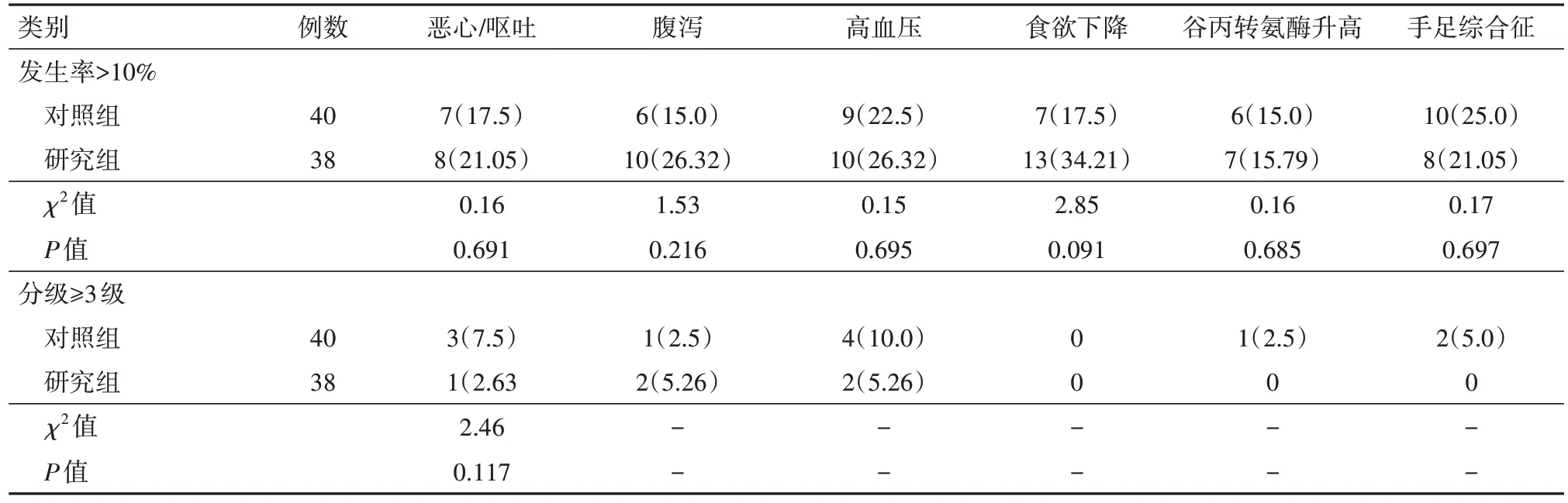
表6 原发性肝癌治疗后毒副反应情况比较/例(%)
3 讨论
流行病学调查显示,不同地区肝癌患病率有明显的差异性,除了甲型肝病毒、乙型肝病毒感染、酒精性肝炎等肝病外,环境因素亦是发病的独立危险因素[7-8]。目前,临床治疗早期PLC 的方法主要为手术切除法,没有手术指征病人可采用局部消融、介入及放化疗等综合疗法。对于晚期PLC 病人而言,一方面受癌细胞的影响机体损伤非常严重,缺乏手术指征;另一方面病人治疗失去了彻底治愈的可能性,绝大多数诉求是延长生存时间、改善其生活质量,因此主要采用药物治疗为主。TACE 是目前公认治疗肝癌最有效的非手术疗法,其优势在于能够让肿瘤细胞发生血氧缺失性坏死,抑制癌细胞分化阻碍病情的进展[9];此外,TACE 术式的微创化特性不会引发组织粘连,同时降低脏器组织损伤程度从而避免肝功衰竭等发生风险[10]。但血氧缺失又会引起癌细胞发生缺氧反应基因转录、表达,诱导血管内皮细胞生长因子表达上调,促使新生血管生成导致癌症转移或复发,因此单一TACE 治疗晚期PLC的效果不甚理想[11]。信迪利单抗是一种靶向程序性死亡受体-1(PD-1)的全人源化IgG4 单克隆抗体,其原理是通过拮抗PD-1 受体与配体的结合路径,激发机体免疫细胞的活性从而杀灭肿瘤细胞[12]。
本研究结果显示,治疗后研究组病人近期DCR率均高于对照组;相较于治疗后1 个月时,治疗后3个月两组病人DCR 均明显降低,对照组病人的降幅明显高于研究组。原因可能是TACE 术上调了血管内皮细胞因子水平,增加了癌细胞转移/复发风险[13],信迪利单抗则阻断了PD-1/PD-L1 通路,快速激活T 淋巴细胞的抗肿瘤活性[14],与TACE 联合使用降低了术后PLC 细胞复发转移风险。丁晓鹏等[15]的一项TACE 联合抗血管生成药物及PD-1 抑制剂治疗中晚期肝癌的研究中的DCR 为85.7%,与本研究结果基本一致。
AFP是一种与人机体生长发育关系密切的糖蛋白,是目前诊断评估肝癌主要的血清标志物之一[16]。AFP-L3 是AFP 的一种异质体,与AFP-L1、AFP-L2 等异质体不同,其主要来源于肝癌细胞中,对肝细胞癌检测的特异性高达95%以上[17]。GP73是存在高尔基体的一种跨膜蛋白,在PLC 组织中呈特异性高表达状态[18]。本研究显示,治疗后观察组血清AFP,AFP-L3 与GP73 水平明显低于对照组,说明TACE 手术能够有效清除PLC 细胞,PD-1 阻断PD-1/PD-L1信号通路后唤醒了几乎耗竭的T淋巴细胞增殖,并且大量分泌肿瘤抑制因子消除PLC 细胞[19]。戴斌等[20]的研究发现,PD-1 抑制剂可以影响晚期非小细胞肺癌病人抑制性免疫检查点的表达,改善T 淋巴细胞免疫功能。本研究结果显示,治疗后研究组病人CD4+、CD4+/CD8+水平均显著升高,与以往相关研究相一致。此外,研究组肿瘤抑制因子(CD9、CD63)水平均明显升高,而肿瘤促进分子CD151 及CD168 水平则明显下降,与Martin 等[21]的研究结果吻合,进一步验证了PD-1在治疗PLC 的相关作用机理。晚期PLC 远期生存率是临床治疗中最为重要的预后指标之一,治疗后随访期研究组病人总生存率为47.37%,远高于对照组的25.0%。Zhang 等[22]的研究也表示晚期肝细胞癌合并门静脉血栓形成采用免疫检查点抑制剂联合TACE 治疗的无进展生存率及总生存率更高;在安全性方面,研究组病人≥3 级毒副反应发生率略低于对照组。由此表明,提示TACE 联合PD-1 治疗晚期PLC 更有助于提高病人的机体免疫力,延长病人的生存时间,降低重度毒副反应发生情况,提升治疗的安全性。本研究的不足:(1)由于病人数量有限样本量较少导致研究结果的可靠性和普适性受到影响;(2)由于研究的时间范围有限难以评估治疗的远期效果和生存率;(3)研究可能存在病人选择的偏差,例如可能有部分病人具有较好的耐受性和预后导致结果的偏倚性。
综上所述,TACE 联合PD-1 治疗晚期PLC 可降低机体肿瘤标志物水平、提升病人的免疫功能及近期疗效,同时可延长病人远期生存率,值得推广。
