糖尿病足合并类鼻疽伯克霍尔德菌感染64例临床特征、药敏特点和治疗分析
2024-01-26陈宗存符沙沙陈金逸赖舒畅符茂雄
陈宗存,符沙沙,陈金逸,赖舒畅,符茂雄
作者单位:1海南医学院第二附属医院内分泌科,海南 海口 570311;2中南大学湘雅医学院附属海口市人民医院呼吸与危重症医学科,海南 海口 570208
我国糖尿病(diabetes mellitus ,DM)的患病率达10.9%[1]。糖尿病足(diabetic foot,DF)是糖尿病病人主要慢性并发症之一,是糖尿病非外伤性截肢的最主要原因[2]。糖尿病足的发生和感染密切相关。类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,BP,简称类鼻疽菌)主要流行于东南亚,我国海南、广东、广西、香港和台湾等地,治疗不及时则病死率高达40%[3-4]。既往文献报道,BP可引起肺部、肝胆、骨等部位严重感染病原菌,甚至危及生命[5-6]。但目前有关DF合并BP感染的报道仍较少。本研究通过回顾性分析,总结DF合并BP感染的临床特征、药物敏感特点及有效的治疗手段,对临床诊治糖尿病足具有重要的指导意义。
1 资料与方法
选取2012 年1 月至2022 年3 月在海南医学院第二附属医院内分泌科、骨科、感染科住院的64 例DF合并BP感染病人,均为首次发生BP感染,均为2型糖尿病。收集和总结病人的临床特征、药敏和治疗情况。纳入标准:(1)符合1999年WHO 糖尿病诊断标准;(2)有糖尿病足;(3)糖尿病足伤口分泌物培养为BP或者伤口分泌物及血培养均为BP者;(4)病人或其近亲属知情同意。排除标准:(1)精神疾病或其他原因不能配合检查者;(2)血培养为其他病原菌感染者;(3)妊娠期或哺乳期妇女。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
2 结果
2.1 临床特征64 例DF 合并BP 病人中,男54 例(84.4%)、女10 例(15.6%),年龄(52.0±12.2)岁,年龄≤50 岁20 例(31.3%),年龄>50 岁44 例(68.7%),38 例(59.4%)职业为农民。糖尿病足Wagner 分级为1 级的0 例,2 级的8 例,3 级的20 例,4 级的30 例,5 级的6 例,其中Wagner 3~4 级的占78.1%。60 例(93.8%)有发热症状,其中44 例(68.8%)有高热(体温>39 ℃)。6 例(9.4%)有酮症酸中毒,16 例(25.0%)合并肺部感染,32 例(50.0%)合并脓毒血症,18 例合并感染性休克,14 例合并脓肿(肝脓肿8例,脾脓肿6 例),30 例(46.9%)出现肝功能不全,20例(31.3%)出现肾功能不全,36例(56.3%)出现低蛋白血症,34例(53.1%)白细胞升高,2例白细胞降低,26 例血红蛋白下降,所有病人的C 反应蛋白[162.2(10.3,326.8)mg/L]和降钙素原[1.9(0.6,93.2)μg/L]均高于正常值。
2.2 药敏结果足部伤口分泌物培养共培养出64株类鼻疽菌,其中10 例培养两次才呈阳性。BP 对临床常用抗菌药物的药物敏感试验结果见表1。
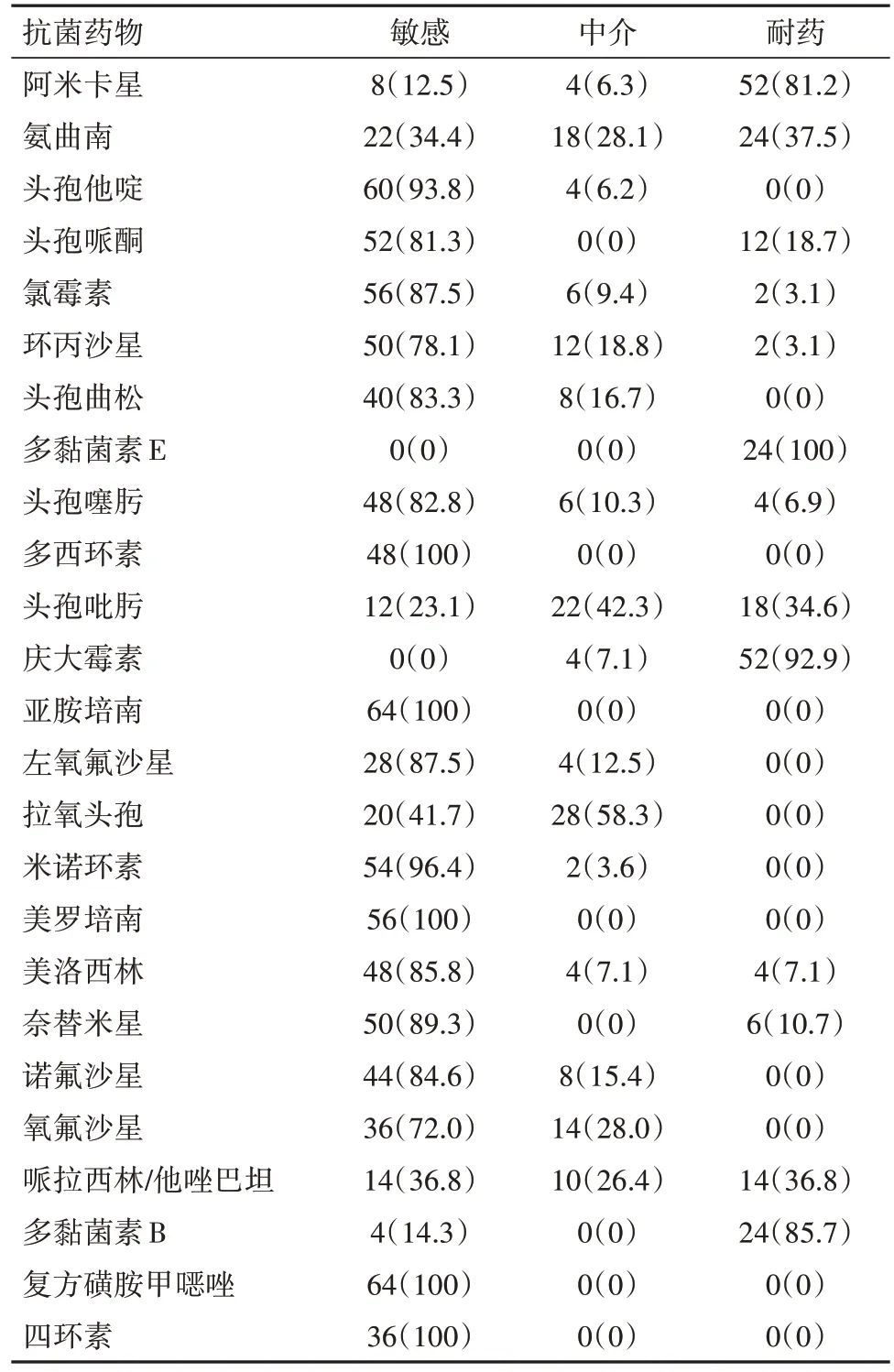
表1 64株类鼻疽霍尔德菌对常用抗菌药的药敏结果/例(%)
64 株BP 对大多数常见的抗菌素敏感性不高,但对亚胺培南西司他丁钠或美罗培南、复方磺胺甲噁唑、多西环素和四环素敏感较高。其中,在临床广泛应用的头孢菌素中,头孢他啶的敏感性相对较高。但要注意,经常在严重感染时选用的哌拉西林他唑巴坦钠对BP 的敏感性较低。而且,BP 对多黏菌素、庆大霉素和阿米卡星的耐药率较高。
2.3 治疗和转归情况所有病人均在使用胰岛素控制血糖、并经糖尿病足伤口标准化清创、引流治疗的基础上,大多数静脉应用碳青霉素烯类抗菌素(亚胺培南西司他丁钠或美罗培南)为主的抗菌治疗(其中6 例降阶梯为头孢他啶联合复方磺胺甲噁唑),大多数静脉抗感染疗程约6 周,并在出院后给予复方磺胺甲噁唑或联合多西环素治疗3~6 个月。64 例病人出院时,最终22 例治愈,30 例好转,8 例未愈,4 例死亡。死亡病例均合并多器官功能障碍,其中2例应用头孢曲松钠或头孢哌酮钠舒巴坦钠抗感染,未应用碳青霉素烯类抗菌素。
3 讨论
糖尿病足是2 型糖尿病的重要慢性并发症之一,发病率达8.1%,年复发率达31.6%,总截肢率达19.03%,病死率达14.4%[7]。抗感染治疗是治疗DF的关键环节之一。类鼻疽伯克霍尔德菌是一种人兽共患的特殊细菌,主要分布于热带和亚热带地区的土壤和水域中[8]。既往很少文献报道DF 感染类鼻疽菌的临床特点。本研究64 例DF 感染病人中68.7%的年龄>50 岁,59.4%的职业为农民。说明老年、接触疫水和土壤的人群是BP 感染的高危人群,这类人群应重点加强防护工作。糖尿病足Wagner 3~4级者占78.1%,说明BP 感染在中重度的DF 中相对常见,对中重度DF 病人如果常规抗感染无效时要警惕合并BP感染可能。
DF 合并BP 感染的特征为大多伴有发热,且大部分为高热,所有病人均有CRP、PCT 升高,容易合并肝脾脓肿、肝肾功能不全、贫血及低蛋白血症,临床上遇到这些特征的感染病人要注意BP感染可能。BP 感染不容易控制,容易进展为脓毒血症、感染性休克甚至多器官功能障碍,提示一旦合并BP 感染,应及时采用有效的抗感染治疗,降低病死率。BP感染容易合并多发的肝脓肿、脾脓肿,这在其他细菌感染中相对少见[9],可作为其临床特征之一。因此,临床上碰到常规抗菌药效果不佳的DF 病人,如果合并肝脾脓肿,要警惕类鼻疽菌感染可能。此外,还应该注意,相当一部分DF 合并BP 病人的白细胞并不高,可能和DF 病人免疫力低下以及BP 感染干扰宿主免疫功能有关,提示即使白细胞不高,也不能排除BP 感染。BP 是胞内寄生菌,寄生在宿主细胞内可以躲避宿主免疫系统和抗生素的攻击,而且其自身具有较强的耐药性[10]。BP 可以通过下调外膜孔蛋白Omp38 的表达从而对头孢他啶产生耐药[11]。研究发现,当敲除penA基因后,羧苄西林、氨苄西林和阿莫西林对BP 的最小抑菌浓度MIC 值明显降低[12]。敲除bpeEF-oprC 基因后,甲氧苄啶对BP的 MIC 值也显著降低[13]。BP依靠其拥有的外排泵系统将进入胞内的抗生素重新排出,缓解胞内抗菌药物的聚积,从而产生耐药[14]。Chantratita 等[15]发现BP 对头孢他啶耐药的主要原因是编码青霉素结合蛋白的BPSS1219基因缺失,从而导致头孢他啶作用靶点改变。在慢性感染状态下,BP可能以非复制性的状态存在于细胞内,其对抗菌药的敏感性降低,胞内存活能力增强[16]。另一方面,BP 在感染过程中通过Ⅲ型分泌系统(typeⅢ secretion system,T3SS)相关蛋白将毒力蛋白注入宿主细胞内,影响了宿主的代谢反应及免疫清除,还可以通过T3SS-3逃逸吞噬囊泡,也延长了BP在胞内存活时间[17]。此外,BP 感染THP-1 细胞后可引起宿主细胞线粒体受损,并诱导线粒体发生自噬,有利于类鼻疽菌的胞内存活[18]。因此,DF 合并BP 感染对常规的抗生素效果欠佳,且抗感染疗程较长,大多数需要静脉应用碳青霉烯类抗菌素治疗约6周及出院后服用复方磺胺甲噁唑3~6 个月,和常规的抗感染方案及疗程明显不同。此外,有文献报道,持续静脉输注美罗培南治疗重症类鼻疽病的效果比间断输注方式更佳,可能和持续静脉输注时美罗培南能始终维持在高于最低抑菌浓度的水平,有效作用时间明显延长有关[19]。
本研究总结分析了糖尿病足合并类鼻疽菌感染的特点,药敏特征及有效的治疗手段,丰富了临床上糖尿病足抗感染治疗的经验。对具有上述特征的糖尿病足人,临床医师应该要警惕合并类鼻疽菌感染可能,并及时采取针对性抗感染方案,而漏诊或延误诊断会造成严重后果。本研究为回顾性单中心研究,存在一定局限性,需要长时间随访进一步验证。
