重组结核分枝杆菌Ag85b蛋白原液纯度反向高效液相色谱检测方法的建立及验证
2024-01-26金丽婷黄岳张素勤肖文俊朱克骏张健江秋虹
金丽婷,黄岳,张素勤,肖文俊,朱克骏,张健,江秋虹
安徽智飞龙科马生物制药有限公司研发中心,安徽 合肥 230088
高效液相色谱法是目前应用较为广泛的一种分离分析技术,是根据混合物各组分在互不相溶的两相中因吸附能力、分配系数等性能差异将待测的各组分分离;同时还具有分离效能高、灵敏度高、分析快、应用范围广等特点[1-2]。高效液相色谱法因保留时间与组分的性质、结构密切相关,常被用于药物鉴别[3-5],此外,该方法对于特定物质检测具有迅速、准确的特点,可控制产品质量[6-7]。
重组结核分枝杆菌(Mycobacterium tuberculosis,Mtb)的主要分泌蛋白抗原85b(Ag85b)是卡介苗(Bacillus Calmette-Guérin,BCG)、Mtb 及其他分枝杆菌最主要的分泌蛋白,也是BCG 在体内外发挥生物学作用的主要成分[8]。Ag85b 蛋白可刺激机体产生体液免疫应答,也可诱导机体产生较强的Th1 型细胞免疫应答[9-10],因此被广泛用于结核疫苗开发。重组MTB Ag85b 蛋白是将构建的基因工程菌经诱导、表达、纯化后获得,因此,重组蛋白类疫苗在规模化生产过程中可能会引入影响其纯度的物质,对疫苗活性及安全性产生影响,有必要在生产或研究过程中严格控制蛋白纯度[11-12]。本研究旨在建立重组MTB Ag85b 蛋白纯度检测的反相高效液相色潽法,并进行验证,以达到控制产品质量的目的[13]。
1 材料与方法
1.1 供试品 重组MTB Ag85b 蛋白原液由安徽智飞龙科马生物制药有限公司制备,批号:M20190102,蛋白含量:500µg/mL。
1.2 主要试剂及仪器 乙腈、甲醇、氯化钾购自国药集团化学试剂有限公司;三氟乙酸(TFA)购自上海阿拉丁生化科技股份有限公司;磷酸氢二钠、磷酸二氢钾购自湖南九典宏阳制药有限公司;氯化钠购自江苏省勤奋药业有限公司;Waters e2695高效液相色谱仪购自美国Waters 公司;Sepax PolyRP-1000 色谱柱(2.1 mm×100 mm,5µm)购自苏州赛分科技股份有限公司。
1.3 溶液配制
1.3.1 流动相 A液(99.9%水,0.1%TFA)[14]:取TFA 0.5 mL,加纯化水至500 mL,经0.22 µm 滤膜过滤,备用;B液(99.9%乙腈,0.1%TFA):取TFA 0.5 mL,加乙腈至500 mL,经0.22µm滤膜过滤,备用。
1.3.2 1 × PBS 缓冲液 取磷酸氢二钠1.44 g、磷酸二氢钾0.24 g、氯化钠8.00 g、氯化钾0.22 g,加入纯化水溶解后,定容至1 000 mL,调节pH 至7.4,过滤备用。
1.3.3 测试溶液 取重组MTB Ag85b蛋白原液120µL,加入80 µL 1 × PBS 缓冲液,配制成300 µg/mL 待测溶液。
1.4 检测条件的选择 选取有机相洗脱梯度比例(A)、检测温度(B)、进样量(C)、95%有机相洗脱时间(D)4个因素对初步色谱条件[色谱柱:Sepax PolyRP-1000(2.1 mm×100 mm,5µm);流动相:A液→B液;重复进样:3次;上样量:10µL;检测波长:280 nm]进行优化,并设计4因素3水平正交试验,见表1和表2。将面积(%)、拖尾因子、峰面积、峰面积RSD(%)作为评价指标对正交试验结果进行分析,摸索最适检测条件。
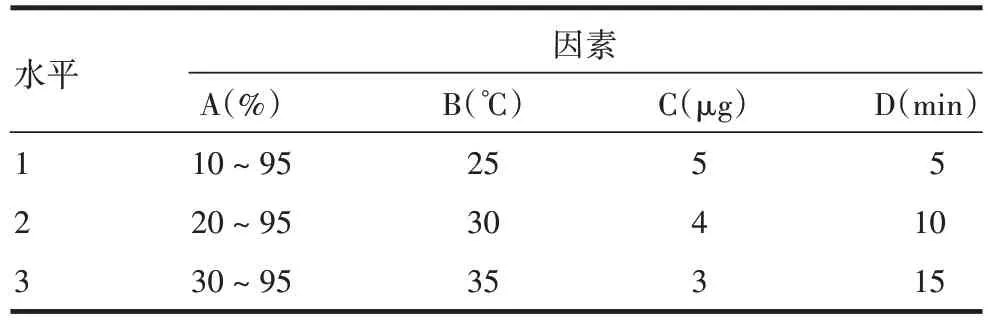
表1 色谱条件的因素和水平选择Tab.1 Selection of factors and levels of chromatographic conditions
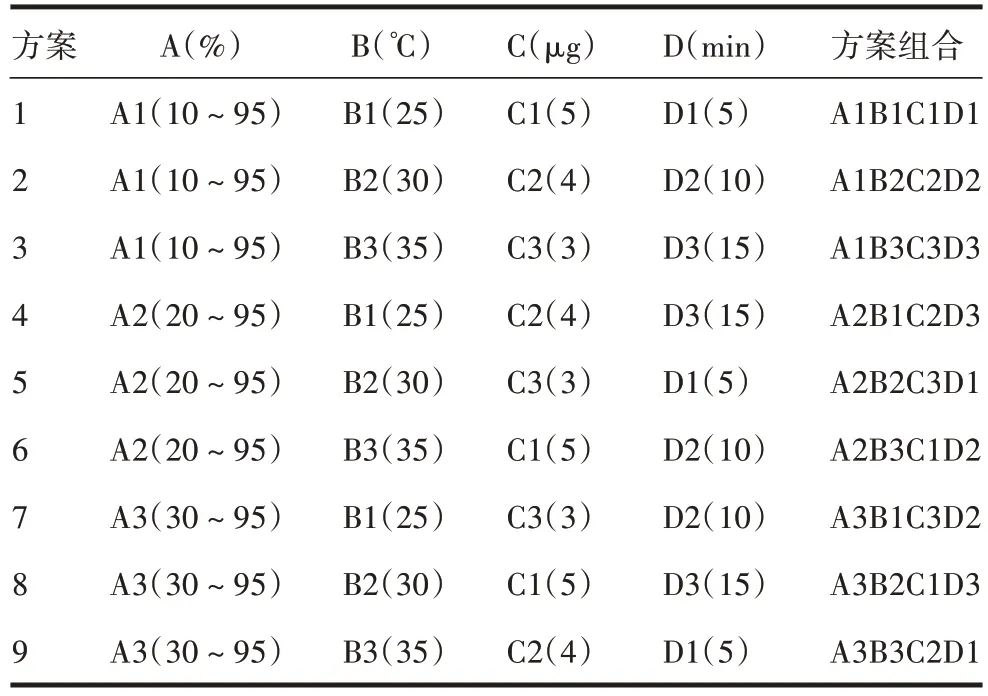
表2 正交试验设计表Tab.2 Orthogonal test design table
1.5 方法验证
按照《中国药典》四部(2020 版)9101 药品质量标准分析方法验证指导原则的要求进行验证[15-19]。
1.5.1 专属性 取测试溶液、1×PBS缓冲液,按照优化后的色谱条件上样。
1.5.2 线性范围 取Ag85b蛋白原液,用1×PBS缓冲液溶解配制成不同浓度(180、240、300、360、420µg/mL)后,按照优化后的色谱条件上样。以样品浓度为横坐标(X)、主峰面积为纵坐标(Y),绘制线性图,进行回归分析,得出回归方程和相关系数(R2)。
1.5.3 精密度
1.5.3.1 重复性 取测试溶液,按照优化后的色谱条件上样,重复进样6次。计算Ag85b蛋白原液保留时间及纯度的RSD。
1.5.3.2 中间精密度 取测试溶液,按照优化后的色谱条件上样。由1名实验员在3个不同日期以及3名实验人员在同一日期进行检测。计算Ag85b 蛋白原液主峰保留时间及纯度RSD。
1.5.4 耐用性
1.5.4.1 流速变化范围考察 取测试溶液,单独改变试验条件中的流速(0.20 ~0.22 mL/min),上样考察流速变化对检测结果的影响。
1.5.4.2 柱温变化范围考察 取测试溶液,单独改变试验条件中的柱温(30 ~40 ℃),上样考察柱温变化对检测结果的影响。
1.6 数据采集及分析 使用Waters Empower 3 软件对色谱结果进行采集及处理;使用Minitab 21.3.1.0软件对正交试验结果进行处理及分析。
2 结果
2.1 正交试验结果 4因素3水平9组正交试验结果见表3,以面积、拖尾因子、峰面积、峰面积RSD为指标,通过软件进行分析,以影响4 个评价指标的第1影响条件为最佳检测条件,由表4 可知,检测温度35 ℃、进样量3 或5 µg、95%有机相洗脱时间5 或15 min 为最佳检测条件。从柱压稳定的角度考虑,由于初步色谱条件选择的平衡条件为70%A液、30%B 液,因此选取的有机相洗脱比例为30% ~95%;进样量最终选择3µg,95%有机相洗脱时间为15 min,即最终确定的色谱条件为:色谱柱Sepax PolyRP-1000(2.1 mm×100 mm,5µm);流动相:A液→B液;平衡条件:70%A、30%B平衡60 min;流速:0.21 mL/min;样品浓度:300 µg/mL;进样量:3 µg,重复进样3次;检测温度:35 ℃;检测波长:280 nm。洗脱流程见表5。
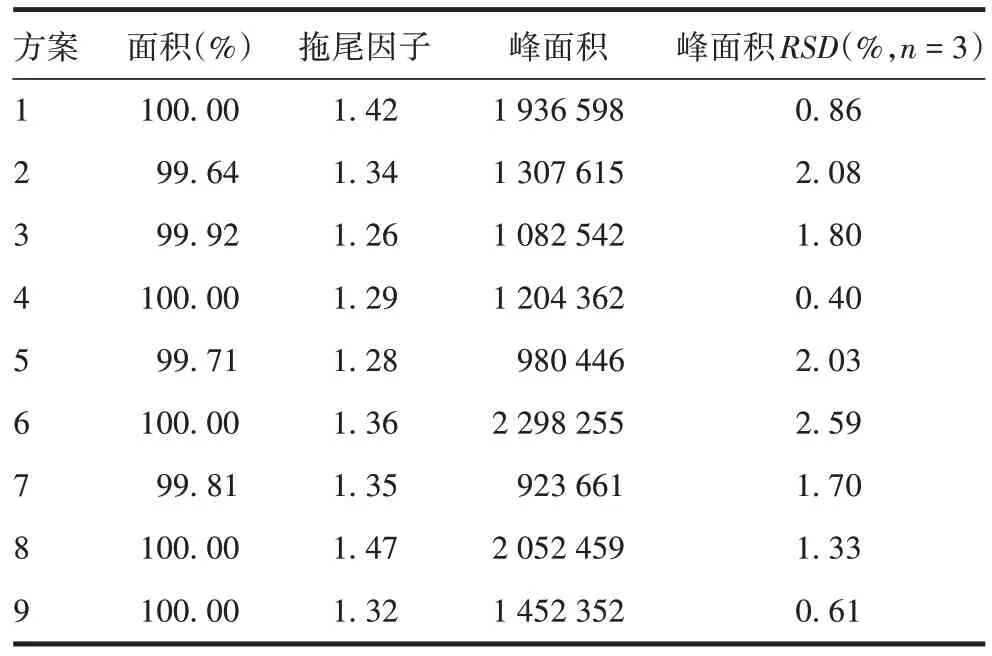
表3 Ag85b蛋白检测结果Tab.3 Detection results of Ag85b protein
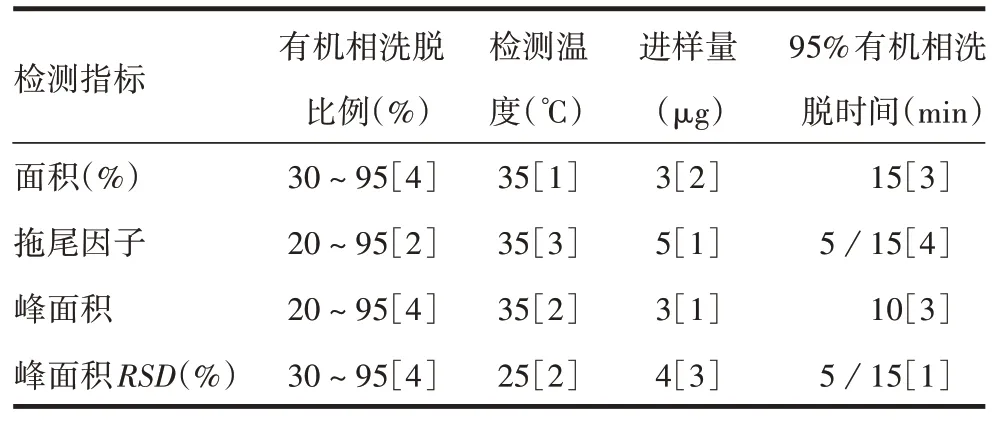
表4 软件分析结果Tab.4 Software analysis results

表5 反向高效液相色谱法检测Ag85b 蛋白原液的梯度洗脱流程Tab.5 Detection of gradient elution process of Ag85b protein stock solution by reversed phase high-performance liquid chromatography
2.2 方法验证结果
2.2.1 专属性 供试品溶液在约20 min 时有最大吸收峰,1 × PBS 缓冲液对供试品溶液出峰无干扰,表明溶剂不影响Ag85b 蛋白的检测,方法专属性良好,见图1。
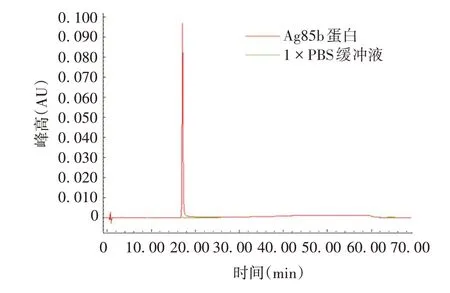
图1 专属性验证色谱图Fig.1 Chromatogram of specificity verification
2.2.2 线性范围 得到的回归方程为:y=4 300.5x+29 739,Ag85b 蛋白在180 ~420µg/mL 范围内线性关系良好,R2=0.998 5,见图2和表6。
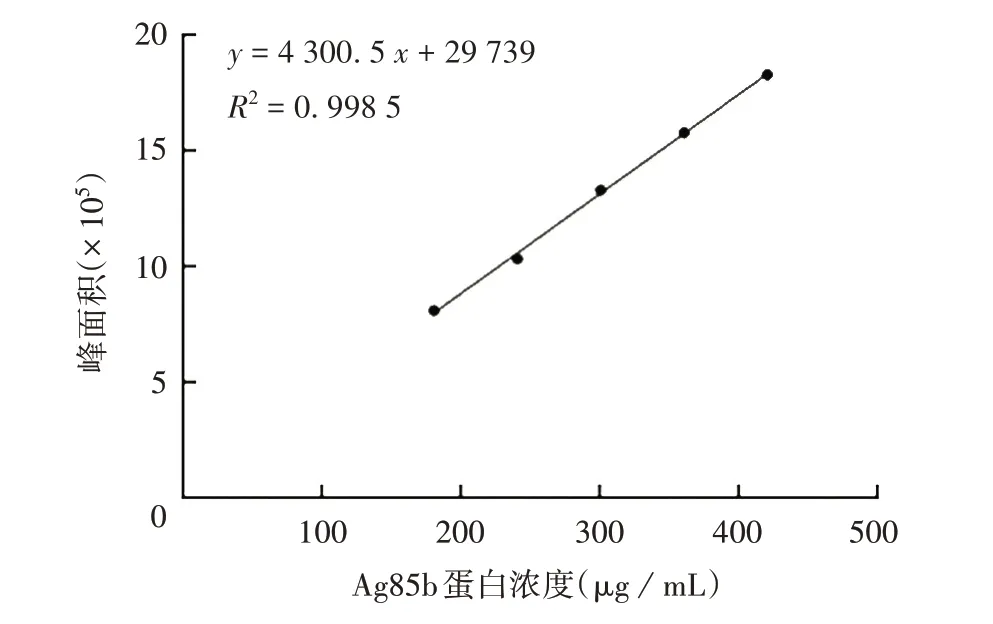
图2 Ag85b蛋白线性回归曲线Fig.2 Ag85b protein linear regression curve

表6 线性范围验证结果Tab.6 Linear range verification results
2.2.3 精密度
2.2.3.1 重复性 Ag85b 蛋白6 次上样保留时间的RSD为0.01%,纯度均为100%,表明该方法重复性良好,见图3和表7。
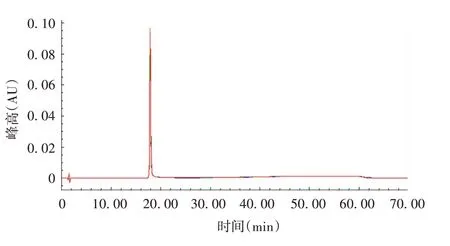
图3 重复性验证色谱图Fig.3 Chromatogram of reproducibility verification
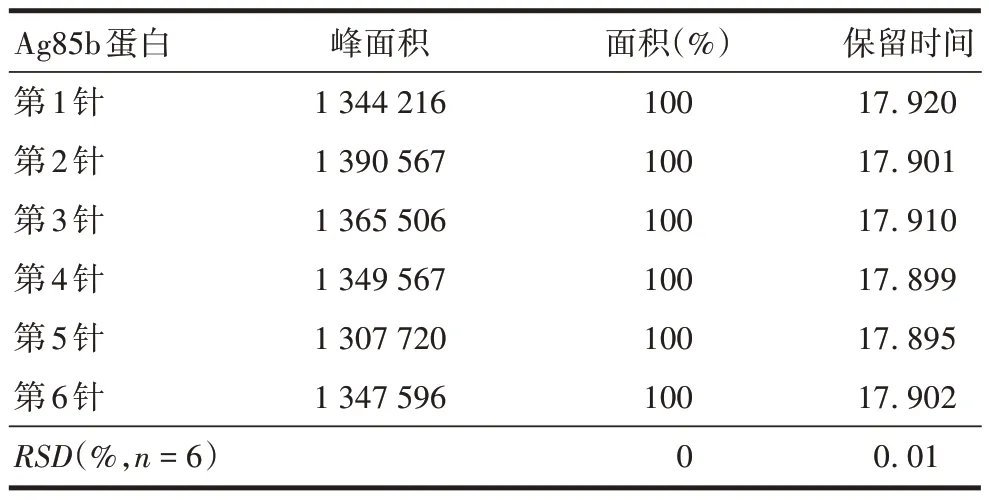
表7 Ag85b蛋白重复性验证结果Tab.7 Ag85b protein reproducibility verification results
2.2.3.2 中间精密度 不同实验员同一时间测定的纯度及主峰保留时间RSD分别为0 和0.08%,同一实验员不同时间测定的纯度及主峰保留时间RSD分别为0、0.21%,表明该方法中间精密度良好,见表8。

表8 Ag85b蛋白中间精密度验证结果Tab.8 Intermediate precision verification results of Ag85b protein
2.2.4 耐用性 流速为0.20、0.21、0.22 mL/min,柱温为30、35、40 ℃时,对Ag85b蛋白的检测无影响,表明该方法耐用性良好,见表9。
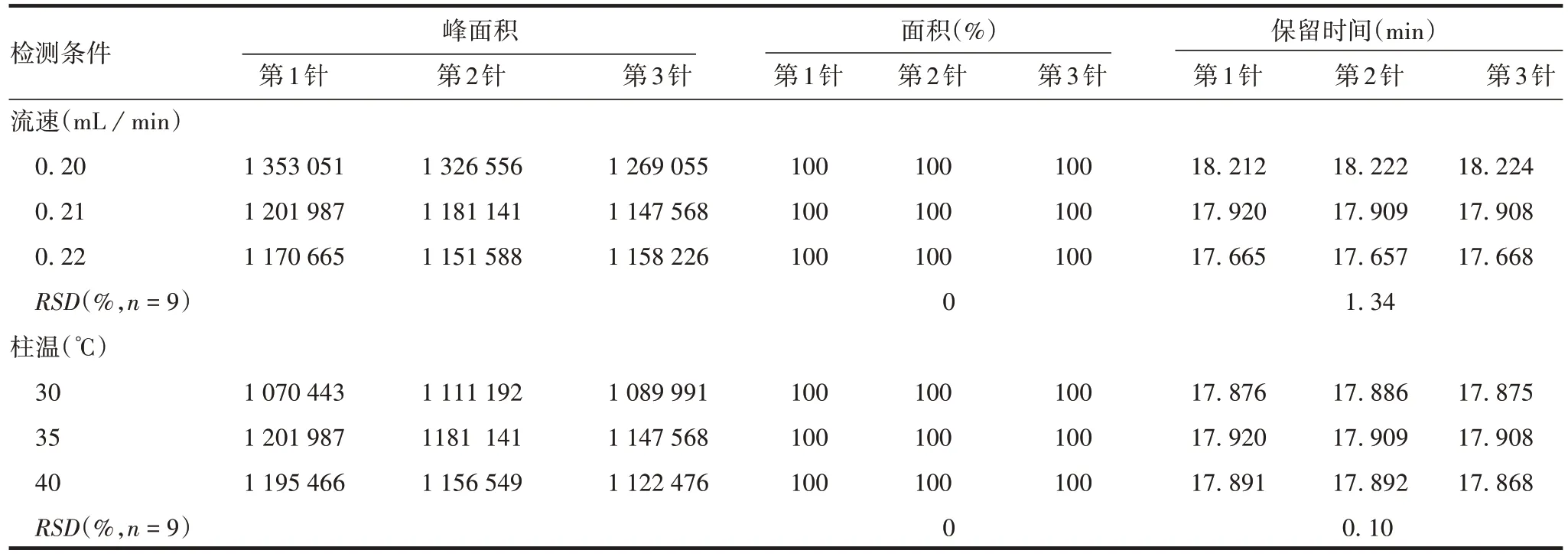
表9 耐用性验证结果Tab.9 Durability verification results
3 讨论
方法验证是制定质量标准的基础,只有经过验证的分析方法才能达到控制产品质量的目的[20-21]。本研究建立了检测重组Mtb Ag85b 蛋白原液纯度的反向高效液相色谱法,为证明该方法能够准确检测Ag85b 蛋白原液纯度,同时达到控制产品质量的目的,分别进行了专属性、线性范围、重复性、中间精密度和耐用性验证,各项验证结果均符合《中国药典》四部(2020 版)9101 药品质量标准分析方法验证指导原则相关要求[15],但本研究未能探讨流动相pH 值对样品纯度的影响,同时也未优化该方法的检测时间,后续将从以上两方面进行深入研究。
疫苗生产采用生物活性原材料,生产工艺复杂,生产周期长且对生产环境要求高,在储存运输过程中的温湿度变化也会对产品造成不良影响,需要疫苗生产企业在生产过程中进行严格的控制和质量管理。本研究采用反向高效液相色谱法对蛋白原液进行检测能够及时反映生产过程中出现的问题,色谱图可直观分析样品纯化效果[22-23],而图谱积分分析结果及保留时间能够制定样品质量标准,更好地控制产品质量[24]。
综上所述,本研究建立的重组Mtb Ag85b蛋白原液纯度的反向高效液相色谱法操作简便,准确度、精密度高,专属性强,干扰小[25-26],适用于重组Mtb Ag85b蛋白原液生产过程中的质量控制,对疫苗生产具有重要意义。
