ANKRD49对人肺腺癌细胞迁移能力的影响及其机制
2024-01-26胡金瑞樊莎莎孙佳王维杨勇王智欣刘超锋庞敏王海龙
胡金瑞,樊莎莎,孙佳,王维,杨勇,王智欣,刘超锋,庞敏,王海龙
1.山西医科大学基础医学院山西医科大学基础医学研究中心,山西 晋中 030600;2.山西医科大学第一医院呼吸与危重症医学科呼吸疾病防治与基础研究山西省重点实验室,山西 太原 030001
肺癌是危害人类健康常见的恶性肿瘤之一,其发病率和病死率均位居恶性肿瘤首位[1]。肺癌根据其病理特征可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non small cell lung cancer,NSCLC)两种类型,而肺腺癌是NSCLC最常见的亚型之一[2-3]。肺腺癌患者早期缺乏特异性临床症状,中晚期患者发生局部浸润甚至远处转移,严重影响其临床预后及生存时间,其5 年总生存率不足20%[4-5]。因此,对肺腺癌远处转移机制的研究对于认识疾病、寻找靶向治疗标志物、降低肺癌病死率及改善临床预后具有重要意义。
ANKRD49(ankyrin repeat domain 49)是一个具有4个ankrin重复序列结构域的蛋白质,该结构域介导蛋白质与蛋白质之间的相互作用[6]。据报道,ANKRD49参与了人类恶性胶质瘤和胃癌的进展[7-8],研究表明,ANKRD49基因与肺癌细胞的侵袭、转移有关[9]。但其在NSCLC 中的具体功能及作用机制尚未揭示。本研究通过慢病毒构建稳定表达ANKRD49的人肺腺癌NCI-H1299 细胞,在体外水平研究ANKRD49 对细胞迁移能力的影响及其机制,为揭示肺腺癌迁移的分子机制及发现潜在治疗靶点提供实验依据。
1 材料与方法
1.1 细胞及病毒人肺腺癌细胞NCI-H1299为山西医科大学基础医学研究中心保存;携带过表达ANKRD49基因的慢病毒(LV5-ANKRD49-OE)、过表达ANKRD49基因的阴性对照慢病毒(LV-ANKRD49-NC),携带敲低ANKRD49基因的慢病毒(LV3-shANKRD49-1、LV3-shANKRD49-2)、敲低ANKRD49基因的阴性对照慢病毒(LV3-ANKRD49-NC)均购自苏州吉玛基因股份有限公司。
1.2 主要试剂及仪器 胎牛血清(fetal bovine serum,FBS)购自浙江天杭生物科技有限公司;RPMI1640培养基购自北京赛文创新生物科技有限公司;Polybrene购自苏州吉玛基因股份有限公司;总RNA 提取试剂盒购自上海普洛麦格生物产品有限公司;逆转录试剂盒和2×M5 HiPer 实时荧光定量试剂盒购自北京聚合美生物科技有限公司;兔抗p-p65 多克隆抗体、山羊抗鼠HRP-IgG 和山羊抗兔HRP-IgG 均购自武汉博士德生物有限公司;兔抗ANKRD49多克隆抗体购自美国Proteintech 公司;兔抗β-actin 多克隆抗体购自美国Bioworld 公司;兔抗基质金属蛋白酶(matrix metalloproteinase,MMP)-9 多克隆抗体、兔抗MMP-2多克隆抗体、鼠抗基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloprotease,TIMP)-1 多克隆抗体和兔抗TIMP-2 多克隆抗体均购自北京博奥森生物技术有限公司;兔抗核转录因子(nuclear transcription factor,NF)-κB/p65多克隆抗体、兔抗p-IκBα多克隆抗体和鼠抗IκBα 多克隆抗体均购自美国Cell Signaling Technology 公司;NF-κB/p65 通路抑制剂PDTC购自美国Med ChemExpress(MCE)公司;Proteinsimple 凝胶成像系统购自美国Alphalmager MINI 公司;Quant studio3 实时荧光定量PCR 仪购自美国Thermo Fisher scientific公司。
1.3 细胞培养 用含10% FBS 的RPMI1640 培养基,于37 ℃,5%CO2及饱和湿度条件下常规传代培养NCIH1299细胞。
1.4 稳转细胞株的建立ANKRD49过表达细胞株:将NCI-H1299 细胞分为空白对照组(NC)和ANKRD49 组,分别感染过表达ANKRD49基因的阴性对照慢病毒和ANKRD49过表达序列慢病毒;ANKRD49敲低细胞株:将NCI-H1299细胞分为阴性对照(shNC)、shANKRD49-1 和shANKRD49-2 组,分别感染敲低ANKRD49基因的阴性对照慢病毒和不同靶点ANKRD49shRNA 序列慢病毒LV3-shANKRD49-1、LV3-shANK-RD49-2。细胞融合度为40%~50%时,按照MOI为200(经预试验确定)分别加入慢病毒悬液(1×108TU/mL)200 µL,Poly-brene 终浓度2 µg/mL。感染后24、48 h在荧光显微镜下观察各孔细胞的荧光表达情况及生长状态;感染48 h后,用浓度为2.5µg/mL(经预试验确定)的嘌呤霉素进行细胞筛选,48 h 后,用浓度为1.25µg/mL(经预试验确定)的嘌呤霉素进行细胞维持。分别采用实时荧光定量PCR和Western blot检测细胞的感染效率。
1.5 实时荧光定量PCR 用总RNA 提取试剂盒提取细胞RNA,再用逆转录试剂盒逆转录获得cDNA,以其为模板,使用2 × M5 HiPer 实时荧光定量试剂盒进行PCR 扩增,以β-actin为内参。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。以2-△△Ct值表示待测样本相较于校准样本基因表达量的倍数。试验重复3 次,取平均值。引物由北京中美泰和生物科技有限公司合成,引物序列见表1。

表1 实时荧光定量PCR引物序列Tab.1 Primer sequences for real-time fluorescence quantitative PCR
1.6 Western blot 收集处于对数生长期的且贴壁率大于90%的细胞,用SDS裂解液提取细胞总蛋白质(按照1∶100的体积分数加入PMSF),BCA法测定总蛋白浓度。将30µg 蛋白样品经12%SDS-PAGE 分离后,湿转至PVDF 膜上,用5%脱脂奶粉室温封闭2 h;分别加入兔抗ANKRD49多抗(1∶500稀释)、兔抗MMP-9多抗(1∶1 000 稀释)、兔抗MMP-2 多抗(1∶1 000 稀释)、鼠抗TIMP-1 多抗(1∶1 000 稀释)、兔抗TIMP-2多抗(1∶1 000 稀释)、兔抗p65 多抗(1∶1 000 稀释)、兔抗p-p65 多抗(1∶1 000 稀释)、兔抗p-IκBα 多抗(1∶1 000稀释)、鼠抗IκBα多抗(1∶1 000稀释)、兔抗β-actin 多抗(1∶5 000 稀释),4 ℃孵育过夜;TBST洗膜3 次,加入山羊抗鼠HRP-IgG 或山羊抗兔HRPIgG(均1∶5 000 稀释),室温孵育1 h;TBST 洗膜后,ECL显影曝光,采用凝胶成像系统分析结果。
1.7 ANKRD49 对NCI-H1299 细胞迁移能力影响的检测 采用细胞划痕试验。分别选取生长状态良好的过表达和敲低组细胞,胰酶消化后按照5 ×106个/孔接种6孔板,每组设3个平行,于细胞培养箱中培养24 h 后,用200 µL 枪头在6 孔板中央垂直画线,PBS 清洗画线部位,加入含5%血清的培养基,分别于0、24、48 h 后显微镜下拍照,测量划痕宽度,统计24、48 h细胞迁移距离。
1.8 统计学分析 采用SPSS 20.0软件进行统计学分析,实验数据以均数±标准差()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。所有试验均独立重复3次。
2 结果
2.1ANKRD49稳转NCI-H1299细胞株的鉴定
2.1.1ANKRD49过表达细胞株 过表达慢病毒感染NCI-H1299 细胞及嘌呤霉素筛选后,荧光显微镜下可见NC 组和ANKRD49 组细胞均表达绿色荧光,感染效率可达60%以上,见图1。Western blot 结果显示,与NC 组相比,ANKRD49 组细胞中ANKRD49 蛋白表达水平明显升高(t= 45.68,P <0.001),见图2和表2。实时荧光定量PCR 结果显示,ANKRD49 组细胞中ANKRD49mRNA 转录水平为NC组的13倍以上(t=70.02,P <0.001),见表2。
图1 ANKRD49过表达细胞的荧光显微镜观察(×100)Fig.1 Fluorescence microscopy of ANKRD49 overexpression cells(×100)
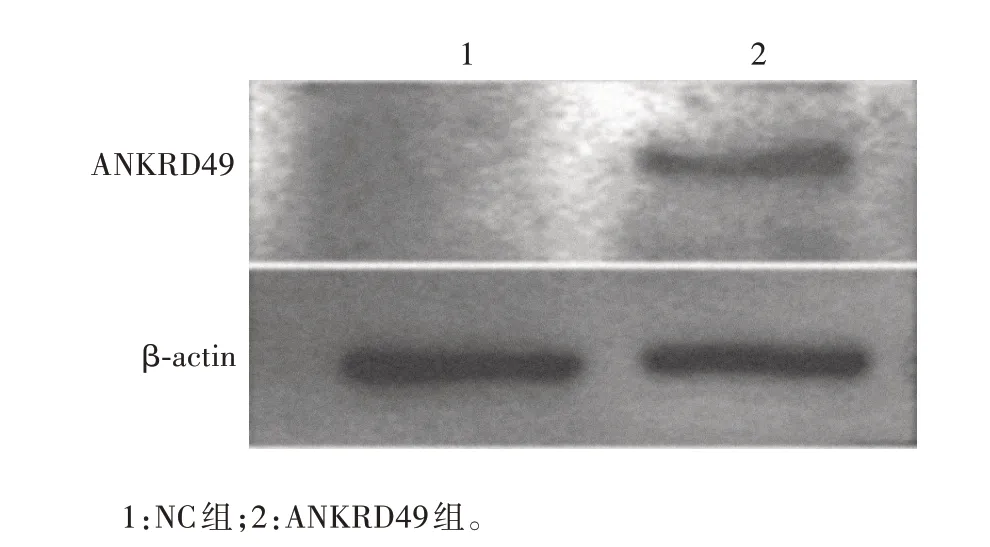
图2 ANKRD49过表达细胞的Western blot鉴定Fig.2 Identification of ANKRD49 overexpression cells by Western blot
表2 过表达各组NCI-H1299 细胞中ANKRD49 mRNA 和蛋白表达水平(±s,n=3)Tab.2 Expression levels of ANKRD49 mRNA and protein in NCIH1299 cells of various overexpression groups(±s,n=3)
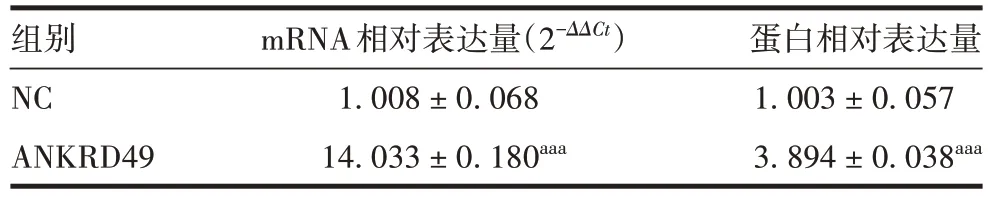
表2 过表达各组NCI-H1299 细胞中ANKRD49 mRNA 和蛋白表达水平(±s,n=3)Tab.2 Expression levels of ANKRD49 mRNA and protein in NCIH1299 cells of various overexpression groups(±s,n=3)
注:aaa表示与NC组比较,P <0.001。
组别NC ANKRD49 mRNA相对表达量(2-ΔΔCt)1.008±0.068 14.033±0.180aaa蛋白相对表达量1.003±0.057 3.894±0.038aaa
2.1.2ANKRD49敲低细胞株 敲低慢病毒感染NCIH1299 细胞及嘌呤霉素筛选后,荧光显微镜下可见shNC、shANKRD49-1、shANKRD49-2组细胞均表达绿色荧光,感染效率可达50%,见图3。Western blot 结果显示,与shNC组相比,shANKRD49-1和shANKRD49-2 组细胞中ANKRD49 蛋白的表达水平均明显降低(t分别为5.412和5.328,P分别为0.005 6和0.006),见图4和表3。实时荧光定量PCR结果显示,与shNC组相比,shANKRD49-1 和shANKRD49-2 组细胞中ANKRD49mRNA转录水平均降低50%以上(t分别为15.34和12.57,P分别为0.001和0.002),见表3。

图3 ANKRD49敲低细胞的荧光显微镜观察(×100)Fig.3 Fluorescence microscopy of ANKRD49 knock-down cells(×100)
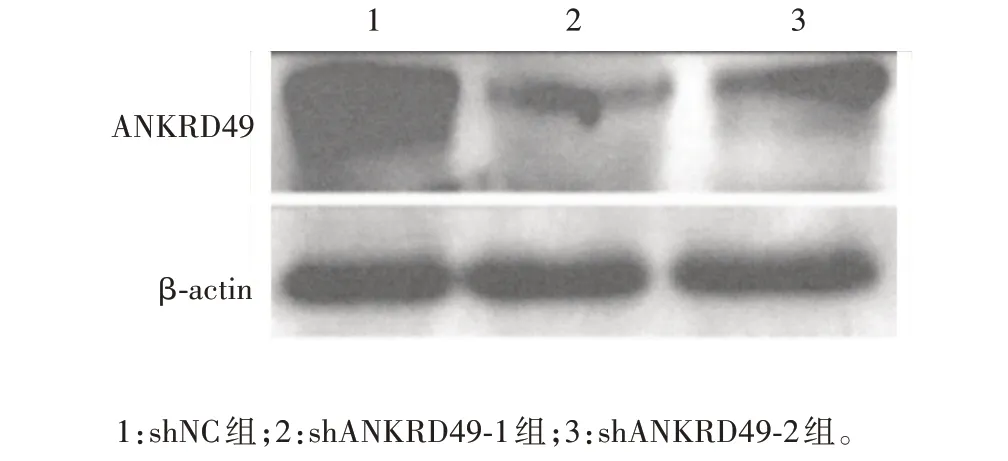
图4 ANKRD49敲低细胞的Western blot鉴定Fig.4 Identification of ANKRD49 knock-down cells by Western blot
表3 敲低各组NCI-H1299 细胞中ANKRD49 mRNA 和蛋白表达水平(±s,n=3)Tab.3 Expression levels of ANKRD49 mRNA and protein in NCIH1299 cells of various knock-down groups(±s,n=3)

表3 敲低各组NCI-H1299 细胞中ANKRD49 mRNA 和蛋白表达水平(±s,n=3)Tab.3 Expression levels of ANKRD49 mRNA and protein in NCIH1299 cells of various knock-down groups(±s,n=3)
注:aa表示与shNC组比较,P <0.01。
组别shNC shANKRD49-1 shANKRD49-2 mRNA 相对表达量(2-ΔΔCt)1.037±0.065 0.512±0.087aa 0.248±0.063aa蛋白相对表达量1.009±0.068 0.753±0.030aa 0.723±0.039aa
2.2 ANKRD49对NCI-H1299细胞迁移能力的影响
2.2.1ANKRD49过表达的影响 细胞划痕试验结果表明,24和48 h NC组细胞迁移距离(分别为331.7和699.3µm)与ANKRD49组(分别为441.5和810.7µm)相比,差异均有统计学意义(t分别为5.343和3.282,P分别为0.005 9和0.030 4),见图5和图6。
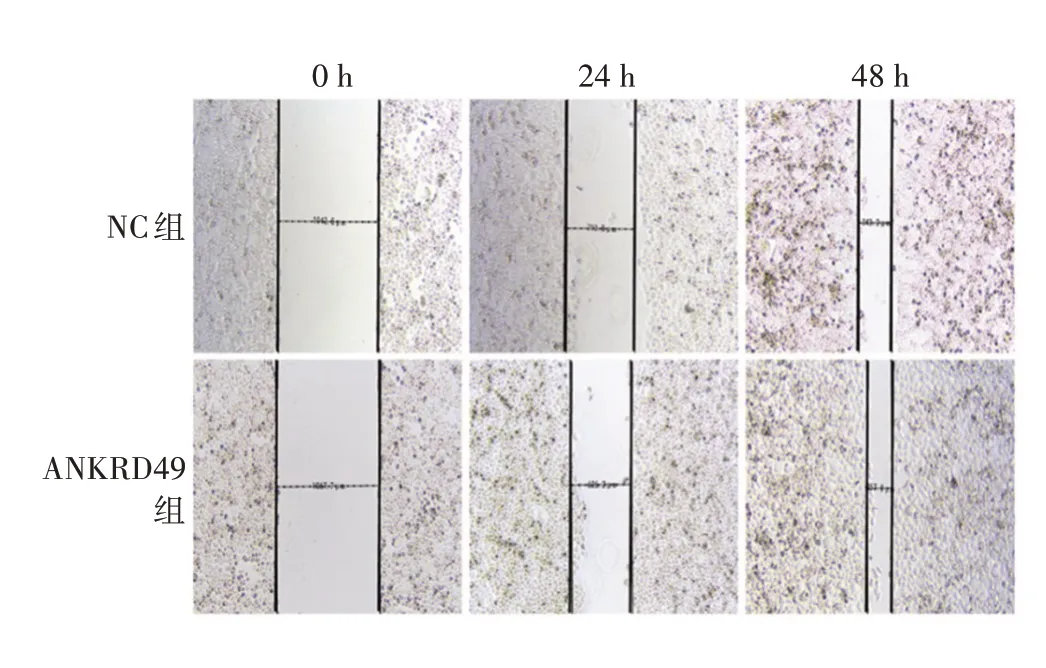
图5 划痕试验检测ANKRD49 过表达对NCI-H1299 细胞迁移能力的影响(×40)Fig.5 Detection of effect of ANKRD49 overexpression on migration ability of NCI-H1299 cells by scratch test(×40)

图6 ANKRD49 过表达组NCI-H1299 细胞不同时间的迁移距离Fig.6 Migration distance of NCI-H1299 cells in ANKRD49 overexpression group at different time
2.2.2ANKRD49敲低的影响 细胞划痕试验结果表明,24 h shNC组细胞迁移距离(469.6µm)与shANKRD49-1和shANKRD49-2组(分别为393.4和440µm)相比,差异均有统计学意义(t分别为4.368和3.933,P分别为0.012 和0.017 1);48 h 时shNC 组细胞迁移距离(862.8 µm)与shANKRD49-1 和shANKRD49-2组(分别为436.9 和593 µm)相比,差异也均有统计学意义(t分别为6.033 和9.673,P分别为0.003 8 和0.000 6)。见图7和图8。
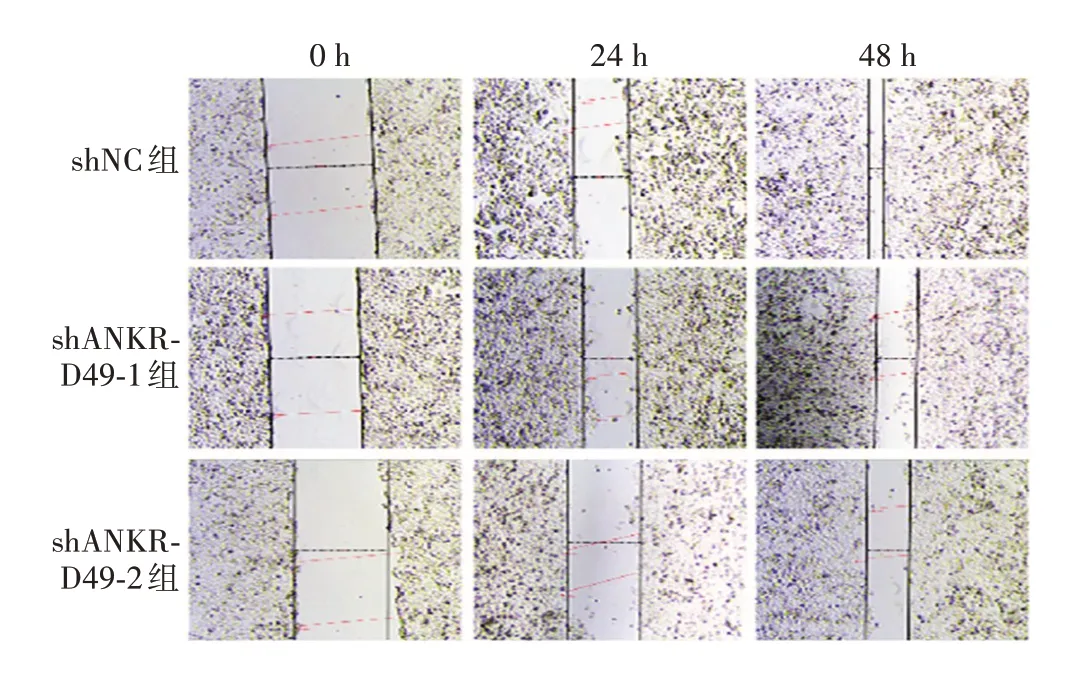
图7 划痕试验检测ANKRD49 敲低对NCI-H1299 细胞迁移能力的影响(×40)Fig.7 Detection of effect of ANKRD49 knocking down on migration ability of NCI-H1299 cells by scratch test(×40)
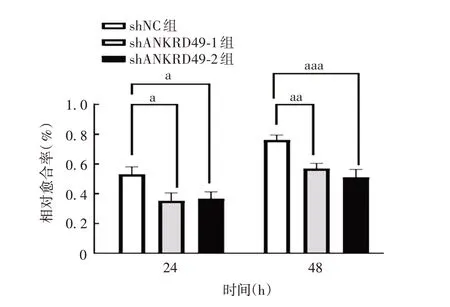
图8 ANKRD49 敲低组NCI-H1299 细胞不同时间的迁移距离Fig.8 Migration distance of NCI-H1299 cells in ANKRD49 knock-down group at different time
2.3 NCI-H1299 细胞中MMP-2/9、TIMP-1/2 mRNA及蛋白的表达水平
2.3.1ANKRD49过表达细胞 实时荧光定量PCR 及Western blot结果显示,与NC组相比,ANKRD49组细胞MMP-2 和MMP-9 mRNA 转录水平及蛋白表达水平均明显升高(t分别为9.304和6.193,P分别为0.000 7和0.003 5),TIMP-1 和TIMP-2 mRNA 转录水平及蛋白表达水平均明显下降(t分别为3.858 和3.517,P分别为0.018 2和0.024 5),见图9和图10。
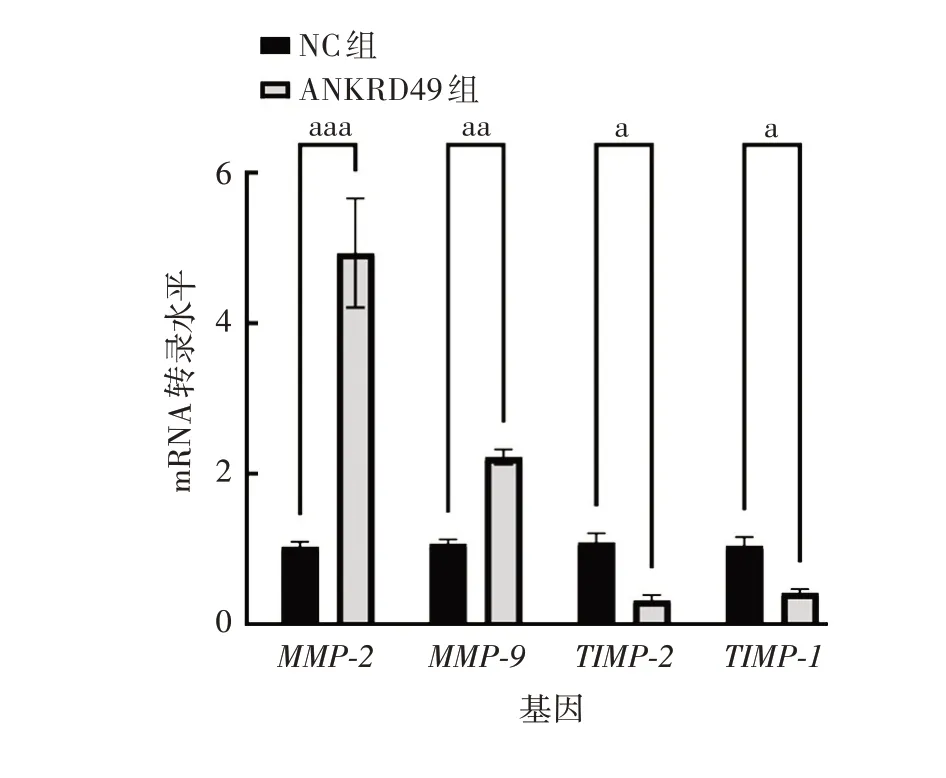
图9 ANKRD49 过表达NCI-H1299 细胞中MMP-2/9、TIMP-1/2 mRNA的转录水平Fig.9 Transcriptional levels of MMP-2/9 and TIMP-1/2 mRNA in NCI-H1299 cells overexpressing ANKRD49
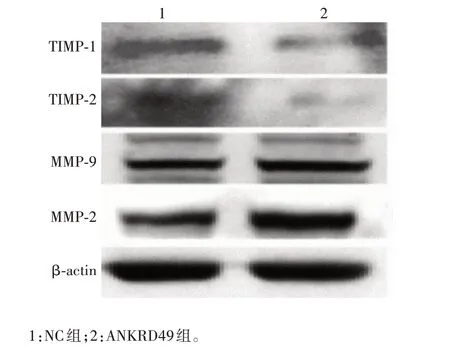
图10 Western blot 分析ANKRD49 过表达NCI-H1299 细胞中MMP-2/9、TIMP-1/2 蛋白表达水平Fig.10 Western blotting of protein expression levels of MMP-2/9 and TIMP-1/2 in NCI-H1299 cells overexpressing ANKRD49
2.3.2ANKRD49敲低细胞 实时荧光定量PCR结果显示,与shNC 组相比,shANKRD49-1 和shANKRD49-2组细胞MMP-2、MMP-9 mRNA 转录水平均明显下降(MMP-2:t分别为31.28 和6.699,P分别为0.001 和0.021 6;MMP-9:t分别为19.00 和12.28,P分别为0.002 8和0.006 6),TIMP-1、TIMP-2 mRNA 转录水平均明显升高(TIMP-1:t分别为5.191和38.38,P分别为0.035 2 和0.000 7;TIMP-2:t分别为5.525 和56.26,P分别为0.031 2和0.000 3);Western blot结果显示,与shNC组相比,shANKRD49-1和shANKRD49-2 组细胞MMP-2、MMP-9 蛋白表达水平均明显下降,TIMP-1、TIMP-2 蛋白表达水平均明显升高。见图11和图12。
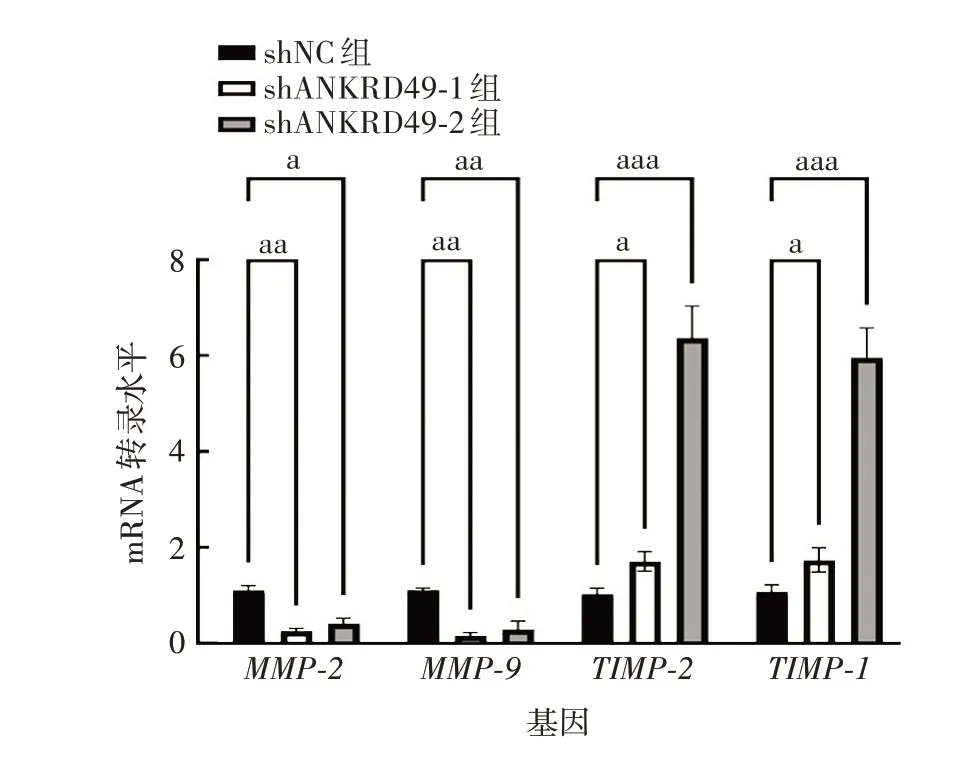
图11 ANKRD49 敲低NCI-H1299 细胞中MMP-2/9、TIMP-1/2 mRNA的转录水平Fig.11 Transcriptional levels of MMP-2/9 and TIMP-1/2 mRNA in ANKRD49 knock-down NCI-H1299 cells
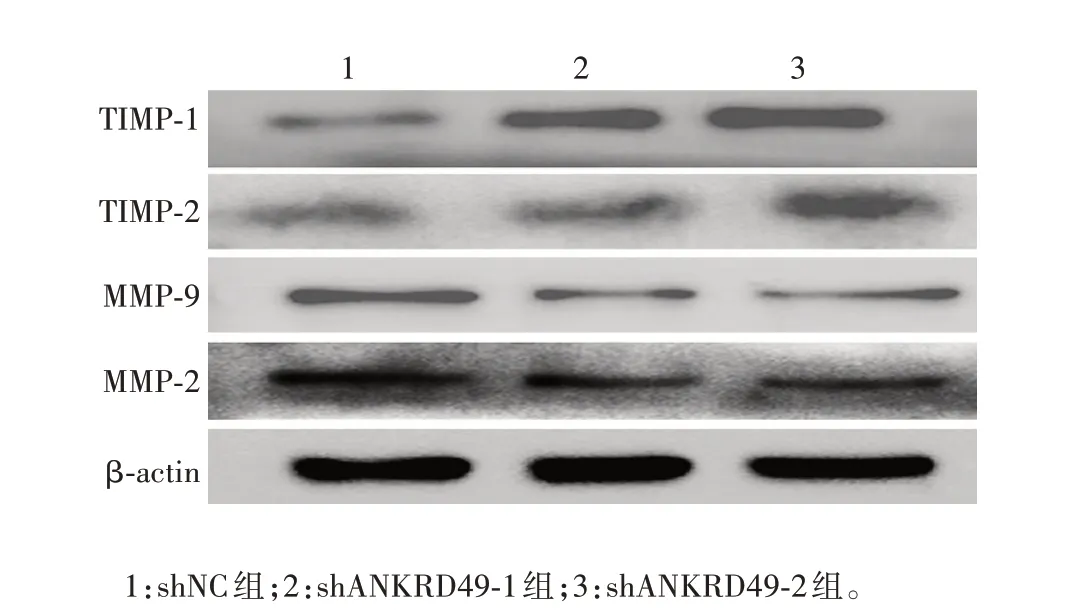
图12 Western blot 分析ANKRD49 敲低NCI-H1299 细胞中MMP-2/9、TIMP-1/2 蛋白表达水平Fig.12 Western blotting of protein expression levels of MMP-2/9 and TIMP-1/2 in ANKRD49 knock-down NCI-H1299 cells
2.4 NCI-H1299 细胞中NF-κB/p65 信号通路相关蛋白的表达
2.4.1ANKRD49过表达细胞 Western blot 结果显示,与NC 组相比,ANKRD49 组细胞p-IκBα 和p-p65表达水平明显升高,IκBα 和p65 总蛋白水平无明显变化,p-p65/p65、p-IκBα/IκBα 值明显增高,差异有统计学意义(t分别为3.962和5.370,P分别为0.016 7和0.005 8),见图13和图14。
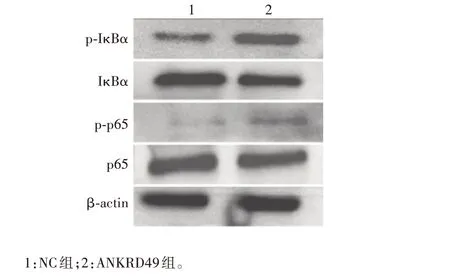
图13 Western blot 分析ANKRD49 过表达NCI-H1299 细胞中NF-κB/p65信号通路相关蛋白的表达Fig.13 Western blotting of expression of NF-κB/p65 signaling pathway related proteins in NCI-H1299 cells overepressing ANKRD49
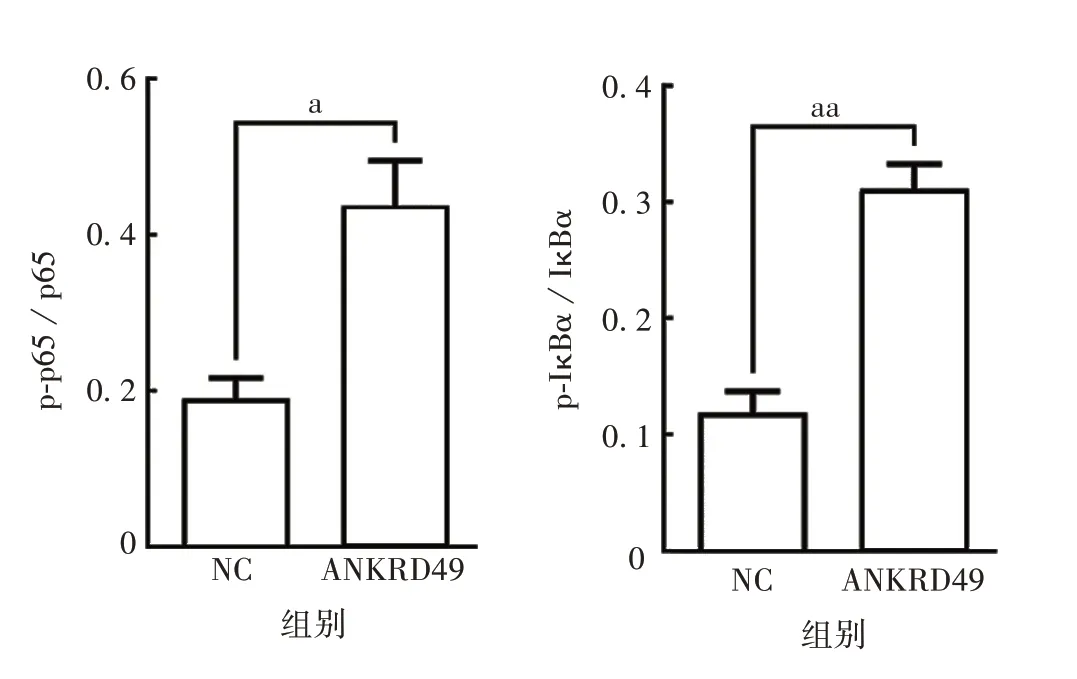
图14 ANKRD49 过表达NCI-H1299 细胞中NF-κB/p65信号通路相关蛋白的表达水平Fig.14 Expression of NF-κB/p65 signaling pathway related proteins in NCI-H1299 cells overexpressing ANKRD49
2.4.2ANKRD49敲低细胞 Western blot结果显示,与shNC 组相比,sh-ANKRD49-1 和sh-ANKRD49-2 组细胞p-IκBα和p-p65表达水平明显降低,IκBα和p65总蛋白水平无明显变化,p-p65/p65、p-IκBα/IκBα 值明显降低,差异有统计学意义(p-p65/p65:t分别为17.42和11.90,P分别为0.003 3和0.007 0;p-IκBα/IκBα:t分别为5.625 和4.436,P分别为0.030 2 和0.047 2),见图15和16。
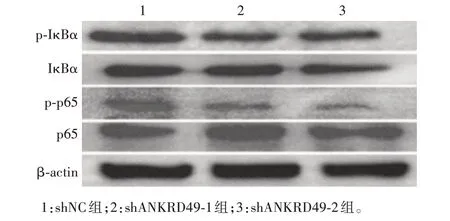
图15 Western blot 分析ANKRD49 敲低NCI-H1299 细胞中NF-κB/p65信号通路相关蛋白的表达Fig.15 Western blotting of expression of NF-κB/p65 signaling pathway related proteins in ANKRD49 knock-down NCIH1299 cells
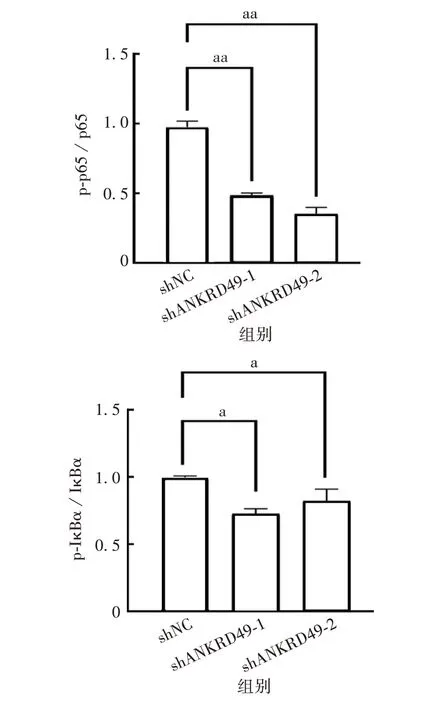
图16 ANKRD49 敲低NCI-H1299 细胞中NF-κB/p65 信号通路相关蛋白的表达水平Fig.16 Expression of NF-κB/p65 signaling pathway related proteins in ANKRD49 knock-down NCI-H1299 cells
2.4.3 NF-κB/p65通路抑制剂PDTC 对ANKRD49过表达NCI-H1299 细胞中MMP-2、MMP-9 表达的影响Western blot结果显示,经100µmol/L PDTC作用24 h,可显著抑制细胞ANKRD49过表达后引起的MMP-2、MMP-9升高(t分别为10.45和15.36,P分别为0.000 5和0.000 1),见图17和图18。

图17 Weste blot 分析NF-κB/P65 通路抑制剂PDTC 对ANKRD49 过表达NCI-H1299 细胞中MMP-2、MMP-9 表达的影响Fig.17 Western blot analysis of effect of NF-κB/P65 pathway inhibitor PDTC on MMP-2 and MMP-9 expressions in NCIH1299 cells overexpressing ANKRD49
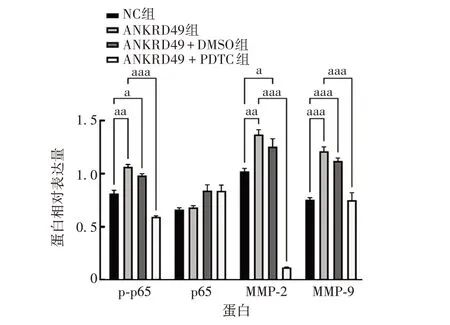
图18 NF-κB/p65 通路抑制剂PDTC 作用后ANKRD49过表达NCI-H1299细胞中MMP-2、MMP-9的表达Fig.18 MMP-2 and MMP-9 expressions in NCI-H1299 cells overexpressing ANKRD49 with effect of NF-κB/p65 pathway inhibitor PDTC
3 讨论
Ankyrin 蛋白通常包括不同数量的锚定蛋白重复结构域,其含有30 ~34 个氨基酸残基,具有典型的螺旋-环螺旋-β-发夹/环折叠,该结构域是一种特定的蛋白质-蛋白质相互作用的基序[6],这些锚定蛋白重复结构域蛋白参与包括肿瘤进展的许多细胞过程[10-11]。Notch、P16和IκB 均属于锚定蛋白重复结构域蛋白,参与与多种肿瘤的发生发展[12]。ANKRD49蛋白包含4 个ankyrin 重复结构域,其在人脑恶性胶质瘤中高表达,通过延长细胞周期和抑制细胞凋亡促进人脑胶质瘤细胞的增殖[7]。组织芯片研究表明,与癌旁正常组织相比,胃癌组织中ANKRD49表达显著上调,且与胃癌患者的不良预后相关[4]。课题组前期通过组织芯片研究发现,ANKRD49 在非小细胞肺癌组织中的表达高于癌旁正常组织[13],但其具体功能和作用机制尚未阐明。本研究通过基因过表达与敲低技术发现,ANKRD49可影响肺腺癌细胞NCIH1299的迁移能力。
肿瘤细胞侵袭转移的发生是多基因、多因素、多步骤的复杂过程,现已证实,肿瘤转移的分子机制与MMPs 有关[14-15]。肿瘤细胞转移时需通过基底膜,而基底膜的主要成分是Ⅳ型胶原,因此,Ⅳ型胶原酶MMP-2和MMP-9对肿瘤细胞的迁移起重要作用[16-17]。正常情况下,MMPs在其体内与TIMPs保持相对平衡。MMP-2 的活性受其特异性组织抑制剂TIMP-2 的抑制,而MMP-9 的特异性抑制剂为TIMP-1。TIMP-2、TIMP-1 分别与潜在和激活形式的MMP-2、MMP-9 形成非共价的1∶1复合物,进而抑制MMP-2、MMP-9激活及其酶活性[18-19]。一旦肿瘤细胞通过各种机制影响MMPs 和TIMPs 的表达,破坏MMPs 与TIMPs 之间的相对平衡,则肿瘤细胞的浸润转移均会增强[20]。本研究结果显示,与对照组相比,ANKRD49过表达促进NCI-H1299 细胞迁移能力的同时,也增加了MMP-2和MMP-9的表达水平,而敲低组结果相反。有关TIMPs与肿瘤进展的研究结果并不一致,有研究显示,其在口腔鳞癌和甲状腺乳头状癌中表达降低[21];也有研究发现,结直肠癌中TIMPs 的表达正常甚至增强[22]。本研究中ANKRD49过表达降低了TIMP-1、TIMP-2在NCI-H1299 细胞中的表达,增加了MMP-2/TIMP-2、MMP-9/TIMP-1值,敲低组降低了其比值,表明TIMPs抑制MMPs 作用下降也是非小细胞肺癌侵袭和转移的原因之一。本研究结果表明,单一的以MMP-2/9的升高判断肿瘤侵袭和转移能力及预后并不全面,应结合MMP-2/TIMP-2、MMP-9/TIMP-1 值综合判断可能更有意义。
NF-κB是一种重要的可诱导基因转录调节因子,参与炎症、免疫、细胞增殖和细胞凋亡等多种生理、病理过程。NF-κB 的激活通过IκB 激酶(IκB kinase,IKK)介导的抑制性分子(包括IkBa)的磷酸化降解释放出p65,后者Ser536(为p65 磷酸化位点)磷酸化后激活发挥转录调控作用[23]。研究表明,NF-κB 调节许多黏附、侵袭、迁移相关因子的转录而参与肿瘤的侵袭转移[24-25]。本研究结果显示,与对照组相比,ANKRD49过表达显著提高p-p65 和p-IkBa 水平,而这两种蛋白的总体水平未见变化,同时,加入PDTC后,AN-KRD49过表达并不能引起MMP-2、MMP-9蛋白表达水平的升高,提示ANKRD49可通过激活NF-κB 信号通路上调MMP-2、MMP-9 及下调TIMP-1、TIMP-2,进而促进肿瘤细胞的转移。
综上所述,本研究结果表明,ANKRD49通过激活NF-κB 信号通路,促进MMP-2、MMP-9 的表达,升高MMP-2/TIMP-2和MMP-9/TIMP-1值,促进NCI-H1299细胞的迁移。本研究初步揭示了ANKRD49 在肺腺癌中的作用及其可能的机制,为阐明肺腺癌的迁移及寻找靶向治疗分子标志物提供了实验依据。
