左慈丸的化学成分及治疗围绝经期听力损失的作用机制研究:基于网络药理学与分子对接技术
2024-01-26刁翯白文佩赵立东
刁翯 白文佩 赵立东


【摘要】 背景 近年來,围绝经期听力损失(PMS-HL)症状得到普遍关注,但无针对性治疗。左慈丸治疗耳聋已有百年历史,但尚无该药治疗PMS-HL的相关研究。目的 在网络药理学和分子对接技术的基础上,进一步通过动物实验验证,初步探讨左慈丸对PMS-HL的作用机制及治疗靶点。方法 检索数据库时限均为建库至2023年2月。根据左慈丸的组方,通过TCMSP和Uniprot数据库挖掘该药物活性成分和作用靶点,根据GeneCards、OMIM、TTD、DrugBank、PharmGKB数据库获取PMS-HL的蛋白靶点,取其交集,筛选左慈丸治疗PMS-HL的潜在治疗靶点,构建“药物-活性成分-靶点”相互作用网络图。利用String数据库的蛋白相互作用分析功能筛选核心靶点。采用Metascape数据库对蛋白的功能及其通路进行富集分析。使用Autodock和Pymol对核心蛋白进行分子对接,确定核心靶点与左慈丸的关键活性成分之间的结合能力。于2022年9月—2023年1月建立绝经大鼠模型:假手术组(SHAM)组、去卵巢组(OVX)组、左慈丸(ZCW)组,并检测血清中关键蛋白白介素1β(IL-1β)水平,使用SPSS 26.0进行统计分析。结果 左慈丸组方中化合物的活性成分90个,潜在蛋白靶点226个,PMS-HL相关靶点2 481个,左慈丸与PMS-HL交集靶点150个。基因本体论(GO)功能中获得生物过程共183个条目,分子功能103个条目,细胞成分103个条目;京都基因和基因组百科全书(KEGG)前三位分别是癌症通路、脂质与动脉粥样硬化病变通路和化学致癌的受体激活通路。分子对接显示,左慈丸治疗PMS-HL的主要活性成分有槲皮素、山柰酚、豆甾醇、β-谷甾醇、异鼠李素、薯蓣皂苷、四氢鸭脚木碱和海风藤酮;左慈丸的活性成分与核心靶蛋白:丝氨酸/苏氨酸蛋白激酶1(AKT1)、细胞肿瘤抗原p53(TP53)、白介素6(IL-6)、血管内皮生长因子(VEGFA)、胱天蛋白酶3(CASP3)、IL-1β、表皮生长因子受体(EGFR)、雌激素受体1(ESR1)结合能稳定。3组大鼠血清IL-1β水平比较,差异有统计学意义(F=11.73,P<0.001)。结论 左慈丸中的槲皮素等90个活性成分通过作用于AKT1等226个潜在蛋白,实现调控组织细胞的抗氧化应激、调节血脂血糖代谢、抗肿瘤等途径,直接或间接地起到保护围绝经期听力功能的作用,IL-1β可能是其中发挥作用的关键靶蛋白。
【关键词】 围绝经期;听力损失;左慈丸;中药化学成分;网络药理学;分子对接
【中图分类号】 R 711.51 R 764.43 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0390
Chemical Composition and Mechanism of Zuoci Pill in Treating Perimenopausal Hearing Loss Based on Network Pharmacology and Molecular Docking Technology
DIAO He1*,BAI Wenpei2,ZHAO Lidong3
1.Department of Traditional Chinese Medicine,Tianjin Central Hospital of Gynecology Obstetrics/Nankai University Maternity Hospital/Tianjin Key Laboratory of Human Development and Reproductive Regulation,Tianjin 300199,China
2.Department of Obstetrics and Gynecology,Beijing Shijitan Hospital,Capital Medical University,Beijing 100038,China
3.Academy of Otolaryngology-Head and Neck Surgery,Chinese PLA General Hospital/National Clinical Research Center for Otolaryngologic Diseases/State Key Lab of Hearing Science Affiliated to Chinese Ministry of Education/Beijing Key Lab of Hearing Impairment Prevention and Treatment,Chinese PLA Medical School,Beijing 100853,China
*Corresponding author:DIAO He,Attending physician;E-mail:hedia@bjmu.edu.cn
【Abstract】 Background In recent years,the symptoms of perimenopausal hearing loss(PMS-HL)have received widespread attention,but there is no targeted treatment. Zuoci pill has been used clinically for a hundred years,but there is no relevant research on the treatment of PMS-HL with this drug. Objective To explore the mechanism and therapeutic targets of Zuoci pill on PMS-HL through further validation of animal experiments based on the network pharmacology and molecular docking technology. Methods The active components and action targets of Zuoci pill were obtained through TCMSP and Uniprot databases,and the protein targets of PMS-HL were obtained through GeneCards,OMIM,TTD,DrugBank,and PharmGKB databases according to the composition of Zuoci pill from inception to February 2023,the intersection was taken to screen the potential therapeutic targets of Zuoci pill for the treatment of PMS-HL,and the "drug-active ingredient-target" interaction network diagram was constructed. The protein interaction analysis function of the String database was utilized to screen core targets. The Metascape database was used for enrichment analysis of the function of the proteins and pathways. Molecular docking of the core proteins was performed using Autodock and Pymol software to determine the binding capacity between key active ingredients and core targets. The menopausal animal model was established from September 2022 to January 2023,including Sham operation group(SHAM)group,ovariectomized(OVX)group,and Zuoci pill(ZCW)group,and serum level of the key protein interleukin 1β(IL-1β)was detected and statistically analyzed using SPSS 26.0. Results There were 90 active components,226 potential protein targets,2 481 PMS-HL related targets,and 150 Zuoci pill and PMS-HL intersection targets for the compounds in the Zuoci pill formula. A total of 183 items for biological process,103 items for molecular function,and 103 items for cellular components were obtained in the Gene Ontology(GO)function. The top three Kyoto Encyclopedia of Genes and Genomes(KEGG)were cancer pathways,lipid and atherosclerotic lesion pathway,and receptor activation pathway for chemical carcinogenesis. Molecular docking showed that the main active ingredients of Zuoci pill in treating PMS-HL were quercetin,kaempferol,stigmasterol,β- Sitosterol,isorhamnetin,diosgenin,tetrahydrostilbene and kaempferone;the active components of Zuoci pill can bind to the core target proteins of serine/threonine kinase 1(AKT1),cellular tumor antigen p53(TP53),interleukin 6(IL-6),vascular endothelial growth factor(VEGFA),cystatinase 3(CASP3),IL-1β,epidermal growth factor receptor(EGFR),and estrogen receptor 1(ESR1)stably. Comparison of serum IL-1β level among the three groups of rats showed statistically significant difference(F=11.73,P<0.001). Conclusion The 90 active ingredients in Zuoci pill,such as quercetin,act on 226 potential proteins such as AKT1 to regulate the antioxidant stress of tissues and cells,metabolism of blood lipids and glucose,and anti-tumor pathway,directly or indirectly protect the perimenopausal hearing function,IL-1β may be one of the key target proteins.
【Key words】 Perimenopause;Hearing loss;Zuoci pill;Chemical compositions;Network pharmacology;Molecular docking
女性的卵巢功能会伴随衰老而逐渐减弱,导致激素水平的变化,进而引发下丘脑-垂体-卵巢轴的一系列临床表现,称为围绝经期综合征(perimenopausal syndrome,PMS)[1]。临床研究发现,女性围绝经期间存在听力损失(hearingloss,HL)的情况[2-3],属于PMS的症状之一。雌激素对听力的保护机制具有多种途径,比如:雌激素可维持内耳神经、血流及代谢的水平,保持耳内微循环平衡,从而保护听力功能;雌激素能够对听觉的上皮细胞进行修复,进而减少HL;雌激素可以调节脑源性神经营养因子相关基因的表达、抑制细胞凋亡和调节钙离子浓度平衡进而保护听神经细胞等[4-5]。临床上对于PMS大多采用绝经激素治疗(menopausal hormone therapy,MHT),本质是弥补年龄增长导致的卵巢功能衰竭。但雌激素属于多种功能的类固醇激素,其受体在人类组织器官上分布较为广泛,故围绝经期听力损失(PMS-HL)使用MHT针对性欠佳。
PMS-HL属于中医妇科学绝经前后诸证的范畴,其病机以肾虚为主,肾的阴阳平衡失调,处于“阴常不足,阳常有余”的状态。《灵枢·脉度篇》中有“肾气通于耳,肾和则耳能闻五音矣”的记载。肾精不足则出现HL的症状。左慈丸是中医治疗耳聋的经典名方,出自《饲鹤亭集方》,在2020版《中国药典》[6]中录入的名称为“耳聋左慈丸”,处方中中药的组成包括熟地黄、茯苓、山药、煅磁石、山茱萸、丹皮、柴胡、泽泻共八味,主治功能为滋肾平肝,治疗肝肾阴虚的耳聋、耳鸣等症。目前研究证实,左慈丸对药物性耳聋、突聋、老年性耳聋以及中耳炎导致HL均有确切疗效[7-8]。此外,动物实验研究提示,左慈丸可能对耳蜗内组织的水通道蛋白4以及血清氧自由基产生影响,从而减少HL[9]。目前,关于左慈丸治疗PMS-HL的研究鲜见报道,因此,左慈丸治疗PMS-HL的具体作用靶点和组织生物学途径有待进一步阐明。
网络药理学可系统阐释多组分中药的靶标蛋白及其生物学作用[10-11]。分子对接技术可以通过化学计量学科支持,模拟化学分子的几何结构,通过两分子之间的作用关系,阐明药物与靶蛋白或活性位点的相互作用,预测其结合模式与亲和力[12]。因此,本研究使用网络药理及分子对接技术,对左慈丸的有效成分及其治疗PMS-HL的生物学机制进行研究并进行动物学验证,为其临床应用奠定基础。
1 资料与方法
1.1 网络药理学
本文数据库检索时限均为建库至2023-02-28。
1.1.1 左慈丸有效成分与作用靶点的收集与筛选:使用TCMSP数据库[13]对煅磁石、柴胡、熟地黄、山茱萸、丹皮、山药、茯苓、泽泻的相关活性成分进行筛选,推算作用靶点。活性成分满足以下条件:类药性(oral bioavailability,OB)≥30%;药物相似性(drug likeness,DL)≥0.18[14]。删除重复的靶点后,使用Uniprot数据库[15](http://www.uniprot.org/)进行分析,限定物种为人(已验证),对靶点名称进行标准化。
1.1.2 PMS-HL疾病靶点获取:使用GeneCards[16](https://www.genecards.org/)、OMIM[17](https://omim.org/)、TTD[18](http://db.idrblab.net/ttd/)、DrugBank[19](https://go.drugbank.com/)、PharmGKB[20](https://www.pharmgkb.org/)数据库,以“climactic syndrome”“primenopause syndrom”“menopause syndrome”“menopausal syndrome”“deaf”和“hearingloss”作为检索词,筛选PMS-HL的靶点基因集,删除交集靶点后得到PMS-HL的靶点,导入Uniprot数据库,对靶点名称进行标准化。
1.1.3 绘制“药物-活性成分-靶點”网络图:分别整理左慈丸的药物靶点以及PMS与HL的疾病靶点,导入Jvenn网站[21](http://jvenn.toulouse.inra.fr/app/),进行映射取交集,绘制韦恩图;采用Cytoscape 3.9.1软件[22]导出药物关联活性成分与治疗靶点的网络图,利用内置工具Network Analyzer筛选核心活性成分。
1.1.4 构建左慈丸治疗PMS-HL的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络:利用String数据库[23](https://string-db.org/)研究左慈丸相关靶点与靶点间的相互作用。将交集靶点导入数据库,物种设置为“Homo Sapiens”,构建PPI网络。利用Cytoscape 3.9.软件绘制PPI网络图。使用Network Analyzer推算拓扑参数分析,根据Betweenness Centrality(中心度值)、Closeness Centrality(紧密中心度值)、Degree(节点连接度值)筛选核心靶蛋白。
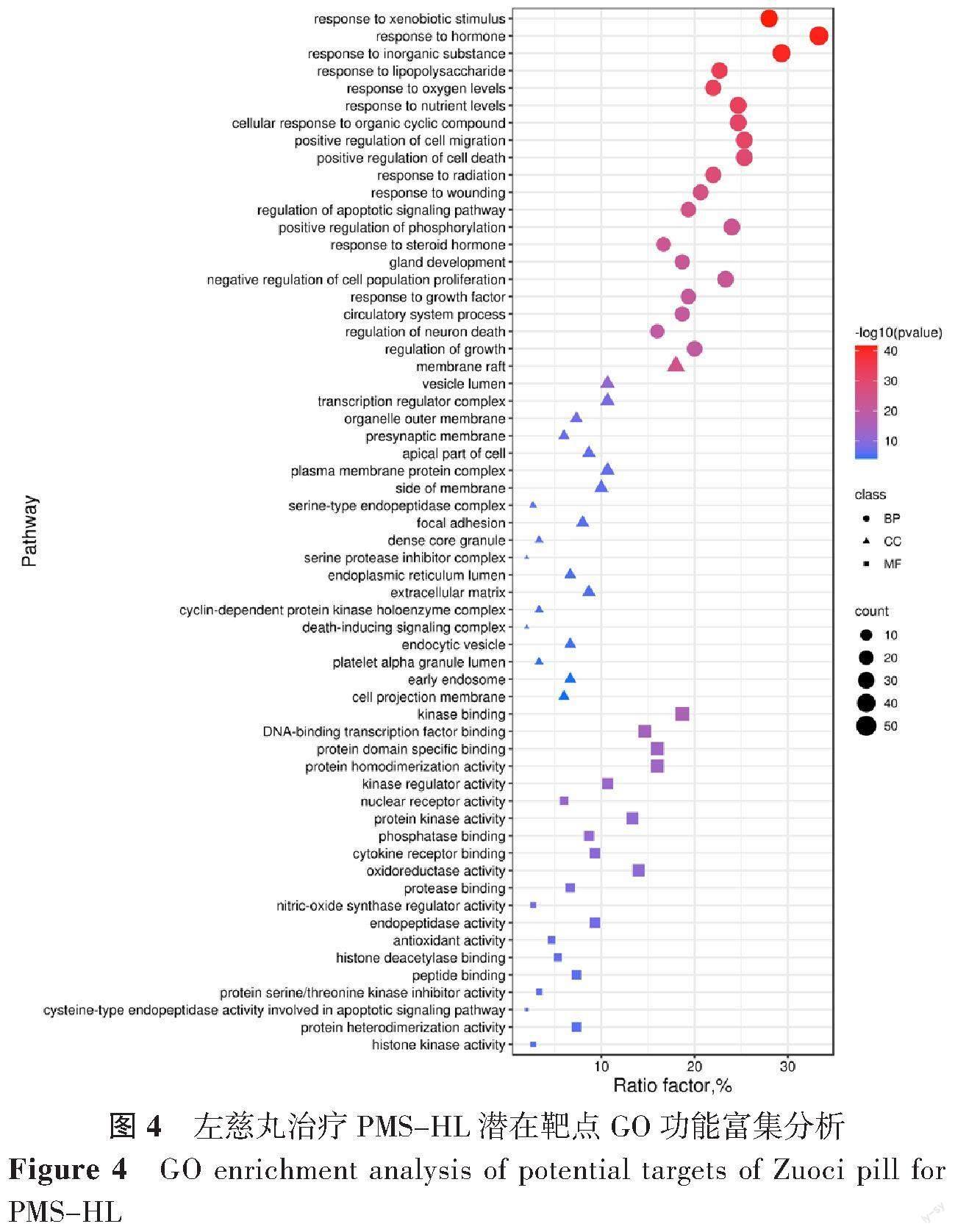
1.1.5 基因本体论(GO)功能与京都基因和基因组百科全书(KEGG)信号通路富集分析:将左慈丸治疗PMS-HL的靶基因上传至Metascape数据库[24](http://metascape.org/gp/index.html),物种:“Homo Sapiens”,得出GO功能和KEGG信号通路的富集结果(以P<0.01为差异有统计学意义)。GO富集分析包含3个方面:细胞组分(cellularcomponent,CC)、生物过程(biologicalprocess,BP)和分子功能(molecularfunction,MF)。结果设置:值截止<0.01,最小重叠>3,最小富集>1.5。使用Bioinformatic平台(http://bioinformatics.com.cn/)绘制GO和KEGG前20个结果的气泡图,数据可视化处理,使用Cytoscape 3.9.1绘制“药物-活性成分-靶点-疾病-信号通路”图。
1.2 分子对接验证
1.2.1 建立有效化合物配体及受体:在建立配体时,选择核心小分子化合物。Pubchem数据库[25](https://pubchem.ncbi.nlm.nih.gov/)中搜索化合物并保存其3D结构。经PyMOL 2.6.1处理后,该化合物能量最小化,保存为mol2格式。在PDB数据库[26](https://www.rcsb.org/)中搜索核心靶点的三维结构(PDB格式),筛选原则:人类来源、具有高分辨率并且具有原始配体。以核心靶点作为受体。
1.2.2 分子对接验证:核心靶点蛋白经过PyMOL 2.6.1软件处理,将其水分子剥离,去除原始配体。采用AutoDock Tools[27]软件处理核心靶点和小分子化合物。利用AutoDock 1.5.7[28]和PyMOL 2.6.1软件进行分子对接和结果可视化,转化为三维图形,导出热图分析结果。
1.3 白介素1β(IL-1β)血清水平检测
1.3.1 研究对象:雌性SD大鼠[动物合格证号:SCXK(京)2019-0008,均由北京华阜康生物有限公司提供],10周龄,SPF级,室温恒温(16~24℃),湿度45%~55%,日光照12 h,去豆粕饲料,自由饮水。本方案已通过南开大学实验动物伦理委员会批准。
1.3.2 造模及分组:将60只大鼠编号,采用随机数字表法分为3组:假手术(SHAM)组、去卵巢(OVX)组、左慈丸(ZCW)组,每组20只。10周龄时,SHAM组进行假手术、OVX组与ZCW组进行去卵巢手术。手术5~10 d后,进行阴道涂片巴氏染色,判断大鼠动情周期。12~16周龄时,ZCW组进行左慈丸汤剂(自制)灌胃,SHAM组、OVX组等同剂量生理盐水灌胃。大鼠用药剂量遵循鼠-人剂量折算公式:大鼠剂量=人临床剂量×70 kg(人均体质量)×0.018/200 g(大鼠体质量)。
1.3.3 药物制备:左慈丸汤剂(熟地黄24 g、山茱萸12 g、山药12 g、茯苓9 g、泽泻9 g、丹皮9 g、柴胡3 g、锻磁石3 g),原料药物均一次性购于天津中医药大学第一附属医院,并由该院煎药室煎制,汤液密封装袋。后水煎液制备浓缩至0.3 g/mL。
1.3.4 标本采集:连续干预给药4周,麻醉状态下腹主动脉取血,血液室温条件下静置30 min,使用低温离心机(4 ℃,3 000 r/min,离心10 min)处理,取上清液,-20 ℃保存。
1.3.5 指标检测:血清中白介素1β(IL-1β)蛋白使用酶联免疫吸附测定法(ELISA)检测。
1.4 统计学分析
采用SPSS 26.0统计学软件进行数据处理。本研究计量资料均符合正态分布,以(x-±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 左慈丸与作用靶点
通过TCMSP数据库筛选出活性成分90个,其中柴胡17个,山茱萸20个,熟地黄2个,山药16个,茯苓15个,丹皮10个,泽泻10个。该数据库未收录煅磁石的活性成分,根据文献补充的锰、铜、锌以及四氧化三铁4种化合物均未达到筛选条件,所以删除。删除活性成分中交集项目,删除Uniprot数据库无法找到official-symbol活性成分的化合物,得到活性成分52个,其中,有4种化合物是左慈丸内不同中药共有的活性成分,见表1。利用TCMSP数据库中的“Related Targets”模块,获得左慈丸活性成分对应的靶蛋白226个。导入Uniprot标准化名称,删除重复及非人类靶蛋白,导出靶蛋白216个,对应基因506个。
2.2 PMS-HL疾病相关靶点基因与药物靶点映射
通过利用检索GeneCards、OMIM、TTD、DrugBank及PharmGKB数据库,删除重复靶点后,疾病相关基因靶点分别为:PMS 3 700个,HL 10 602个,取交集后导出PMS-HL基因2 481个,再与左慈丸治疗靶点取交集,最终获得左慈丸治疗PMS-HL药物靶点150个。通过Cytoscape 3.9.1软件构建“左慈丸-活性成分-药物靶点”的可视化网络图,经过筛选共获得左慈丸药物包含的52种化学成分,靶蛋白148个,相应靶基因150个(图1)。
2.3 “左慈丸-活性成分-药物靶点”网络图分析
将150个靶蛋白通过Cytoscape軟件绘制“左慈丸-活性成分-药物靶点”网络图,获得网络节点206个,其中药材节点7个、化合物节点50个、靶点节点150个,边642条,见图2。通过Network Analyzer软件对网络中的拓扑参数进行计算,并对中心度值、紧密中心度值、节点连接度值较大的节点进行筛选,得到药物作用的关键枢纽靶点。每个靶点平均与化合物相互作用的个数为13.1,每个化合物平均与靶点相互作用的个数为3.9。提示了左慈丸组方内多种化合物成分与多治疗靶点具有共同作用,体现了左慈丸治疗MPS-HL疾病的组方具有整体性和联系性的特点。通过筛选得出节点连接度值前8位的活性成分:槲皮素、山柰酚、豆甾醇、β-谷甾醇、异鼠李素、薯蓣皂苷、四氢鸭脚木碱、海风藤酮。左慈丸的4种共有活性成分(槲皮素、山柰酚、豆甾醇、β-谷甾醇)均在前8位,见表2。网络中靶基因的面积大小依据degree设定,由图2可知PTGS2、PGR、NR3C2、HSP90AA1、TOP2A、F2R、ADRB2、DPP4、F10、PPARG、CHRM2等靶基因度值较大。
2.4 左慈丸治疗PMS-HL潜在作用靶点互作网络构建与分析
将靶基因导入String数据库获取左慈丸治疗PMS-HL靶点间相互作用关系数据,下载TSV文件,导入Cytoscape 3.9.1进行可视化及并使用Mcode进行基因连通性分析,得到PPI网络,以Mcode分数定义靶点基因大小,分数越高者为位于调控网络中心连通性较高的靶基因,两种靶基因相互关系证据程度分数(combine score)以边的颜色表示(图3A)。在该网络中具有节点150个,边2 770条。紧密中心度值平均值为0.544 944 496、节点连接度值平均值为36.93、中心度值平均值为0.005 950。以节点连接度值73.86、中心度值≥0.011 9作为条件筛选得出核心网络图(图3B)。丝氨酸/苏氨酸蛋白激酶1(AKT1)、细胞肿瘤抗原p53(TP53)、白介素6(IL-6)、血管内皮生长因子(VEGFA)、胱天蛋白酶3(CASP3)、IL-1β、表皮生长因子受体(EGFR)、雌激素受体1(ESR1)、肿瘤相关性蛋白(MYC)、缺氧诱导因子(HIF1A)为节点连接度值排名前10位靶蛋白,见表3。
2.5 GO功能和KEGG信号通路富集分析
GO功能富集分析:生物过程(biological process,BP)分析獲得183个条目,其中排名前3位的分别为:response to xenobiotic stimulus(对异种刺激的反应)、response to hormone(对激素的反应)、response to inorganic substance(对无机化合物的反应);细胞组分(cell component,CC)分析获得78个条目,其中排名前3位的分别为:membrane raft(膜筏)、vesicle lumen(囊泡腔)、transcription regulator complex(转录调节复合体);分子功能(molecular function,MF)分析获得103个条目,其中排名前3位的分别为:kinase binding(蛋白激酶结合)、DNA-binding transcription factor binding(DNA结合转录因子结合)、protein domain specific binding(蛋白质结构域特异性结合)。分别选取BP、CC、MF结果排名前20位的过程绘制GO功能气泡图,见图4。
KEGG信号通路富集分析共获得161条信号通路,选取最为显著的20个过程绘制KEGG信号通路富集气泡图,见图5。使用Cytoscape 3.9.1绘制KEGG信号通路富集制“药物-活性成分-靶点-疾病-信号通路”图,见图6。
2.6 分子对接
利用AutoDock软件将槲皮素、山柰酚、豆甾醇、谷甾醇、异鼠李素、薯蓣皂苷、四氢鸭脚木碱、海风藤酮(即“左慈丸-活性成分-药物靶点”网络图节点连接度值最高的8个活性成分)与AKT1、TP53、IL-6、VEGFA、CASP3、IL-1β、EGFR、ESR1(PPI网络图中8个核心蛋白)进行分子对接。以上核心蛋白PDB数据库编号分别为:7nh5、4rg2、1aIu、3qtk、3kjf、3ltq、8a27、5aav。其中二者结合能≤0 kcal/mol说明两者可以结合,结合能≤-2.0 kcal/mol说明有较好的结合能力[10],结合能越低,即结合越稳定。结果显示,化合物与靶蛋白的结合能如热图(图7)所示,提示左慈丸中的8种化学成分与靶点蛋白与化合物综合结合能力较强的蛋白为IL-1β与ESR1。利用PyMOL软件对结果进行三维图转化,图中可展示活性成分与蛋白的分子对接,见图8。
2.7 模型检测
大鼠去势后5~10 d,经阴道脱落细胞巴氏染色(图9)发现,SHAM组大鼠的脱落细胞中有被染成粉红色、鳞状脱落的角质细胞及膨大的椭圆形上皮细胞,提示大鼠可能处于动情期及动情前期。OVX组与ZCW组只有透明蓝黑色核深染的白细胞和少量较小的扁平上皮细胞,提示OVX组与ZCW组大鼠均无动情周期。
2.8 IL-1β检测及分析
给药4 周后,大鼠主动脉取血检测血清IL-1β。3组大鼠血清IL-1β水平比较,差异有统计学意义(P<0.05);其中OVX组、ZCW组大鼠血清IL-1β水平均高于SHAM组,而ZCW组大鼠血清IL-1β水平低于OVX组,差异有统计学意义(P<0.05),见表4。
3 讨论
目前研究发现雌激素能够减少听力的损失,绝经期使用MHT能够减缓女性绝经时带来的HL[2-4]。但由于雌激素是具有多种功能的类固醇激素,在身体的其他组织和器官的细胞内也有受体,因此临床上并没有针对PMS-HL的症状而使用MHT。
左慈丸是治疗肾虚类耳聋的名方,临床研究数据表明,左慈丸可治疗感音性耳聋、老年性耳聋以及慢性分泌性中耳炎导致听力下降等疾病;研究发现左慈丸可能通过抗氧化应激以及影响细胞的自噬与凋亡通路,进而缓解年龄相关的HL[6-8]。但目前没有针对左慈丸治疗PMS-HL的相关研究。本研究创新性地将围绝经期与HL的疾病靶点进行汇总导出并取得交集,从而获得PMS-HL的潜在治疗靶点。
通过网络药理学对左慈丸中药成分进行研究,根据“左慈丸-活性成分-药物靶点”网络图,发现其活性成分排名靠前的为槲皮素,山柰酚、豆甾醇、β-谷甾醇、异鼠李素、薯蓣皂苷、四氢鸭脚木碱和海风藤酮。其中,槲皮素、山柰酚、豆甾醇和β-谷甾醇均为左慈丸中多味中药共同含有的活性成分。进一步对其活性成分的治疗靶点与PMS-HL靶点取交集,筛选潜在靶基因,并进行富集分析。GO富集结果提示,靶蛋白主要集中在细胞的细胞膜筏、囊泡腔以及转录调节复合体等位置,生物过程主要表现为对异种刺激的反应、对激素的反应和对无机化合物的反应,其生物功能表现为蛋白激酶结合、DNA结合转录因子结合以及蛋白质结构域的特异性结合。KEGG分析提示,在基因靶点富集的疾病通路中,前3名分别是:癌症通路、脂质与动脉粥样硬化病变通路和化学致癌的受体激活通路。
既往研究表明,耳聋的发病与伴随衰老出现的代谢异常明显相关;血黏度、血脂增高以及动脉粥样硬化和糖尿病等可作为独立因素导致听功能异常的发生[29-30]。左慈丸中的黄酮类活性成分:槲皮素、山柰酚、异鼠李素以及海风藤酮具有显著的抗氧化、抗肿瘤、抗炎、降血脂以及免疫保护等药理作用和生物活性[31-32];有研究发现,该类化合物能缓解慢性中耳炎、氧化应激等导致的HL[33-34]。左慈丸中植物甾醇类活性成分:β-谷甾醇和豆甾醇具有抗氧化、降血糖、降低胆固醇的作用[35-36],但目前没有研究发现该类化合物与听力直接相关,提示该类活性化合物可能通过血糖、血脂的调节及抗氧化应激等途径间接保护听力功能。左慈丸中多种中药共有的活性成分具有一致性,这也体现了中药配伍中的“相须”和“相使”原则,即性能相似者以增强疗效;作用在同一生物学通路者,一种药物可以辅助另一种药物来提高其原有的疗效。
PPI网络中排名前8位的靶基因AKT1、TP53、VEGFA、IL-6、CASP3、IL-1β、EGFR、ESR1等,体现了中药复方多靶点治疗的特点。通过分子对接结合能数据发现,核心蛋白与核心活性成分之间的结合能均≤-2.0 kcal/mol,说明药物和靶蛋白之间具有较好的结合能力,相互作用稳定。其中,综合结合能最为稳定的是IL-1β和ESR1。IL-1β是IL-1家族中最为重要的成员,IL-1家族在生物体先天性免疫中发挥着重要作用。有动物研究发现,当胰岛素生长因子1缺乏时,在噪声暴露环境下的衰老大鼠血清IL-1β水平增多,HL更为明显[37],这可能是造成糖尿病HL的病理机制。并有研究发现,衰老、噪声以及耳毒性药物导致的HL都会引起血清IL-1β水平增多[38]。本研究建立去势模型,验证了雌激素缺失可导致血清IL-1β水平升高,而左慈丸治疗能够降低其血清IL-1β水平。该结果提示,左慈丸可能是通过IL-1β调控其下游,进而减少HL。ESR1是雌激素受体α,在前期研究中发现,该蛋白在内、外毛细胞和螺旋神经节上均有分布;雌激素的减退会影响外毛细胞中的动力蛋白含量,并会导致大鼠高频听力听阈升高[39]。本研究结果显示,左慈丸中的活性成分可能与ESR1结合,发挥雌激素样作用,从而减少雌激素导致的HL。但由于没有对雌激素通路下游的蛋白进行检测,左慈丸是否具有雌激素同样的分子生物学功能仍有待验证。
综上所述,本研究利用网络药理学和分子对接技术,初步研究左慈丸治疗PMS-HL的作用机制,阐述左慈丸可能通过其活性成分槲皮素、山柰酚、豆甾醇、β-谷甾醇、异鼠李素、薯蓣皂苷、四氢鸭脚木碱和海风藤酮,作用于AKT1、EGFR、TP53、VEGFA、IL-6、CASP3、IL-1β、ESR1等靶点,通过癌症通路、脂质代谢与动脉粥样硬化病变通路以及化学致癌的受体激活等通路,多靶点、多通路协同保护听力。研究结果体现了中药复方配伍的严谨性和实用性,为阐明PMS-HL生理病理过程以及左慈丸对该症的治疗作用及其机制奠定理论基础。但本研究受实验条件影响,未能对左慈丸入血的有效成分进行进一步探索,仅利用分子结合能推理出关键蛋白,并进行动物实验验证。可能会忽略其他化合物,从而错失更为关键的靶蛋白。此外,期待未来的研究能够对动物进行测听验证,进一步完善实验。
作者贡献:刁翯负责设计文章思路與框架,绘制图表,动物实验,数据结果和可视化呈现,撰写论文,对文章整体负责;白文佩、赵立东负责论文终稿审校及质量控制。
本文无利益冲突。
参考文献
中华医学会妇产科学分会绝经学组. 中国绝经管理与绝经激素治疗指南2023版[J]. 中华妇产科杂志,2023,58(1):4-21. DOI:10.3760/cma.j.cn112141-20221118-00706.
CURHAN S G,ELIASSEN A H,EAVEY R D,et al. Menopause and postmenopausal hormone therapy and risk of hearing loss[J]. Menopause,2017,24(9):1049-1056. DOI:10.1097/GME.0000000000000878.
WILLIAMSON T T,ZHU X X,PINEROS J,et al. Understanding hormone and hormone therapies' impact on the auditory system[J]. J Neurosci Res,2020,98(9):1721-1730. DOI:10.1002/jnr.24588.
HEDERSTIERNA C,HULTCRANTZ M,COLLINS A,et al. Hearing in women at menopause. Prevalence of hearing loss,audiometric configuration and relation to hormone replacement therapy[J]. Acta Oto Laryngol,2007,127(2):149-155. DOI:10.1080/00016480600794446.
刁翯,赵立东,白文佩. 雌激素对听力损失影响的研究进展[J]. 中国妇产科临床杂志,2019,20(4):382-384. DOI:10.13390/j.issn.1672-1861.2019.04.029.
国家药典委员会. 中华人民共和国药典-一部:2020年版[M]. 北京:中国医药科技出版社,2020.
严阿建,俞英英. 耳聋左慈丸联合声音疗法治疗肾精亏虚型慢性耳鸣临床研究[J]. 新中医,2023,55(3):151-154. DOI:10.13457/j.cnki.jncm.2023.03.033.
邹龙英. 耳聋左慈丸治疗老年性耳聋临床研究[J]. 新中医,2020,52(23):25-27. DOI:10.13457/j.cnki.jncm.2020.23.006.
游娇娇,裴秋萍,王小伟. 耳聋左慈丸对大鼠年龄相关性听力减退的干预作用及对耳蜗组织SOD、MDA水平的影响[J]. 内蒙古中医药,2023,42(1):126-128. DOI:10.16040/j.cnki.cn15-1101.2023.01.039.
HOPKINS A L. Network pharmacology[J]. Nat Biotechnol,2007,25(10):1110-1111. DOI:10.1038/nbt1007-1110.
叶坤,雷敏,谢欣,等. 基于网络药理学与分子对接技术探讨黄芪建中汤治疗腹泻型肠易激综合征的作用机制研究[J]. 中国全科医学,2022,25(15):1814-1824. DOI:10.12114/j.issn.1007-9572.2022.02.014.
PINZI L C,RASTELLI G. Molecular docking:shifting paradigms in drug discovery[J]. Int J Mol Sci,2019,20(18):4331. DOI:10.3390/ijms20184331.
RU J L,LI P,WANG J N,et al. TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].
J Cheminform,2014,6:13. DOI:10.1186/1758-2946-6-13.
DAINA A,MICHIELIN O,ZOETE V. SwissADME:a free web tool to evaluate pharmacokinetics,drug-likeness and medicinal chemistry friendliness of small molecules[J]. Sci Rep,2017,7:42717. DOI:10.1038/srep42717.
CONSORTIUM U. UniProt:a worldwide hub of protein knowledge[J]. Nucleic Acids Res,2019,47(D1):D506-515. DOI:10.1093/nar/gky1049.
STELZER G,ROSEN N,PLASCHKES I,et al. The GeneCards suite:from gene data mining to disease genome sequence analyses[J]. Curr Protoc Bioinformatics,2016,54:1.30.1-1.30.33. DOI:10.1002/cpbi.5.
AMBERGER J S,BOCCHINI C A,SCHIETTECATTE F,et al. OMIM.org:online Mendelian Inheritance in Man(OMIM?),an online catalog of human genes and genetic disorders[J]. Nucleic Acids Res,2015,43(Database issue):D789-798. DOI:10.1093/nar/gku1205.
LI Y H,YU C Y,LI X X,et al. Therapeutic target database update 2018:enriched resource for facilitating bench-to-clinic research of targeted therapeutics[J]. Nucleic Acids Res,2018,46(D1):D1121-1127. DOI:10.1093/nar/gkx1076.
LAW V,KNOX C,DJOUMBOU Y,et al. DrugBank 4.0:shedding new light on drug metabolism[J]. Nucleic Acids Res,2014,42(Database issue):D1091-1097. DOI:10.1093/nar/gkt1068.
WHIRL-CARRILLO M,HUDDART R,GONG L,et al. An evidence-based framework for evaluating pharmacogenomics knowledge for personalized medicine[J]. Clin Pharmacol Ther,2021,110(3):563-572. DOI:10.1002/cpt.2350.
BARDOU P,MARIETTE J,ESCUDI? F,et al. Jvenn:an interactive Venn diagram viewer[J]. BMC Bioinformatics,2014,15(1):293. DOI:10.1186/1471-2105-15-293.
SHANNON P,MARKIEL A,OZIER O,et al. Cytoscape:a software environment for integrated models of biomolecular interaction networks[J]. Genome Res,2003,13(11):2498-2504. DOI:10.1101/gr.1239303.
SZKLARCZYK D,MORRIS J H,COOK H,et al. The STRING database in 2017:quality-controlled protein-protein association networks,made broadly accessible[J]. Nucleic Acids Res,2017,45(D1):D362-368. DOI:10.1093/nar/gkw937.
ZHOU Y Y,ZHOU B,PACHE L,et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun,2019,10(1):1523. DOI:10.1038/s41467-019-09234-6.
KIM S,THIESSEN P A,BOLTON E E,et al. PubChem substance and compound databases[J]. Nucleic Acids Res,2016,44(D1):D1202-1213. DOI:10.1093/nar/gkv951.
BURLEY S K,BERMAN H M,KLEYWEGT G J,et al. Protein data bank (PDB):the single global macromolecular structure archive[J]. Methods Mol Biol,2017,1607:627-641. DOI:10.1007/978-1-4939-7000-1_26.
MORRIS G M,HUEY R,LINDSTROM W,et al. AutoDock4 and AutoDockTools4:automated docking with selective receptor flexibility[J]. J Comput Chem,2009,30(16):2785-2791. DOI:10.1002/jcc.21256.
TROTT O,OLSON A J. AutoDock Vina:improving the speed and accuracy of docking with a new scoring function,efficient optimization,and multithreading[J]. J Comput Chem,2010,
31(2):455-461. DOI:10.1002/jcc.21334.
NIEMAN C L,OH E S. Hearing loss[J]. Ann Intern Med,2020,173(11):ITC81-96. DOI:10.7326/AITC202012010.
SHAFIEPOUR M,BAMDAD Z,RADMAN M. Prevalence of hearing loss among patients with type 2 diabetes[J]. J Med Life,2022,15(6):772-777. DOI:10.25122/jml-2021-0300.
SERBAN M C,SAHEBKAR A,ZANCHETTI A,et al. Effects of quercetin on blood pressure:a systematic review and meta-analysis of randomized controlled trials[J]. J Am Heart Assoc,2016,
5(7):e002713. DOI:10.1161/JAHA.115.002713.
ACHETE DE SOUZA G,DE MARQUI S V,MATIAS J N,et al. Effects of ginkgo biloba on diseases related to oxidative stress[J]. Planta Med,2020,86(6):376-386. DOI:10.1055/a-1109-3405.
CASTA?EDA R,NATARAJAN S,JEONG S Y,et al. Traditional oriental medicine for sensorineural hearing loss:can ethnopharmacology contribute to potential drug discovery?[J]. J Ethnopharmacol,2019,231:409-428. DOI:10.1016/j.jep.2018.11.016.
MA Y K,CHEN Y B,LI P. Quercetin inhibits NTHi-triggered CXCR4 activation through suppressing IKKα/NF-κB and MAPK signaling pathways in otitis media[J]. Int J Mol Med,2018,
42(1):248-258. DOI:10.3892/ijmm.2018.3577.
MO Z S,XU P Q,LI H Y. Stigmasterol alleviates interleukin-1beta-induced chondrocyte injury by down-regulatingsterol regulatory element binding transcription factor 2 to regulateferroptosis[J]. Bioengineered,2021,12(2):9332-9340. DOI:10.1080/21655979.2021.2000742.
BABU S,JAYARAMAN S. An update on β-sitosterol:a potential herbal nutraceutical for diabetic management[J]. Biomed Pharmacother,2020,131:110702. DOI:10.1016/j.biopha.2020.110702.
CELAYA A M,RODR?GUEZ-DE LA ROSA L,BERM?DEZ-MU?OZ J M,et al. IGF-1 haploinsufficiency causes age-related chronic cochlear inflammation and increases noise-induced hearing loss[J]. Cells,2021,10(7):1686. DOI:10.3390/cells10071686.
CHEN P,HAO J J,LI M W,et al. Integrative functional transcriptomic analyses implicate shared molecular circuits in sensorineural hearing loss[J]. Front Cell Neurosci,2022,16:857344. DOI:10.3389/fncel.2022.857344.
DIAO H,ZHAO L,QIN L,et al. Lower expression of prestin and MYO7A correlates with menopause-associated hearing loss[J]. Climacteric,2019,22(4):361-369. DOI:10.1080/13697137.2018.1547698.
