番茄环纹斑点病毒核衣壳蛋白N的RT-LAMP检测方法的建立
2024-01-25罗海燕李恒陆承聪魏辉郑雪陈勇
罗海燕 李恒 陆承聪 魏辉 郑雪 陈勇

关键词:番茄环纹斑点病毒;核衣壳蛋白N;逆转录环介导等温扩增技术;检测
植物病毒病素有“植物癌症”之称,是导致作物减产和品质下降的主要因素之一,全球每年因植物病毒病害造成的经济损失高达300亿美元。在已报道的1484种植物病毒病害中,70%以上由媒介昆虫传播。番茄环纹斑点病毒(Tomato zonate spot virus,TZSV)属正番茄斑萎病毒属(Orthotospovirus),于2005年在我国云南省被首次发现并报道,自然状态下主要侵染番茄(So-lanum lycopersicum)、辣椒(Capsicum annuum)、烟草(Nicotiana tabacum)和马铃薯(Solanum tuberos-Mm)等20多种作物及杂草,主要由西花蓟马(Franilclinella occz,dentalis)、梳缺花蓟马(F.shcu-letzi)、棕榈蓟马(Thrips palmi)等蓟马类昆虫以持久增殖型方式传播,也可通过机械摩擦传播。近年来,除云南外,在北京、贵州及广西的辣椒、番茄产区也检测到该病毒病发生,危害有蔓延至周边省份的趋势。建立一种高效、特异、灵敏的检测方法对TZSV的预警及发病规律研究具有重要意义。
逆转寻环介导等温扩增技术(reverse tran-scription loop-mediated isothermal amplification,RT-LAMP)是将环介导等温扩增与逆转录反应相结合直接检测RNA的方法,当被检RNA与反应混合物中的pH指示剂耦合时,可通过颜色变化获得检测结果。RT-LAMP技术已被广泛应用于粮食、果树、蔬菜等农作物病毒病的检测。李战彪等建立了基于TZSV RNA聚合酶(RNA-dependent RNA polymerase, RdRp)的RT-LAMP技术。但迄今国内外未见有利用该技术检测TZSV核衣壳蛋白N(nucleocapsid protein N)的报道。本研究根据TZSV核衣壳蛋白N的基因序列设计RT-LAMP引物,建立快速高效、特异灵敏的TZSV RT-LAMP检测体系,以期为TZSV的鉴定及防控提供技术支持。
1材料与方法
1.1试验材料
1.1.1供试病叶及病毒感染TZSV、番茄斑萎病毒(Tomato spotted wilt virus,TSWV)和烟草花叶病毒(Tobacco mosazicVLrUS,TMV)的辣椒葉片均由云南省农业科学院生物技术与种质资源研究所提供,经RT-PCR检测确定病毒种类后,-80℃保存备用。携带TZSV-Ⅳ基因的质粒pTOPO-TZSV-N由福建省农业科学院植物保护研究所生物安全实验室构建并保存。
1.1.2主要试剂TransZol Plant多糖植物总RNA提取试剂盒、EasyScript Reverse Transcriptase反转录试剂盒、Trans2k Plus DNA Marker、dNTPs均购自北京全式金生物技术有限公司:Bst DNA聚合酶、10xBst Reaction Buffer购自生工生物工程(上海)股份有限公司;SYBR Green I和甜菜碱购自北京索莱宝科技有限公司;Bst聚合酶、Mg-S04购自New England Biolabs(美国);其他试剂均为常规分析纯试剂。
1.1.3主要仪器Bio-rad TlOO PCR仪、MINI-PRATEA电泳仪、Bio Rad SYSTEM GelDocXR+凝胶成像系统均购自美国Bio -rad公司。
1.2试验设计与方法
1.2.1引物设计根据GenBank中TZSV-N基因序列(登录号:MG656995.1),利用Primer Ex-plorer V4软件设计RT-LAMP犷增引物,其中F3和B3为外引物、FIP和BIP为内引物(表1),由福州尚亚生物技术有限公司合成。
1.2.2总RNA提取及cDNA合成按照TransZolPlant试剂盒操作说明提取病叶总RNA(终浓度1ug/uL),-80℃保存备用。以RNA为模板,利用EasyScript Reverse Transcriptase试剂盒合成cDNA,-20℃保存备用。
1.2.3RT-LAMP和RT-PCR反应体系
25uLRT-LAMP反应体系:8U/uL Bst 2.0 DNA聚合酶反应条件:60℃1h,80℃5min。反应结束后,加入2.0uL SYBRGreen I核酸染料,观察颜色反应;或取5uL扩增产物1%琼脂糖凝胶电泳后凝胶成像仪观察、拍照。
1.2.4特异性及灵敏度检测分别以感染TZSV、TSWV、TMV的辣椒叶片总RAN为模版,利用建立的反应体系进行RT-LAMP扩增和1%琼脂糖凝胶电泳检测,与RT-PCR扩增结果对比,明确该方法的特异性。
将感染TZSV的总RNA用RNase-free H2010倍梯度稀释(1.0x10-1~1.0x10-9),以稀释后的RNA为模板,分别进行RT-LAMP和RT-PCR扩增,1%琼脂糖凝胶电泳检测扩增产物,比较两者的灵敏度。
1.3RT-LAMP方法的应用
秋冬季从云南省采集疑似感染TZSV的辣椒叶片,提取总RNA,利用本试验建立的RT-LAMP和普通RT-PCR体系扩增,1%琼脂糖凝胶电泳检测扩增产物。RT-LAMP反应产物中加入2.0uLSYBR Green I核酸染料,阳性为绿色,阴性为橙色。
2结果与分析
2.1RT-LAMP引物筛选
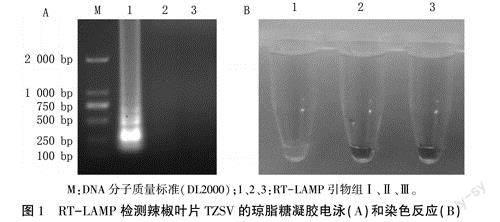
以质粒pTOPO-TZSV-N为模板,进行RT-LAMP反应,1%琼脂糖凝胶电泳检测表明,引物组I产生典型的LAMP梯状条带,扩增效果最好,其余两组无明显的梯状条带(图1A);终止反应后向反应液中加入SYBR Green I,可见引物组I变为绿色,其余两组为橙色(图1B)。因此,选择第1组引物进行特异性和灵敏度检测。
2.2RT-LAMP的特异性检测
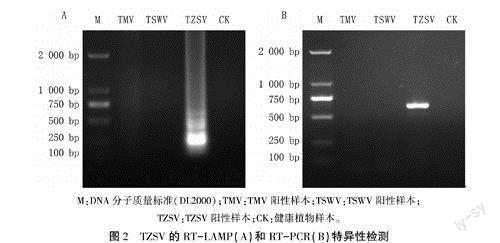
以TZSV阳性样本为阳性对照,健康植物样本为阴性对照,对TMV和TSWV阳性样本进行RT-LAMP检测。结果显示,只有TZSV阳性样品出现梯状条带,其它病毒和健康植物样本中未产生梯状条带,与RT-PCR检测结果相同(图2),说明建立的TZSV
RT-LAMP检测方法具有较强的特异性。
2.3RT-LAMP的灵敏度检测
将1ug/uL的TZSV总RNA进行10倍梯度稀释,以不同浓度RNA为模板分别进行RT-LAMP和RT-PCR扩增。结果显示,RNA浓度被稀释至0.01pg/uL(10-8)时,RT-LAMP方法仍能检测出TZSV(图3A),而RT-PCR只能检测到RNA浓度稀释至0.1pg/uL(10-7)的样品(图3B),表明RT-LAMP检测方法的灵敏度是RT-PCR的10倍。
2.4RT-LAMP技术的田间检测应用
对采自云南省的疑似感染TZSV的辣椒叶片进行RT-LAMP和RT-PCR检测。结果显示,6份样品中利用RT-LAMP方法检测出4份TZSV阳性样品,与RT-PCR检测结果一致。向RT-LAMP反应产物中加入SYBR Green I核酸荧光染料,阳性样品迅速变为绿色,阴性样品为橙色,结果一致(图4)。综上,本研究建立的RT-LAMP检测法可用于田间辣椒TZSV快速检测。
3讨论与结论
关于TZSV的检测,目前已建立了血清学、电镜观察、分子生物学等技术。与血清学、电镜观察等手段相比,RT-PCR和RT-qPCR等分子生物学方法灵敏度较高、特异性较强,是TZSV检测最常用的方法,但在日常病害诊断中耗时长、操作繁琐且受限于高精度的实验仪器。本研究根据TZSV的核衣壳蛋白Ⅳ基因设计引物,建立了TZSV的RT-LAMP检测技术,具有操作简便、特异性和灵敏度高、反应时间短、无需贵重仪器等优点,扩增产物既可凝胶电泳检测,也可依据颜色变化可视化判定,为生产及科研单位快速诊断TZSV提供了技术支持。
特异性是检测RT-LAMP技术最为重要的指标之一。TZSV是茄科作物上的重要病原菌,与正番茄斑萎病毒属(Orthotospovirus)代表种TSWV同为云南地区蔬菜上的优势病毒,常交替或同时发生。李战彪等报道了基于TZSV-RdRp的RT-LAMP检测方法,但未明确其是否能特异性区分TZSV与TSWV。本研究以TZSV-N为靶标基因设计筛选了其RT-LAMP特异性引物,有效扩增到TZSV,未扩增到TSWV,表现出较高的特异性。
通常,RT-LAMP检测的灵敏度要高于普通RT-PCR。本研究建立的TZSV RT-LAMP方法RNA濃度检测下限为0.01 pg/uLL,是RT-PCR灵敏度的10倍,也略高于基于TZSV-RdRp的RT-LAMP方法。此外,由于TZSV侵染引起的病症存在低温隐症现象,给病害的诊断造成一定困难。本研究对秋冬季采自云南的6份辣椒叶片疑似病样进行鉴定,检测结果与RT-PCR一致,表明建立的RT-LAMP检测技术对隐症或病毒含量较低的样品也可有效检测。
综上,本研究建立的TZSV-N基因的RT-LAMP检测方法能够特异扩增TZSV,灵敏度为RT-PCR的10倍。在RT-LAMP反应产物中加入SYBR Green I核酸荧光染料用肉眼观察即可判断样品是否感染TZSV.该结论可为TZSV的鉴定及防控提供技术支持。
