实时荧光定量聚合酶链式反应检测石蜡样本结核DNA时有关切片量的控制及优化
2024-01-25蒋鸿雁王浩君陈忠宜
蒋鸿雁,何 姣,王浩君,陈忠宜
(遂宁市中心医院,四川 遂宁 629000)
结核病(TB)由结核分枝杆菌引起,通过呼吸道在人与人之间传播,具有传播速度快、传播面广、易感染的特点。结核分枝杆菌具有高致病性,常引起肺部感染,且淋巴结、脑、肾脏和脊柱也会受到侵袭[1]。最常见的检查手段为影像学和免疫学检查,但也有局限性,在鉴别肺部结核和感染性疾病方面较为困难,需取活组织进行病理学检查确诊,而传统病理诊断主要依靠镜下形态和抗酸染色结果相结合,但抗酸染色阳性率低、费力、耗时[2],也逐渐被分子检测所取代[3-5]。在分子检测中,最常用的就是实时荧光定量聚合酶链式反应(RT-PCR)检测结核分枝杆菌复合群。在实验操作过程中,由于实验人员对切片数量、切片厚度的把控不同,导致了对切片量的控制不同,直接影响核酸的提取效率,影响样本的浓度和纯度,在一定程度上会影响实验的效果。有学者[6]指出,高质量的DNA是分子检测的基础,而DNA的质量一般从DNA的浓度、纯度以及DNA的完整性三方面进行评估。因此,本文着重探讨规范切片厚度和切片数量对RT-PCR检测石蜡样本结核DNA浓度和纯度的影响,以提高样本DNA的效用,确保结核病理诊断准确性,为临床和患者提供可靠诊疗依据。
1 材料与方法
1.1 材料
收集2022年11月—2023年5月遂宁市中心医院病理科诊断为疑似结核的石蜡样本组织216 例,根据诊断需要,切取一定量的石蜡样本组织,用于RT-PCR检测,并记录其DNA的浓度和纯度。本实验经遂宁市中心医院伦理委员会批准,患者均知情同意。
1.2 主要试剂和仪器
医脉赛核酸提取/纯化试剂盒(嘉兴医脉赛科技有限公司,中国),结核分枝杆菌复合群核酸检测试剂盒(天隆科技有限公司,中国),PCR仪(Roche,德国),核酸浓度检测仪(艾德生物,中国)以及实验用枪头、Leica石蜡切片机、移液枪、PCR八联管、试管架等耗材均由遂宁市中心医院病理科提供。
1.3 实验方法
1.3.1 石蜡样本组织的切片
规范前,根据实验人员对石蜡样本组织的评估,对需要做结核DNA检测的石蜡样本大组织(见图1a)进行切片,切片厚度为4 μm,切片数量为10张;对石蜡样本中等大小的组织(见图1b)进行切片,切片厚度为4 μm,切片数量为12张;对石蜡样本小组织(见图1c)进行切片,切片厚度为4 μm,切片数量为15张。

(a)为大组织;(b)为中等大小组织;(c)为小组织
规范后,实验人员通过前期摸索,根据实验需要对需要做结核DNA检测的石蜡样本大组织(见图1a和图1b)进行切片,切片厚度为6 μm,切片数量为4~6张;对中等大小的穿刺组织(见图2)进行切片,切片厚度为6 μm,切片数量为8~15张;对石蜡样本小组织(见图1c)进行切片,切片厚度为6 μm,切片数量为15~20张。

图2 石蜡样本穿刺组织
1.3.2 核酸提取
参考医脉赛核酸提取/纯化试剂盒对石蜡样本组织进行DNA提取,详细操作步骤如下。第一,样本前处理:将切取的石蜡组织切片转移至1.5 mL离心管中;加入300 μL石蜡样本液,150 μL石蜡消化液A和20 μL蛋白酶K,置于56 ℃恒温金属浴消化过夜;次日,将150 μL石蜡消化液B加入标本管,充分混匀后,70 ℃恒温金属浴消化2 h。第二,DNA的提取:4 ℃,10 000 g离心10 min;离心后,小心吸取全部下层液体,加入300 μL裂解吸附液、20 μL核酸提取磁珠、10 μL核酸提取液颠倒混匀15 min;用磁分离架吸附磁珠1 min,弃上清;加入600 μL洗涤液Ⅰ洗涤磁珠,颠倒混匀洗涤1 min,吸附磁珠,弃上清;再次加入600 μL洗涤液Ⅱ洗涤磁珠1 min,吸附磁珠,弃上清;加入600 μL洗涤液Ⅲ洗涤磁珠1 min,吸附磁珠,弃上清;尽量吸弃上清后,静置5 min,去除乙醇残留;加入50 μL洗脱液,50 ℃混合均匀洗脱10 min;磁场吸附磁珠,回收含基因组DNA的洗脱液至另一干净离心管内,以备实验需要(-20 ℃储存)。
通过核酸浓度检测仪,对样本进行浓度和纯度检测,参照操作说明书:用焦碳酸二乙酯(DEPC)水调零后,吸取2 μL待测DNA溶液滴在检测探头上,放下悬臂,检测读取A260/A280和DNA的浓度值。提起悬臂,用干净卫生纸除去DNA溶液,用DEPC水清洗,擦去DEPC水后检测下一个样本,并记录详细数值。
1.3.3 PCR扩增
参照试剂说明书,根据实验需要,将提取到的DNA溶液取4 μL加入到36 μL的体系中按预设程序进行PCR扩增(40个循环),实验结束后收集FAM通道荧光信号,并记录数据。
1.4 参考标准
1.4.1 DNA的浓度
不同检测方法或检测试剂盒对被检查样本的DNA浓度要求不尽相同。根据不同实验目的、实验方法和检测平台的需要,认为将DNA浓度控制在60.00~600.00 ng/μL比较好[6]。
1.4.2 DNA的纯度
DNA的A260/A280的正常值为1.80~2.00[6]。
2 结 果
2.1 规范前后石蜡样本组织的DNA浓度评价
实验过程中,对每一个样品进行浓度检测,其中详细记录样本浓度者216 例。本研究通过统计规范切片厚度和切片数量前后的DNA浓度发现,规范切片前,样本DNA浓度为2.25~1 373.00 ng/μL,平均浓度128.70 ng/μL。规范切片后,样本DNA浓度范围为6.20~1 380.00 ng/μL,DNA的浓度有所增加,平均浓度149.20 ng/μL,其浓度主要集中在20~200 ng/μL(见图3)。对实验中两次DNA浓度超过1 300.00 ng/μL的样本均稀释10倍进行实验。
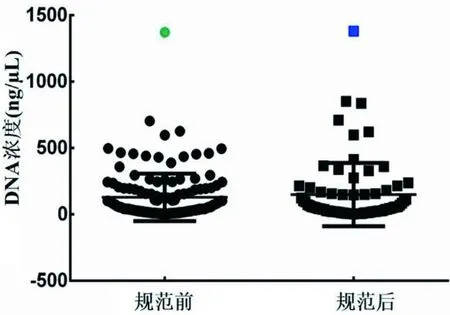
图3 规范前和规范后石蜡样本组织DNA浓度比较
2.2 规范前后石蜡样本组织的DNA纯度评价
实验过程中,对每一个样品进行浓度检测并记录A260/A280的数值,其中详细记录样本纯度者216 例。DNA纯度1.80~2.10为样本纯度较高,否则会存在一定的污染[6]。本研究通过统计规范切片厚度和切片数量前后的DNA纯度发现,规范切片前DNA纯度范围为1.10~2.20。规范切片后,DNA的纯度有所改善,浓度主要集中在1.80~2.27(见图4)。
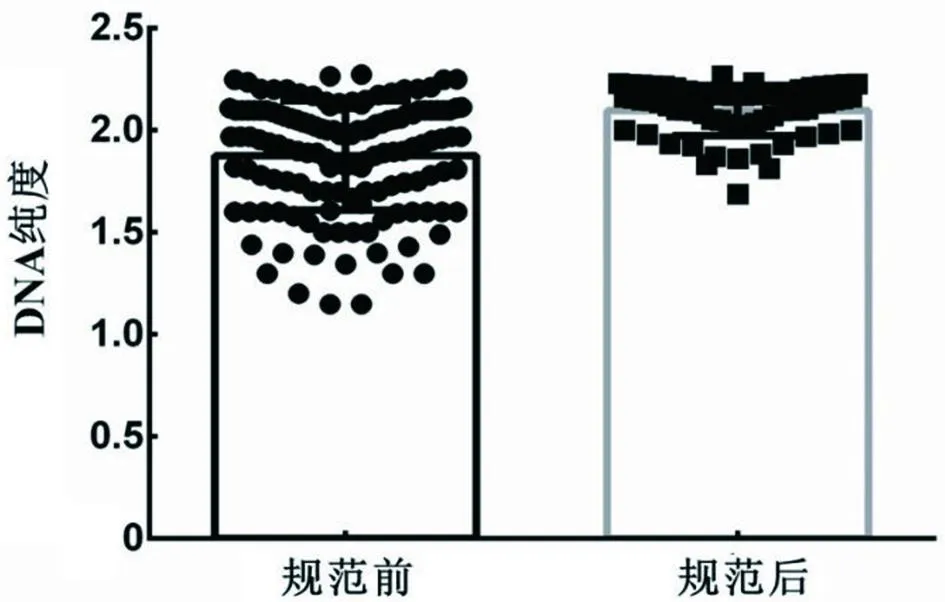
图4 规范前和规范后石蜡样本组织DNA纯度
本研究通过收集规范切片厚度和切片数量前后的DNA浓度和纯度,发现规范切片前,DNA浓度相对较低的样本,其纯度也较低,实验室统计抗酸染色和RT-PCR的符合率(数据待发)发现,均为阴性的符合率为40%,均为阳性的符合率为23%。规范切片后,组织的DNA浓度有所增加,纯度也较高,相对而言改善了样本的质量,实验室统计抗酸染色和RT-PCR的符合率(数据待发),均为阴性的符合率为44%,均为阳性的符合率为25%,在一定程度上确保了实验结果。本研究出现的两个石蜡样本组织的浓度超过1 300 ng/μL,纯度处于2.00~2.10,属于质量较好的样本,根据实验所需,我们稀释了10倍进行实验,结果符合临床症状,且与相关检验/检查相符合,满足诊断需求。
3 讨 论
结核分枝杆菌是结核病的病原体。结核病发展快速且不可逆[7],是由于其独特的致病性和发病过程,导致了结核病诊断面临着发病率高和检出率低的情况[8]。有学者[4]指出,当痰涂片和抗酸染色结果出现阴性时,病理诊断在结核病的确诊中意义重大。随着分子病理学的迅速发展,RT-PCR实验技术的应用在提高石蜡样本结核分支杆菌复合群的检出中发挥着重要作用。RT-PCR检测石蜡样本抗酸杆菌复合群时,最主要的一步是检测DNA分离;不严格控制石蜡组织的切片量,会影响所提取的DNA的浓度和纯度,进而影响RT-PCR检测的灵敏度[9]。因此,我们要重视RT-PCR在石蜡样本结核分枝杆菌复合群检测中的重要性,为结核病的精准诊治提供可靠的病理学依据[10]。
在小标本、肺穿刺组织的结核诊断中,常因为标本较小,实验人员会尽可能地多切组织标本,从而提高总基因组中结核分枝杆菌DNA的数量,但实验发现,当样本切得过多时,组织消化不够,导致结核分枝杆菌不能完全释放,会影响实验结果。但是,每个实验人员对于组织的大小、切片厚度和切片数量的把握都存在一定的差异,因此规范切片厚度和切片数量就极为迫切;同时也希望在未来的工作中有效能更高的试剂盒来辅助提取石蜡样本中的结核分枝杆菌DNA,最大限度使结核分枝杆菌释放出来;或通过特殊滤网拦截基因组较大的标本DNA,滤过相对较小的结核分枝杆菌DNA,尽可能地保留结核分枝杆菌DNA,进而提高结核分枝杆菌的检出率[11]。
本研究结果表明规范切片后样本DNA的浓度和纯度均有所提高。总的来说,为满足本实验室的需要,将样本控制在100~400 ng/μL较为适宜。对DNA浓度超过范围的样本进行适度稀释后再进行实验,这与2018年杨军等[6]在甲醛固定石蜡包埋的组织中提取DNA样本质量评价的多中心调研中提出的方法一致,该调查提出切片量过多和过少都会使实验结果出现误差,对DNA浓度过低的样本需要在现有基础上增加切片量,如增加切片厚度或是增加切片张数等。除了样本DNA的浓度外,DNA的纯度同样对实验结果有影响,样本污染程度也会影响实验结果,这与实验操作过程中是否严格消毒实验环境、规范操作流程有关[6]。
本研究所使用的标本均为石蜡样本,而石蜡样本的DNA质量是获得正确结果的重要保障[12]。本研究基于样本浓度和纯度的结果分析,根据石蜡样本组织的大小,总结了规范切片厚度和切片数量前后的样本DNA浓度和纯度的变化情况(未做统计学分析),而有关样本DNA的完整性还有待进一步分析和探讨。
综上所述,基于本实验室情况,我们根据组织的大小,将切片量控制在24~120 μm,切片厚度为6 μm,详细切片厚度和切片总量参考表1。在整个切片过程中,需要根据组织的大小在建议范围内控制切片量,有利于在进行RT-PCR检测时提高样本DNA的浓度和纯度,有助于提高实验的精确性,减少不必要损耗,确保诊断的正确性。

表1 不同大小组织切片厚度和切片总量参考表
