滋水清肝饮对慢性束缚应激抑郁小鼠皮层ERK/CREB/BDNF 通路及肠道菌群的影响
2024-01-25曹珊珊史磊磊张雨涵史永恒韩朝军刘继平
曹珊珊,史磊磊,张雨涵,史永恒,韩朝军,王 斌,刘继平
陕西中医药大学药学院,陕西 咸阳 712046
重度抑郁症(major depressive disorder,MDD)又称抑郁障碍,是一种常见的精神疾病,其特征是情绪低落、兴趣减退和快乐感减退,发病率为6.4%~10.4%[1-2],严重降低患者生活质量,使预期寿命缩短近10 年[3]。据《医学正传》记载,中医最早以“郁证”为该疾病名称,认为情志内伤为郁证主要因素,脏器虚弱为发病的内在原因,中医临床多配以疏肝、解郁和理气药来治疗郁证[4]。近几十年来,抑郁症引起的全球疾病负担一直在增加,已成为全球残疾的主要原因之一[5],且对MDD 的临床治愈率仅有27%[6],已经成为严重的医学与社会难题。因此,寻找有效防治抑郁症的措施,对降低其发病率,提高治疗率、提升生活质量、减轻医疗费用负担具有重要意义。
滋水清肝饮源自清代名医高鼓峰所著《医宗己任编·四明心法》[7],为六味地黄汤和丹栀逍遥散的化裁方,书中记载:“疏肝益肾汤,凡胃脘痛,大便秘结者,肝血虚也,此方主之,逍遥散所不能愈者,此方妙”。全方共11 味药,具有滋肾养阴、清泻肝火之效,可用于临床治疗抑郁、失眠等精神类疾病。在临床治疗时发现,滋水清肝饮能有效改善患者抑郁状况[8],减轻氧化应激及炎症[9-10]。根据临床研究发现,抑郁症患者的肠道菌群发生改变[11],40%~60%的抑郁症患者下丘脑-垂体-肾上腺(hypothalamicpituitary-adrenal,HPA)轴出现紊乱[12],患者外周血脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)含量降低[13],5-羟色胺(5-hydroxytryptamine,5-HT)合成减少。基于以上临床研究基础,本研究利用慢性束缚应激(chronic restraint stress,CRS)建立小鼠MDD 模型,观察超氧化物歧化 酶 ( superoxide dismutase )、丙 二 醛(malondialdehyde,MDA)、5-HT、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)、皮质酮(corticosterone,CORT)水平以及肠道微生物群的组成和结构,进一步研究其作用机制。
1 材料
1.1 动物
SPF 级雄性C57BL 小鼠54 只,6~8 周,体质量(20±2)g,购自成都达硕实验动物有限公司,动物许可证号SCXK(川)2020-030。垫料和饲料均由成都达硕实验动物有限公司提供,动物饲养于陕西中医药大学中药药理实验动物房。动物实验获得陕西中医药大学动物伦理委员会批准(审查备案编号SUCMDL20210310006)。
1.2 药材
滋水清肝饮(熟地黄10 g、柴胡6 g、泽泻10 g、山茱萸10 g、山药10 g、茯苓10 g、当归10 g、牡丹皮10 g、酸枣仁10 g、白芍10 克、栀子10 g)饮片均购自陕西中医药大学校医院,经陕西中医药大学药学院中药鉴定教研室颜永刚教授分别鉴定为玄参科植物地黄RehmanniaglutinosaLibosch.的新鲜或干燥块根的炮制加工品、伞形科植物柴胡BupleurumchinenseDC 的干燥根、泽泻科植物泽泻Alismaplantago-aquaticaLinn.的干燥块茎、山茱萸科植物山茱萸CornusofficinalisSieb.et Zucc.的干燥成熟果肉、薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎、多孔菌科真菌茯苓Poriacocos(Schw.) Wolf 的干燥菌核、伞形科植物当归Angelica sinensis(Oliv.) Diels 的干燥根、毛莨科植物牡丹PaeoniasuffruticosaAndr.的干燥根皮、鼠李科植物酸枣ZiziphusjujubaMill.var.spinosa(Bunge) Hu ex H.F.Chou 的干燥成熟种子、毛莨科植物芍药PaeonialactifloraPall.的干燥根、茜草科植物栀子GardeniajasminoidesEllis 的干燥成熟果实,均符合《中国药典》2020 年版一部相关规定。
1.3 药品与试剂
盐酸氟西汀(批号33323)购自美国MCE 公司;5-HT 试剂盒(批号20221214)、CRH 试剂盒(批号20221020)、ACTH 试剂盒(批号20221020)、CORT试剂盒(批号20221020)、BDNF 试剂盒(批号20221104)购自上海酶联生物科技有限公司;MDA 试剂盒(批号20230507)、SOD 试剂盒(批号20230508)、BCA 蛋白定量试剂盒(批号20230307)均购自南京建成生物工程研究所;细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)抗体(批号00115457)、p-ERK1/2 抗体(批号00106696)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号10017731)购自美国Proteintech 公司;环磷酸腺苷反应元件结合蛋白(cyclic adenosine monophosphate response binding protein,CREB)抗体(批号4000000113)、p-CREB 抗体(批号5500015117)购自美国Abclonal 公司;羊抗小鼠二抗(BA1050)、羊抗兔二抗(批号BA1051)、BDNF 抗体(批号GB11559)、Iba-1 抗体(批号GB113502-100)、超敏ECL化学发光液(批号AR1197)购自武汉博士德生物工程有限公司。
1.4 仪器
EPOCH2NS 型酶标仪(美国Bio-Tek 公司);BSA224S 型分析电子天平(德国Sartorius 公司);UPHW-II-90T 型纯水仪(成都超纯科技有限公司);1-15K 型低温高速离心机(美国Sigma 公司);Nikon Eclipse C1 型正置荧光显微镜(日本尼康公司)。
2 方法
2.1 滋水清肝饮的制备
滋水清肝饮总方106 g,按照处方配比称取药材,先用10 倍量的水浸泡40 min,用煎药砂锅武火煮沸后转文火慢煎1 h,趁热滤过,再加8 倍量水,武火煮沸后转文火慢煎40 min,合并滤液后浓缩为生药量为2 g/mL 的液体。滋水清肝饮方中,山茱萸、山药为君药,白芍、柴胡为臣药,其主要成分有马钱苷、阿魏酸、芍药苷及柴胡皂苷。参照《中国药典》2020 年版一部相关规定,经高效液相色谱仪测定马钱苷、阿魏酸、芍药苷、柴胡皂苷A 的质量分数分别为(0.221 7±0.008 3)%、(0.018 5±0.000 5)%、(0.963 5±0.002 5)%、(0.332 7±0.002 5)%。
2.2 动物分组、造模及给药
小鼠适应性喂养7 d,对照组9 只不做处理,造模组45 只采用自制打孔离心管对小鼠进行21 d 慢性束缚应激处理,每天定时将小鼠禁锢于安静昏暗的环境6 h[14-15]。造模结束后,对全部小鼠进行糖水偏好实验。根据小鼠糖水偏好结果对造模组小鼠进行随机分组,分别为模型组、盐酸氟西汀(0.01 g/kg)组和滋水清肝饮低、中、高剂量(8.835、17.670、35.340 g/kg,分别相当于临床剂量的0.5、1、2 倍)组,每组9 只。各给药组ig 相应药物(20 mL/kg),对照组和模型组ig 等体积的生理盐水,1 次/d,连续给药14 d。给药30 min 后,除对照组外,其余小鼠继续进行慢性束缚应激处理。
2.3 行为学检测
2.3.1 糖水偏好实验 分别在给药前及给药第7、14 天后进行糖水偏好实验。每只小鼠置于配有2 个相同水瓶的笼中单独饲养,2 个瓶子分别装有1%蔗糖水和饮用水。第1 天在适应24 h 后,互换1%糖水和饮用水的水瓶位置,第2 天继续适应24 h。第3 天对所有小鼠进行断水禁食处理24 h,结束后进行2 h 的糖水偏好实验。糖水偏好实验前分别称定1%糖水和自来水瓶质量,2 h 后取下2 个瓶子,再次称定质量,计算糖水偏好率。
糖水偏好率=糖水饮用量/(自来水饮用量+糖水饮用量)
2.3.2 悬尾实验 分别在给药第7、14 天后进行悬尾实验。将小鼠倒挂在头部距离地面20 cm 高度的装置上,视频记录小鼠6 min 内的悬尾状态,当小鼠表现为被动的悬挂且没有任何的肢体活动时被判定为不动,用秒表计算后4 min 内的累计不动时间。
2.3.3 强迫游泳实验 分别在给药第7、14 天后进行强迫游泳实验。将小鼠放入高24.5 cm、直径为16 cm 的高硼硅玻璃容器中,容器中盛有20 cm 高度的水,且水温保持在(23±2)℃,视频记录小鼠在6 min 的游泳状态,当小鼠在容器中没有明显的游泳动作时被认为漂浮不动,用秒表计算后4 min 时间段内的累计不动时间。
2.4 全脑及结肠病理观察和海马Iba-1 表达检测
2.4.1 海马、皮层及结肠苏木素-伊红(HE)染色小鼠断颈处死,冰上剥离,取固定24 h 以上的全脑组织及结肠组织样本,制作石蜡切片,片厚4 μm。石蜡切片脱水,脱蜡,苏木素染色3~5 min,自来水洗,返蓝,脱水,伊红染色5 min,脱水,透明,中性树胶封片,显微镜下观察各组小鼠海马CA1区、皮层及结肠组织病理变化。
2.4.2 免疫荧光染色检测海马Iba-1 表达 在脱蜡、水合和抗原修复后,将海马切片固定在4 ℃的4%多聚甲醛溶液中过夜,然后在室温下用正常绵羊血清封闭1 h,滴加Iba-1 抗体(1∶4 000),4 ℃孵育过夜,滴加二抗。DAPI 复染细胞核,淬灭组织自发荧光,封片后镜检扫描,观察海马CA1 区小胶质细胞标志物Iba-1 的表达。DAPI 为蓝色荧光,Iba-1 为绿色荧光。
2.5 血清及前额叶皮质生化指标的检测
小鼠眼眶取血,室温静置30 min 后,3 500 r/min离心15 min,取上清。按照试剂盒说明书检测小鼠血清中SOD 活性和MDA、ACTH、CORT、CRH、5-HT 水平,检测小鼠前额叶皮质SOD 活性和5-HT、BDNF、MDA 水平。
2.6 高通量测序技术测定肠道菌群结构
收集各组小鼠结肠内容物,置于灭菌的EP 管中,−80 ℃冻存。先对微生物组进行总DNA 提取,再对目标片段进行PCR 扩增,扩增产物磁珠纯化收回,将PCR 扩增回收产物进行荧光定量,根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合,采用Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 制备测序文库。上机进行高通量测序,结束后进行筛查分析。
2.7 Western blotting 检测前额叶皮层组织ERK1/2、p-ERK1/2、CREB、p-CREB、BDNF 蛋白表达
取小鼠前额叶皮层,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液,充分研磨,4 ℃离心取上清液,采用BCA 蛋白定量试剂盒测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%脱脂牛奶中封闭,分别加入ERK1/2(1∶1 000)、p-ERK1/2(1∶3 000)、CREB(1∶1 000)、p-CREB(1∶1 000)、BDNF(1∶800)、GAPDH(1∶25 000)抗体,4 ℃过夜;TBST 洗膜3 次,加入二抗室温孵育;TBST 洗膜3 次,滴加ECL 化学发光液显影,利用Image J 软件计算目的蛋白的相对表达量。
2.8 统计学分析
3 结果
3.1 滋水清肝饮对抑郁小鼠行为学的影响
3.1.1 滋水清肝饮对抑郁小鼠糖水偏好率的影响如表1 所示,与对照组比较,给药前模型组及各给药组糖水偏好率显著下降(P<0.01)。给药7 d 后,与模型组比较,盐酸氟西汀组及滋水清肝饮中剂量组糖水偏好率显著上升(P<0.05、0.01)。给药14 d后,各给药组糖水偏好率均显著升高(P<0.01)。
表1 滋水清肝饮对抑郁小鼠糖水偏好率的影响 (±s , n = 9)Table 1 Effect of Zishui Qinggan Yin on sucrose preference rate of depressed mice (±s , n = 9)

表1 滋水清肝饮对抑郁小鼠糖水偏好率的影响 (±s , n = 9)Table 1 Effect of Zishui Qinggan Yin on sucrose preference rate of depressed mice (±s , n = 9)
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下表同。#P < 0.05 ##P < 0.01 vs control group; *P < 0.05 **P < 0.01 vs model group, same as below tables.
组别 剂量/(g·kg−1) 糖水偏好率/%给药前 给药7 d 给药14 d对照 — 90.01±2.16 91.97±3.25 89.55±4.74模型 — 52.76±10.83## 51.88±3.45## 46.36±7.80##盐酸氟西汀 0.01 55.06±13.86## 72.74±5.30* 84.36±9.01**滋水清肝饮 8.835 54.76±9.56## 67.53±12.94 79.90±7.67**17.670 56.02±8.73## 77.30±11.17** 84.53±5.25**35.340 55.40±12.41## 69.59±15.04 80.96±8.27**
3.1.2 滋水清肝饮对抑郁小鼠悬尾实验和强迫游泳实验不动时间的影响 如表2 所示,与对照组比较,模型组小鼠悬尾实验和强迫游泳实验不动时间明显增加(P<0.01)。给药7、14 d 后,与模型组比较,各给药组小鼠悬尾实验不动时间明显缩短(P<0.05、0.01)。给药7 d 后,盐酸氟西汀组及滋水清肝饮中剂量组小鼠强迫游泳不动时间均缩短(P<0.01);给药14 d 后,各给药组小鼠强迫游泳不动时间均明显缩短(P<0.01)。
表2 滋水清肝饮对抑郁小鼠悬尾实验和强迫游泳实验不动时间的影响 (±s, n = 9)Table 2 Effect of Zishui Qinggan Yin on immobility time in tail suspension test and forced swimming test of depressed mice(±s, n = 9)

表2 滋水清肝饮对抑郁小鼠悬尾实验和强迫游泳实验不动时间的影响 (±s, n = 9)Table 2 Effect of Zishui Qinggan Yin on immobility time in tail suspension test and forced swimming test of depressed mice(±s, n = 9)
组别 剂量/(g·kg−1) 悬尾不动时间/s 强迫游泳不动时间/s给药7 d 给药14 d 给药7 d 给药14 d对照 — 88.32±13.22 90.19±23.18 86.11±12.59 80.37±11.62模型 — 150.15±15.17## 154.35±8.50## 146.39±14.36## 150.42±16.57##盐酸氟西汀 0.01 101.01±8.33* 97.07±14.23** 101.92±8.65** 87.59±15.98**滋水清肝饮 8.835 125.46±9.48* 116.94±15.13* 126.77±15.00 120.01±14.57**17.670 108.46±9.48* 100.94±16.13** 102.06±20.13** 90.65±16.36**35.340 120.3±20.95* 115.54±25.95* 133.23±18.28 118.95±10.78**
3.2 滋水清肝饮对抑郁小鼠全脑及结肠病理变化的影响
3.2.1 滋水清肝饮对抑郁小鼠海马CA1 区、皮层组织及结肠组织病理变化的影响 如图1 所示,对照组小鼠海马CA1 区及皮层组织中神经细胞轮廓清晰,形态饱满。与对照组比较,模型组细胞变形,轮廓模糊且颜色被深染,结构形态较差,细胞核出现固缩。与模型组比较,滋水清肝饮低剂量组部分神经细胞形态结构发生改变,存在核固缩现象,其余各给药组细胞神经细胞的形态基本正常,核固缩现象减少。对照组小鼠结肠黏膜上皮完整,排列规则,肠隐窝结构正常,呈单管状。与正常组相比,模型组小鼠结肠排列松散严重,怀状细胞缺失肠隐窝萎缩且表面不规则,腺体受损严重。与模型组比较,各给药组小鼠结肠组织损伤均减轻。

图1 滋水清肝饮对抑郁小鼠海马CA1 区、皮层组织及结肠组织病理变化的影响 (HE, ×200)Fig.1 Effect of Zishui Qinggan Yin on pathological changes in hippocampal CA1 region, cortical tissue and colon tissue of depressed mice (HE, × 200)
3.2.2 滋水清肝饮对抑郁小鼠海马CA1 区Iba-1 表达的影响 如图2 所示,与对照组比较,模型组小鼠海马组织中出现大量小胶质细胞增生,突起回缩,胞体增大;与模型组比较,各给药组小胶质细胞标志物Iba-1 表达明显减少。
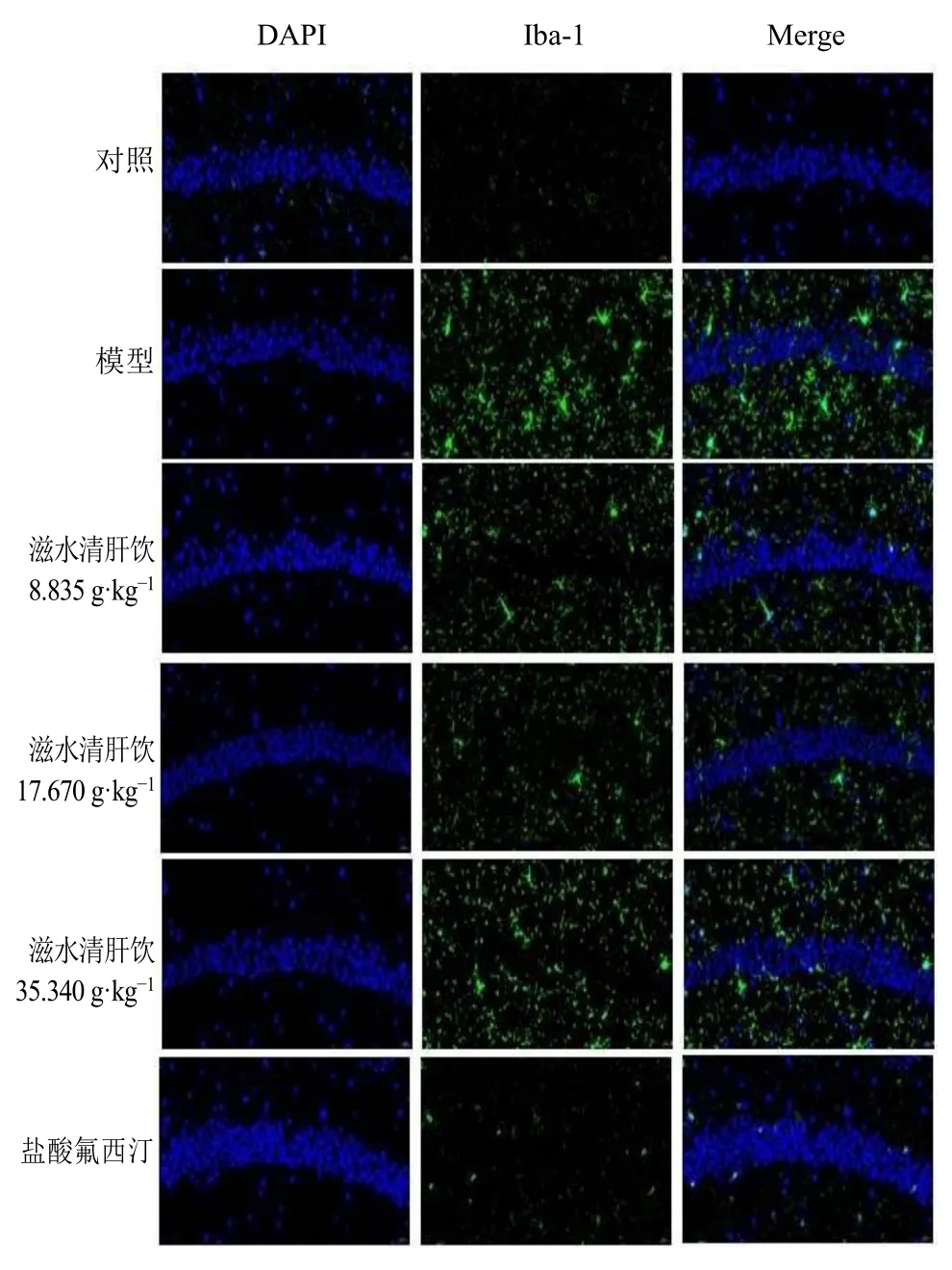
图2 滋水清肝饮对抑郁小鼠海马CA1 区Iba-1 表达的影响 (×400)Fig.2 Effect of Zishui Qinggan Yin on Iba-1 expression in hippocampal CA1 region of depressed mice (× 400)
3.3 滋水清肝饮对抑郁小鼠血清中SOD 活性和5-HT、CORT、ACTH、CRH、MDA 水平的影响
如表3 所示,与对照组比较,模型组小鼠血清中5-HT 水平和SOD 活性显著降低(P<0.01),CORT、ACTH、CRH、MDA 水平显著升高(P<0.01);与模型组比较,各给药组ACTH 和MDA 水平显著降低(P<0.01),SOD 活性显著升高(P<0.05、0.01);盐酸氟西汀组和滋水清肝饮中剂量组5-HT 水平显著升高(P<0.05、0.01),CORT 和CRH水平显著降低(P<0.05、0.01)。
表3 滋水清肝饮对抑郁小鼠血清中SOD 活性和5-HT、CORT、ACTH、CRH、MDA 水平的影响 (±s, n = 9)Table 3 Effect of Zishui Qinggan Yin on SOD activity and 5-HT, CORT, ACTH, CRT, SOD, MDA levels in serum of depressed mice (±s , n = 9)

表3 滋水清肝饮对抑郁小鼠血清中SOD 活性和5-HT、CORT、ACTH、CRH、MDA 水平的影响 (±s, n = 9)Table 3 Effect of Zishui Qinggan Yin on SOD activity and 5-HT, CORT, ACTH, CRT, SOD, MDA levels in serum of depressed mice (±s , n = 9)
组别 剂量/(g·kg−1)5-HT/(ng·mL−1)CORT/(ng·mL−1)ACTH/(pg·mL−1)CRH/(pg·mL−1)SOD/(U·mL−1)MDA/(nmol·mL−1)对照 — 193.49±6.42 192.96±2.58 61.50±3.89 78.25±0.77 120.09±3.39 5.27±0.44模型 — 176.26±2.52## 221.16±13.87## 76.86±2.54## 97.24±3.42## 79.14±10.64## 8.26±1.51##盐酸氟西汀 0.01 191.73±6.84** 192.23±5.15* 63.86±2.62** 80.73±3.66** 122.15±9.88** 5.48±0.48**滋水清肝饮 8.835 177.15±5.58 196.28±3.56 68.30±2.39** 88.57±10.15 100.22±9.50** 6.83±0.60**17.670 186.12±3.13* 192.18±2.14* 63.93±2.17** 80.84±5.36** 111.33±5.64** 5.86±0.47**35.340 180.42±10.76 204.62±4.07 66.17±0.71** 87.90±6.68 90.34±15.19* 6.96±0.55**
3.4 滋水清肝饮对抑郁小鼠前额叶皮层SOD 活性和5-HT、BDNF、MDA 水平的影响
如表4 所示,与对照组比较,模型组小鼠前额叶皮层中5-HT、BDNF 水平和SOD 活性均显著降低(P<0.01),MDA 水平显著升高(P<0.01);与模型组比较,各给药组小鼠前额叶皮层中5-HT、BDNF 水平和SOD 活性均显著升高(P<0.05、0.01),盐酸氟西汀组和滋水清肝饮中、高剂量组MDA 水平显著升高(P<0.01)。
表4 滋水清肝饮对抑郁小鼠前额叶皮层SOD 活性和5-HT、BDNF、MDA 水平的影响 (±s , n = 6)Table 4 Effect of Zishui Qinggan Yin on SOD activity and 5-HT, BDNF, MDA levels in prefrontal cortex of depressed mice(±s , n = 6)

表4 滋水清肝饮对抑郁小鼠前额叶皮层SOD 活性和5-HT、BDNF、MDA 水平的影响 (±s , n = 6)Table 4 Effect of Zishui Qinggan Yin on SOD activity and 5-HT, BDNF, MDA levels in prefrontal cortex of depressed mice(±s , n = 6)
组别 剂量/(g·kg−1) 5-HT/(ng·mL−1) BDNF/(pg·mL−1) SOD/(U·mgprot−1) MDA/(nmol·mgprot−1)对照 — 304.84±12.91 824.38±32.34 222.24±19.19 8.42±1.93模型 — 245.99±11.10## 741.61±7.56## 183.40±11.82## 15.43±3.85##盐酸氟西汀 0.01 289.42±7.72** 815.46±25.91** 260.84±27.01** 7.72±3.28**滋水清肝饮 8.835 262.66±9.93* 796.21±21.32* 213.22±26.83** 11.71±1.90 17.670 286.13±9.14** 814.60±19.12** 235.83±13.97** 7.30±1.51**35.340 277.87±6.52** 804.83±22.72** 233.69±14.85* 9.91±2.66**
3.5 滋水清肝饮对抑郁小鼠肠道菌群的影响
3.5.1 菌群测序结果质量分析 各组小鼠结肠内容物样品的稀释曲线见图3-A,送测数量合理,测序深度足以满足后续研究。物种累积曲线见图3-B,在样本量渐增的同时,所对应的物种数目也在增加,且曲线渐趋平坦,说明小鼠测序样品的数量合理。

图3 小鼠肠道菌群测序结果质量分析Fig.3 Quality analysis of sequencing results of intestinal flora in mice
3.5.2 各组分类操作单元(operational taxonomic unit,OTU)组成相似性 如图4 所示,与对照组比较,模型组独有的物种数量降低;与模型组比较,滋水清肝饮中剂量组及盐酸氟西汀组独有的物种数量均升高,滋水清肝饮高、低剂量组均降低。
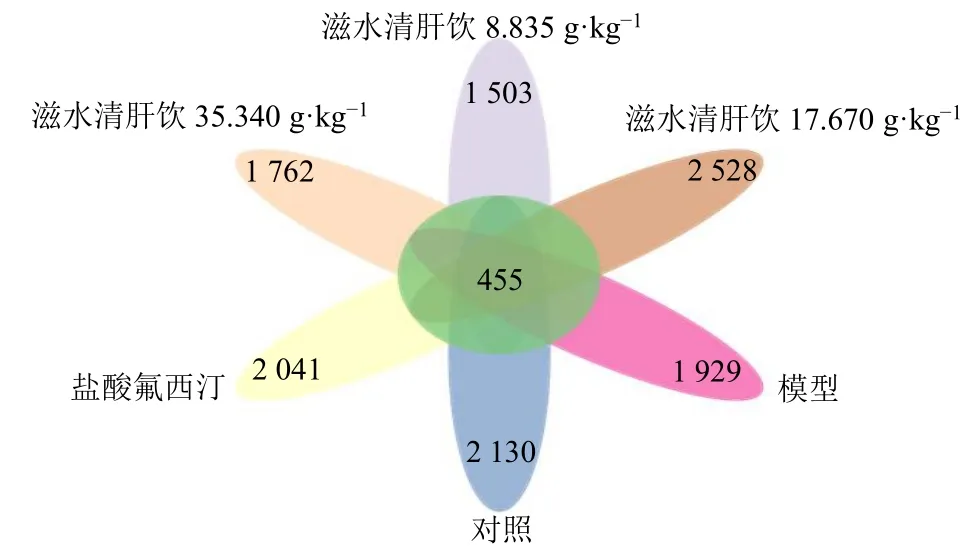
图4 各组样本ASV/OTU 的花瓣图Fig.4 Petals of ASV/OTU in each group
3.5.3 α 多样性分析 如表5 所示,与对照组比较,模型组Chao1 指数及Observed species 指数均显著降低(P<0.05),Simpson 指数及Shannon 指数无显著差异;与模型组比较,滋水清肝饮中剂量组和盐酸氟西汀组Chao1 指数及Observed species 指数均显著升高(P<0.05),Shannon 指数有升高趋势但无显著差异。
表5 滋水清肝饮对抑郁小鼠肠道菌群多样性指数的影响 (±s, n = 3)Table 5 Effect of Zishui Qinggan Yin on intestinal flora diversity index of depressed mice (±s , n = 3)

表5 滋水清肝饮对抑郁小鼠肠道菌群多样性指数的影响 (±s, n = 3)Table 5 Effect of Zishui Qinggan Yin on intestinal flora diversity index of depressed mice (±s , n = 3)
组别 剂量/(g·kg−1) Chao1 指数 Simpson 指数 Shannon 指数 Observed species 指数对照 — 2 054.24±123.07 0.95±0.01 6.38±0.31 1 868.20±157.49模型 — 1 830.36±28.77# 0.96±0.01 6.04±0.96 1 661.90±7.18#盐酸氟西汀 0.01 1 966.69±96.32* 0.95±0.01 6.31±0.51 1 802.80±37.91*滋水清肝饮 8.835 1 853.90±124.23 0.95±0.03 6.16±0.06 1 614.13±157.85 17.670 2 149.69±51.95* 0.95±0.02 6.71±0.14 1 968.70±193.96*35.340 1 944.33±179.49* 0.95±0.01 6.42±0.52 1 752.07±118.27
3.5.4 β 多样性分析 如图5 所示,主坐标分析(principal co-ordinates analysis,PCoA)表明对照组及各给药组大部分样本有交叉,模型组则单独于在1 个位置,说明抑郁小鼠的肠道群落结构发生了改变,经滋水清肝饮治疗后肠道群落结构得到改善。

图5 β 多样性分析Fig.5 β Diversity analysis
3.5.5 小鼠肠道菌群门及属水平中前20 的生物物种组成 对对照组、模型组及各给药组小鼠肠道菌群在门水平上物种组成进行分析(图6-A),结果表明各组小鼠肠道菌群中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteria)、变形杆菌门(Proteobacteria)为优势菌群,总比例大于85%。与对照组比较,模型组小鼠肠道内的有益菌拟杆菌门及放线菌门等相对丰度下降,有害菌变形杆菌门相对丰度增加;与模型组比较,各给药组有害菌厚壁菌门及变形杆菌门相对丰度均降低,除滋水清肝饮低剂量组外,其余各给药组拟杆菌门及放线菌门等相对丰度均有所增加。

图6 小鼠肠道菌群门及属水平中前20 的生物物种组成Fig.6 Composition of top 20 biological species at level of phyla and genus in intestinal flora of depressed mice
对对照组、模型组及各给药组小鼠肠道菌群在属水平上物种组成进行分析(图6-B),属水平上优势菌属为杜氏杆菌属Dubosiella、乳杆菌属Lactobacillus、Muribaculaceae、幽门螺杆菌属Helicobacter、毛螺菌属Lachnospiraceae等。与对照组比较,模型组幽门螺杆菌属丰度升高,除杜氏杆菌属降低且有显著差异外,Muribaculaceae、乳酸杆菌属丰度降低有差异但不显著;与模型组比较,各给药组幽门螺杆菌属丰度均降低,杜氏杆菌属、毛螺菌属、乳杆菌属及Muribaculaceae丰度升高,以滋水清肝饮中剂量组及盐酸氟西汀组最为显著。
3.6 Western blotting 检测小鼠皮层组织ERK1/2、p-ERK1/2、CREB、p-CREB、BDNF 蛋白表达
如图7 和表6 所示,与对照组比较,模型组小鼠前额叶皮层中p-ERK1/2、p-CREB、BDNF 蛋白表达水平均显著降低(P<0.01);与模型组比较,各给药组前额叶皮层组织中p-ERK1/2、p-CREB、BDNF 蛋白表达水平均显著升高(P<0.05、0.01)。

图7 各组小鼠前额叶皮层中ERK1/2、p-ERK1/2、CREB、p-CREB、BDNF 蛋白表达Fig.7 ERK1/2, p-ERK1/2, CREB, p-CREB and BDNF protein expressions in prefrontal cortex of mice in each group
表6 滋水清肝饮对抑郁小鼠前额叶皮层组织ERK1/2、p-ERK1/2、CREB、p-CREB、BDNF 蛋白表达的影响(±s , n = 3)Table 6 Effect of Zishui Qinggan Yin on ERK1/2, p-ERK1/2, CREB, p-CREB and BDNF protein expressions in prefrontal cortex tissue of depressed mice (±s , n = 3)

表6 滋水清肝饮对抑郁小鼠前额叶皮层组织ERK1/2、p-ERK1/2、CREB、p-CREB、BDNF 蛋白表达的影响(±s , n = 3)Table 6 Effect of Zishui Qinggan Yin on ERK1/2, p-ERK1/2, CREB, p-CREB and BDNF protein expressions in prefrontal cortex tissue of depressed mice (±s , n = 3)
组别 剂量/(g·kg−1) p-ERK1/2/ERK1/2 p-CREB/CREB BDNF/GAPDH对照 — 0.93±0.04 0.77±0.05 0.90±0.03模型 — 0.11±0.01## 0.36±0.08## 0.31±0.04##盐酸氟西汀 0.01 0.93±0.02** 0.85±0.02** 0.54±0.06*滋水清肝饮 8.835 0.62±0.06** 0.61±0.03** 0.61±0.03**17.670 0.94±0.01** 0.70±0.07** 0.83±0.05**35.340 0.71±0.07** 0.56±0.04* 0.44±0.05**
4 讨论
压力是抑郁症发展的致病因素之一[16],长期或慢性应激可导致HPA 轴功能失调,导致体内CRH、ACTH、CORT 水平升高[17];大脑氧化应激加重,导致海马CA1 区小胶质细胞过度激活释放大量促炎细胞因子[18];激活色氨酸-犬尿氨酸途径减少5-HT的生成;肠道屏障通透性增加,最终导致肠道生态失调[19]。本研究通过CRS 模型,根据蔗糖摄入量减少、运动活动缺陷、绝望性行为来模拟临床抑郁症的发展和进展,探究抑郁症的病理学生理学特征,围绕肠道菌群进行一系列探究分析,探索阐述滋水清肝饮的抗抑郁作用与机制。
实验结果表明,在α 多样性分析结果中各组之间的物种丰富度和粪便菌群多样性有显著差异,其中模型组的Chao1、Observed species、Shannon 指数均有降低趋势。在β 多样性分析中,模型与其他群体之间存在明显差异,表现出CRS 后微生物群落结构的明显变化;给予滋水清肝饮治疗后,肠道菌落结构得到一定改善,并与对照组有一定交集。在小鼠肠道菌群门和属水平中,模型组有害菌厚壁菌门、变形杆菌门、幽门螺杆菌属等增加,益生菌拟杆菌门、放线菌门、杜氏杆菌属、毛螺菌属、乳杆菌属、Muribaculaceae等降低,在MDD 患者肠道菌群[11]中也观察到了与之相似的结果。经滋水清肝饮及盐酸氟西汀治疗后,各给药组益生菌丰度增加,有害菌丰度降低,其中以滋水清肝饮中剂量及盐酸氟西汀最为显著。在以上提及的有益菌门中,杜氏杆菌属具有调节体内代谢、减轻炎症和提高肠道免疫力等功效的一类肠道菌属。Muribaculaceae及毛螺菌属可产生短链脂肪酸,促进肠道上皮的完整性[20-22]。乳酸杆菌可通过迷走神经调节神经递质5-HT 及多巴胺受体的表达来改善抑郁行为[23],进而改善小鼠抑郁样作用。由此表明,滋水清肝饮可以通过调控抑郁小鼠肠道内菌群的组成进而改善小鼠抑郁症状。
与对照组比较,模型组小鼠海马、皮层及结肠的病理损伤严重,氧化应激加重,5-HT 含量降低,小鼠抑郁样行为加剧,前额叶皮层中5-HT 及BDNF含量降低。经过滋水清肝饮干预后,小鼠全脑组织HE 染色、全脑免疫荧光染色及结肠HE 染色结果均表明其损伤程度远低于模型组。与模型组比较,各给药组小鼠快感缺失情况减轻,悬尾实验和强迫游泳实验不动时间缩短;血清中5-HT 含量增加,SOD活力提高,CORT、ACTH、CRH 及MDA 含量降低;前额叶皮层中5-HT 及BDNF 含量增加,SOD活力提高,MDA 含量降低;海马、皮层及结肠的病理状态得到改善,海马小胶质细胞标志物Iba-1 表达降低。表明滋水清肝饮可以提高小鼠体内神经递质5-HT 及营养因子BDNF 水平,减轻氧化应激,减轻炎症,调节HPA 轴,从而发挥抗抑郁作用,也表明滋水清肝饮给药不具有剂量相关性,中剂量组即临床等效剂量组效果最好。
前额叶皮层是边缘皮层的一部分,由于其丰富的神经相互连接,涉及许多应激敏感的心理障碍。BDNF 是一种可塑性相关蛋白质,源于大脑皮层的轴突末梢,在啮齿动物和人类的大脑皮层中都高度表达,并在神经元去极化时在轴突中释放[24]。前额叶皮层中释放出的BDNF 会结合受体酪氨酸激酶刺激ERK,而ERK 作为细胞信号的递质,参与细胞的迁移、分化、生长和存活。当ERK 激活下游CREB后,导致丝氨酸133(Ser133)的磷酸化,磷酸化的CREB 具有神经保护作用,可调节包括多巴胺能神经元在内的多个细胞基因转录的功能[25]。p-CREB又作为BDNF 的上游调控BDNF 的转录,从而达到抗抑郁的效果。也有研究表明,BDNF 可以加速肠道排空并增加排便频率[26],增强肠平滑肌的肌电活性及增大收缩幅度的峰值,增强孤立大鼠结肠的蠕动反射[27]。实验结果表明,与对照组比较,模型组小鼠海马BDNF、p-CREB、p-ERK1/2 蛋白表达均降低;与模型组比较,当给予不同剂量的滋水清肝饮后小鼠海马BDNF、p-CREB、p-ERK1/2 蛋白表达均有不同程度的增加,其中中剂量组即临床等效剂量组蛋白增加最为显著,效果最好。
由于滋水清肝饮具有多成分、多靶点的作用,实验中对于抗炎、抗氧化等作用仅体现在血液及皮层中的改变,对其调控作用机制及其他损伤部位仍需深入研究。同时滋水清肝饮在重塑肠道菌群和调控小鼠皮层ERK/CREB/BDNF 信号通路中发挥抗抑郁作用,可作为抑郁症治疗的潜在新策略值得进一步的研究探讨。
利益冲突所有作者均声明不存在利益冲突
