川芎嗪对小鼠生长性能、血液生理、生化指标及抗氧化功能的影响
2024-01-24赵思绮郭子铭吴柯怡唐利军
■ 胡 雪 赵思绮 郭子铭 吴柯怡 王 雨 唐利军 舒 刚*
(1.四川农业大学动物医学院,四川成都 611130;2.大英县农业农村局,四川遂宁 629300)
川芎(Ligusticum chuanxiong Hort.),为多年生草本、伞形科、藁本属植物川芎的干燥根茎[1]。川芎作为中国的传统中药材及四川道地药材,其性温,归属肝经、胆经、心包经,具有活血祛瘀、祛风止痛的作用,药用价值极高,是近年来在医学领域应用十分广泛的绿色经济药材[2-4]。川芎嗪(tetramethyl pyrazine,TMP)是中药川芎的主要有效成分,具有广泛的临床作用。已有研究表明[5],川芎嗪有明显的抗氧化作用,能抑制黄嘌呤酶的生成,增加血清总超氧化物歧化酶(TSOD)的活性和谷胱甘肽过氧化氢酶(GSH-Px)的含量,从而减轻自由基损伤。但目前关于川芎嗪对小鼠生长性能、抗氧化功能等的研究较少。本次试验以昆明(KM)小鼠为研究对象,探究不同浓度川芎嗪对小鼠生长性能、血液生理指标及抗氧化功能的影响,为川芎嗪的开发应用提供理论依据。
1 材料与方法
1.1 试验动物与试剂
72只元特定疫病(SPF)级雄性KM小鼠(4周龄),体质量(20±2) g,动物许可证号为SCXK(chuang)2020-030,由成都达硕实验动物中心提供。
川芎嗪(德思特生物技术有限公司,纯度>98%)、4%多聚甲醛固定液(Beyotime 公司)、生理盐水、羧甲基纤维素钠;天冬氨酸氨基酸转移酶(AST)试剂盒、谷氨酸-丙酮酸转氨酶(ALT)试剂盒、还原型谷胱甘肽(GSH)试剂盒、丙二醛(MDA)试剂盒、T-SOD 试剂盒、总抗氧化能力(T-AOC)试剂盒,均购自南京建成生物工程研究所有限公司。
1.2 仪器与设备
酶标仪(美国Thermo 公司)、数显恒温水浴锅(常州澳华仪器有限公司)、高速冷冻离心机(美国Thermo公司)、动物血细胞分析仪(北京益仁恒业有限公司)、RM2245 型转轮式切片机(美国Thermo 公司)、病理切片扫描仪(上海徕卡生物系统公司)。
1.3 试验方法
1.3.1 试验分组及给药
将72 只SPF 雄性KM 小鼠适应性喂养7 d,随机分为空白(K)组和试验1、2、3、4、5组。试验1、2、3、4、5 组分别灌胃50、100、150、200、250 mg/kg 川芎嗪,空白组灌胃0.2 mL/10 g 的0.8%羧甲基纤维素钠溶液,1 次/d,处理14 d。小鼠饲喂于四川农业大学动物医学院动物房,室温(22±1) ℃,相对湿度50%~60%,12 h/12 h明暗节律,自由进食、饮水。
1.3.2 样品采集
小鼠在最后一次灌服川芎嗪溶液24 h后,眼静脉丛采血,采取0.5 mL肝素钠抗凝处理,其余的静置1 h后置于高速冷冻离心机中离心,条件为4 ℃,3 500 r/min,10 min,离心后吸取上清液为血清,-20 ℃保存。随后颈椎脱臼法处死小鼠,摘取肝脏、心脏、肺脏、脾脏、肾脏。取部分肝脏组织称重,加0.9%的氯化钠溶液分别制成10%的肝脏匀浆和20%的肝脏匀浆,以备后续试验。
1.4 指标测定
1.4.1 生长性能测定
以组为单位,进行7 d 的适应性喂养,空腹12 h后,用电子秤在灌胃试验的第1 天称重,作为试验初体重;于正式试验第14 天,对小鼠进行空腹12 h后称重,作为试验末体重。另外,观察各组小鼠试验期间的精神状况、毛发光泽度、活动状态、食欲及排泌情况,记录死亡小鼠情况,计算死亡率。
1.4.2 脏器指数测定
试验结束后,采用颈椎脱臼法对小鼠进行处死,完整取下其心脏、肝脏、脾脏、肺脏和肾脏,生理盐水冲洗,分别称重并记录,采用下列公式计算脏器指数。
脏器指数(%)=[脏器质量(g)/体重(g)]×100
1.4.3 血液生理指标测定
采用眼球采血法取血,并将0.5 mL血液置于抗凝EP 管中,放置冰盒内保存,上下轻柔转动,使其充分抗凝,混匀后采用动物血细胞分析仪检测样本,测定小鼠淋巴细胞、白细胞、单核细胞、中性粒细胞、红细胞数量,淋巴细胞、单核细胞、中性粒细胞百分比及血红蛋白浓度等指标。
1.4.4 血清酶测定
取处理好的血清测定其ALT和AST含量,并按照各组小鼠编号进行数据记录。具体操作步骤严格按照试剂盒说明书。
1.4.5 血清抗氧化指标水平测定
将处理好的血清采用相关试剂盒测定其GSH、MDA、T-SOD、T-AOC 含量,并按照各组小鼠编号进行数据记录。具体操作步骤严格按照试剂盒说明书。
1.4.6 肝组织抗氧化指标水平测定
取处理好的肝脏匀浆2 mL,3 000 r/min 离心10~15 min 后取上清液,采用相关试剂盒测定其GSH、MDA、T-SOD、T-AOC 含量,并按照各组小鼠编号进行数据记录。具体操作步骤严格按照试剂盒说明书。
1.5 数据统计分析
数据用Excel 初步整理,用SPSS 27.0 统计学软件进行单因素方差分析和回归统计分析,用Duncan’s法进行多重比较,所有试验数据以“平均值±标准差”的形式表示,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 不同剂量的川芎嗪对小鼠体重的影响
由表1 可知,各试验组小鼠体重较空白组均无显著差异(P>0.05),表明川芎嗪对小鼠的生长无显著影响,且不符合线性回归模型(P>0.05)。

表1 川芎嗪对小鼠体重的影响(g)
2.2 不同剂量的川芎嗪对小鼠脏器指数的影响
由表2 可知,各试验组小鼠脏器指数变化较空白组均无显著差异(P>0.05), 不符合线性回归模型(P>0.05)。
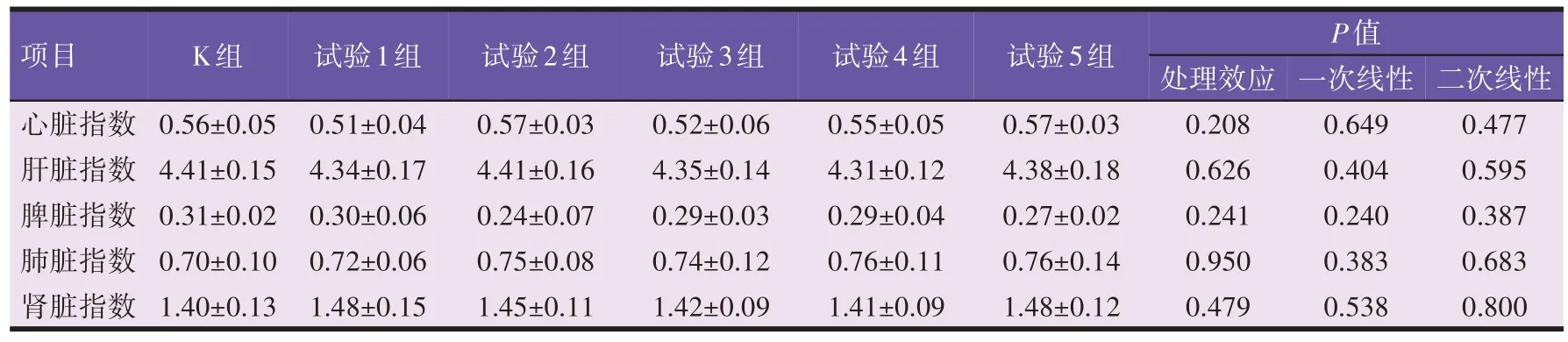
表2 川芎嗪对小鼠脏器指数的影响(%)
2.3 不同剂量的川芎嗪对小鼠血液生理指标的影响
由表3 可知,经川芎嗪处理后,与空白组相比,试验1、2、3、4 组的白细胞总数和淋巴细胞数目均显著降低(P<0.05),白细胞数目分别降低19.05%、9.52%、28.57%、19.05%,淋巴细胞数目分别降低22.45%、8.16%、28.57%、26.53%;而试验1、2、4 组的淋巴细胞百分比分别降低3.09%、2.45%、7.73%(P<0.05);试验1、2、4、5 组的血小板数目分别升高19.33%、7.81%、25.54%、12.21%。试验组的中性粒细胞百分比与空白组相比均无显著性差异(P>0.05)。
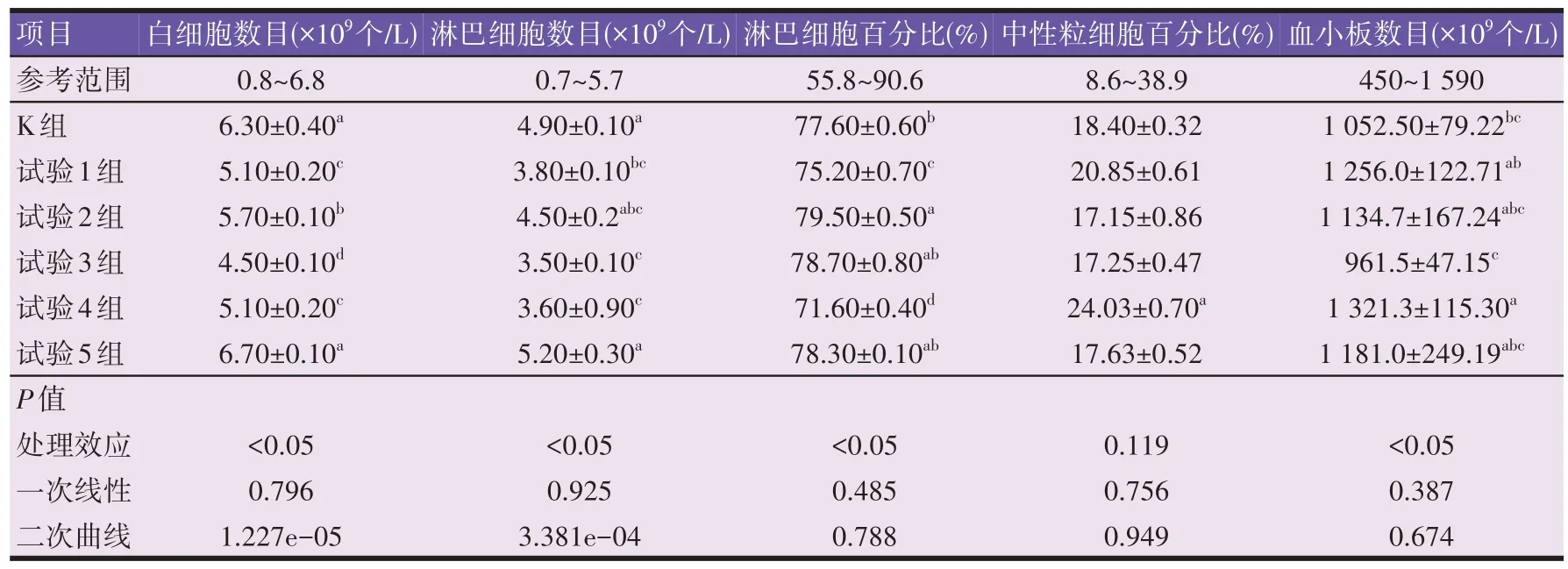
表3 川芎嗪对小鼠血液生理指标的影响
白细胞数目随川芎嗪给药剂量呈二次曲线降低的剂量依赖关系(P=1.227e-05,R2=0.63),以试验5 组含量最高,150 mg/kg 组含量最低;且淋巴细胞数目随川芎嗪给药剂量呈二次曲线降低的剂量依赖关系(P=3.381e-04,R2=0.49),以250 mg/kg 组含量最高,150 mg/kg 组含量最低。其余血常规指标均不符合线性回归模型(P>0.05)。
2.4 不同剂量的川芎嗪对小鼠血清生化指标的影响
由表4 可知,各组之间AST 含量没有显著差异(P>0.05),不符合线性回归模型。川芎嗪水平对小鼠血清ALT 含量存在显著影响(P<0.05),且符合多项式回归模型(P=0.002,R2=0.40)。随川芎嗪水平的提高,血清ALT 活性(P=0.002,R2=0.41)呈显著的二次线性升高的剂量依赖关系,除试验1组外,其他试验组ALT含量均低于空白组。
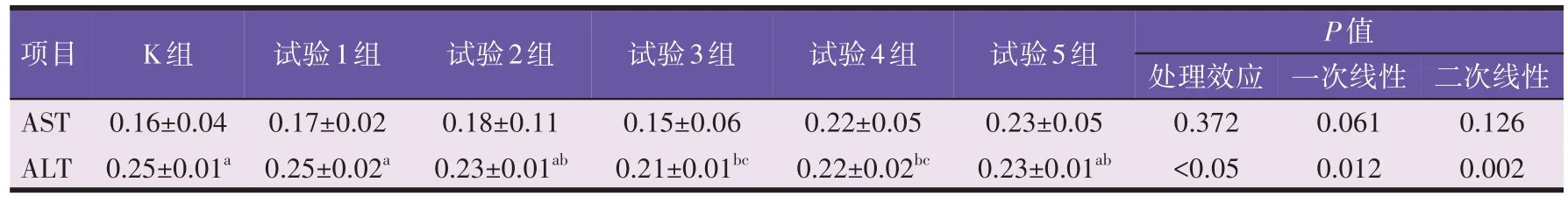
表4 川芎嗪对小鼠血清生化指标的影响(U/L)
回归关系表明,随川芎嗪剂量的提高,血清ALT含量(P=0.002,R2=0.40)呈显著的二次线性升高的剂量依赖关系,以试验3 组含量较低,以空白组和试验1 组含量较高。与空白组相比,试验3、4 组ALT 水平显著降低(P<0.05),试验3 组ALT 水平降低最显著,可见150 mg/kg 川芎嗪降低小鼠血清ALT 的效果最好。
2.5 不同剂量的川芎嗪对小鼠血清抗氧化能力的影响
由表5 可知,与空白组比较,川芎嗪可显著提升试验组小鼠血清的GSH、SOD含量,显著降低除试验1组外MDA 水平,且这种显著变化与川芎嗪的剂量存在显著联系(P<0.05)。相比空白组,试验组小鼠血清GSH含量、SOD含量和T-AOC含量随川芎嗪剂量的升高呈显著的二次线性升高趋势(P=9.34e-08,R2=0.77;P=2.2e-05,R2=0.61;P=0.003,R2=0.37)。当川芎嗪剂量为150 mg/mg时,小鼠血清SOD水平到达最高值,显著高于其他组(P<0.05)。当川芎嗪剂量为150 mg/mg与200 mg/kg 时,小鼠血清GSH 水平显著高于其他组(P<0.05)。当川芎嗪剂量为150、200、250 mg/kg 时,小鼠血清T-AOC 水平显著高于其他组(P<0.05)。而血清MDA 含量随川芎嗪剂量的升高呈显著二次曲线升高的剂量依赖关系(P=1.666e-06,R2=0.69),以150 mg/mg组含量最低,250 mg/kg组含量较高。
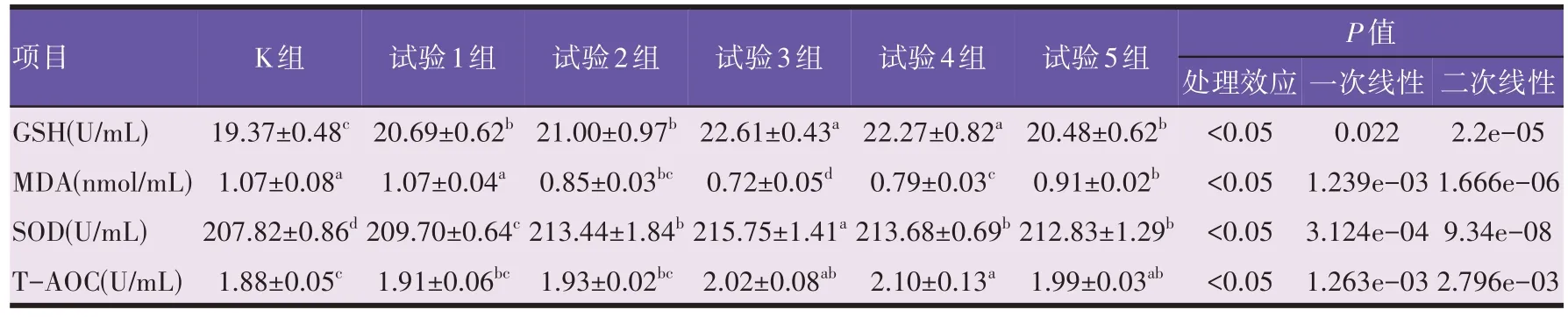
表5 川芎嗪对小鼠血清抗氧化指标的影响
由表6 可知,试验3 组GSH、SOD、T-AOC 含量上升,MDA 含量下降幅度最显著,提示150 mg/kg 剂量川芎嗪比其他浓度抗氧化能力更强。
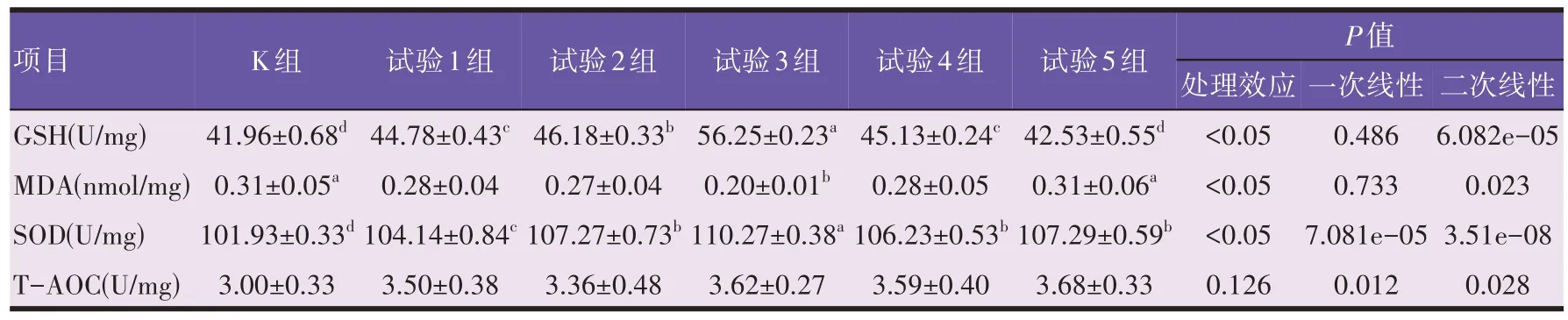
表6 川芎嗪对小鼠肝脏抗氧化指标的影响
2.6 不同剂量的川芎嗪对小鼠肝组织抗氧化能力的影响
由表6可知,与空白组相比,试验1、2、3、4组小鼠肝脏MDA 活性均降低,且试验4 组显著低于空白组(P<0.05);各试验组小鼠的肝脏GSH 活性均高于空白组,且试验1、2、3、4组均显著高于空白组(P<0.05),分别提高了6.72%、10.06%、30.06%、7.56%;各试验组SOD均显著高于空白组(P<0.05),分别提高了2.17%、5.24%、8.18%、4.22%、5.26%;各试验组小鼠肝脏TAOC 含量均高于空白组,但差异不显著(P>0.05)。结果表明,川芎嗪能够显著提高小鼠肝脏组织的GSH、SOD 的含量,显著降低小鼠肝脏的MDA 含量,且在150 mg/kg剂量下效果最好。
回归关系表明,随川芎嗪剂量的提高,肝脏GSH(P=6.082e-05,R2=0.52)、SOD(P=3.51e-08,R2=0.76)均呈显著的二次线性降低的剂量依赖关系,均以试验3 组含量较高,GSH 以试验5 组含量较低,SOD 以试验1 组和试验4 组较低;肝脏MDA(P=0.023,R2=0.24)、T-AOC(P=0.028,R2=0.24)均呈显著的二次曲线升高的剂量依赖关系,MDA 以试验3 组含量较高,T-AOC以试验2 组含量较低,二者均以试验5 组含量较高。随川芎嗪剂量的升高,肝脏SOD呈显著的一次线性增加的剂量关系(P=7.081e-05,R2=0.47),以试验3 组含量最高;肝脏T-AOC 呈显著的一次线性增加的剂量关系(P=0.012,R2=0.20),试验2、4、5 组含量高于试验1、2组。
3 讨论
3.1 不同剂量的川芎嗪对小鼠生长性能的影响
目前,关于川芎嗪对动物生长性能的影响研究相对较少。王燕等[6]通过被动吸烟的方式建立大鼠胎儿的生长受限(FGR)模型,研究川芎嗪对生长受限胎鼠的生长发育的影响,发现不同剂量的川芎嗪可使FGR胎鼠的生长发育情况得到明显改善,证明川芎嗪可以有效防治胎鼠FGR。本试验中通过对小鼠灌胃不同剂量的川芎嗪后发现,试验期间小鼠精神状态、营养状况良好,表明川芎嗪对小鼠生长性能没有不良影响,这可能是由于物种和不同生长阶段的差异造成的[7]。
3.2 不同剂量的川芎嗪对小鼠脏器指数的影响
脏器指数指的是器官的重量占体重的百分比,可以在一定程度上反映器官的发育和健康情况[8]。一般来说,脏器重量与机体重量成正比,但在多种因素(如品种、性别等自身因素和季节和饲养条件等环境因素)的影响下,也有存在成反比的可能性[9]。本试验结果显示川芎嗪对小鼠的脏器指数没有显著影响,说明川芎嗪不影响小鼠脏器的发育,且无不良反应。但目前关于川芎嗪在服用后对生长期动物脏器指数影响的研究报道不多,其对脏器发育的影响还需进一步研究。
3.3 不同剂量的川芎嗪对小鼠血液生理指标的影响
研究表明,作为一种新型钙离子颉颃剂及自由基清除剂,川芎嗪可通过血脑屏障阻止钙离子的胞内转移,进而保护红细胞及血管内皮组织;提高T-SOD活性及清除自由基、抑制环磷酸酯酶的活性而增加环磷酸腺苷含量,抑制动脉痉挛,阻断5-羟色胺生成[10],扩张血管、抗血小板凝集,降低血脂及血黏度,抗血栓形成及溶解血栓、抗菌和钙离子颉颃[5],活血化瘀作用明显。这一结论在本试验中有所体现,试验1、2、4、5组的小鼠血小板数目较空白组有所升高。各组小鼠的血液生理指标均处于正常范围内,证明川芎嗪对小鼠血液生理指标无不良影响,且可提高血小板数目,提升抗凝血能力。
3.4 不同剂量的川芎嗪对小鼠血清酶和抗氧化指标的影响
ALT、AST含量是肝细胞损伤情况的重要指标,通过测定血清或血浆中ALT、AST 的含量变化能够反映肝脏受到损害的情况[11]。试验结果显示,试验组小鼠肝脏未受到损伤,血清中AST 含量较空白组无明显变化,试验3、4 组能显著降低血清中ALT 含量。此结果表明川芎嗪能显著降低血清中ALT含量,从而说明川芎嗪对肝脏细胞膜无损伤[12]。
MDA 可间接反映机体细胞受自由基攻击的程度,显示细胞损伤的程度。GSH 是广泛存在于动物体的各种组织中含量较高的一种含巯基三肽,是体内重要的抗氧化剂和自由基清除剂[13]。GSH 水平降低意味着机体抗氧化能力下降并引发机体的氧化应激反应, 因此自由基生成大量增加[14]。SOD 是机体脂质过氧化防御系统中的一个重要酶,是生物体内清除自由基的首要物质,可清除体内超氧自由基并有效减轻细胞生物膜上的脂质过氧化[15]。T-AOC是待测样品中所有抗氧化剂的抗氧化能力总和,可一定程度上反映机体清除活性氧/一氧化氮合酶(ROS/NOS)的总能力。T-AOC水平越高,其抗氧化能力越强。机体抗防御体系中T-SOD、GSH 和T-AOC 对氧化与抗氧化平衡起着重要作用,可以有效阻断自由基引起的连锁反应,从而起到抗氧化、抗衰老作用[16-17]。而MDA增多可引起脏细胞形态脂质过氧化反应,机体MDA 含量变化可间接反映机体细胞受自由基攻击的严重程度[18]。
相关文献报道,应用反式脂肪酸(TFA)致肝脏损伤的大鼠构建模型,其中TFA 通过诱导机体产生活性氧和自由基造成氧化损伤,而经川芎嗪作用后肝脏SOD活性有明显升高,MDA含量有下降的趋势[19]。肖成云等[20]也得出类似结果,川芎嗪可降低机体产生氧自由基酶系的活力,使MDA 的含量降低,同时提高肝组织GSH 活性。本试验结果表明:与空白组相比,不同剂量的川芎嗪可以显著降低肝组织中MDA 的含量,显著升高肝组织中GSH、SOD 含量,能够提高肝组织总抗氧化能力(T-AOC),但不具有显著性,与前人研究结果基本一致。此外,与空白组相比,150 mg/kg川芎嗪降低MDA、升高GSH、SOD 的效果最显著。吾斯曼·艾海提等[21]研究发现,川芎嗪可作为抗氧化剂显著降低D-氨基半乳糖诱导的急性肝损伤小鼠肝组织中MDA 含量,显著升高肝组织中SOD、GSH 含量,其机制可能与AMPK/SIRT1 信号通路和自噬有关。本研究显示川芎嗪可以显著提升小鼠血清GSH、SOD 含量,显著降低血清MDA 含量,川芎嗪剂量在0~150 mg/kg 范围时对小鼠的抗氧化功能有不同程度的提升效果,且150 mg/kg 时抗氧化效果最佳,当剂量超过150 mg/kg 后川芎嗪对小鼠抗氧化功能产生负影响,抗氧化功能减弱,这表明川芎嗪在一定剂量范围内可有效减轻自由基损伤,提升小鼠抗氧化水平,但高水平的川芎嗪会对小鼠的抗氧化功能产生负影响。
4 结论
川芎嗪对小鼠的生长性能无不良影响,能够有效提高小鼠抗凝血能力和肝脏抗氧化能力,其血清TSOD、GSH 含量显著提升,MDA 含量有所降低,肝组织中T-SOD、GSH含量显著升高,MDA含量有所降低。总体而言,当川芎嗪剂量范围为0~150 mg/kg时,小鼠抗氧化能力随川芎嗪剂量升高而增强,当剂量超过150 mg/kg后产生负影响,即抗氧化能力随之减弱。故而,当川芎嗪剂量为150 mg/kg时,小鼠抗氧化能力最强。
