CaO-CaCl2 混凝沉淀结合电化学氧化法去除钨冶炼高盐废水中的氟和氨氮
2024-01-23徐建兵张志峰李忠岐陈后兴
曾 鹏,洪 侃,徐建兵,张志峰,李忠岐,王 明,陈后兴
(赣州有色冶金研究所有限公司,江西 赣州 341000)
0 引 言
目前,在钨冶炼行业中较为成熟的APT 生产工艺为“碱分解-离子交换”生产工艺,该工艺在高温压煮钨精矿的过程中加入过量片碱进行反应,制得粗钨酸钠溶液,再对粗钨酸钠溶液进行除杂,得到相对较纯的钨酸钠溶液,在最佳pH 和浓度工艺条件下,用离子交换法对钨酸钠溶液中的钨酸进行吸附,吸附完钨酸之后产生的大量强碱性溶液就变为交后液废水排出,排出的废水再经过低钨交换之后变为酸性废水排出。经过离子交换后的废水通常为高盐溶液混杂氟和氨氮等污染物的状态,若直接排放,会对人体健康及环境造成极大的影响[1-3]。
目前,国内外对工业含氟废水的处理方法主要为化学混凝沉淀法、吸附法、离子交换法、膜渗透法、电化学氧化法等[4]。研究人员发现[5],利用吸附法对工业废水进行除氟可以将氟由较高浓度除至中低浓度,但吸附法往往需要加入特殊的处理剂和设置特定设备,导致处理费用高于化学混凝沉淀法,并且操作也较繁琐,因此,吸附法比较适用于城市低浓度含氟饮用水的处理;离子交换法、膜渗透法和电化学氧化法虽除氟效果较好,但由于造价较高,需要另外购买仪器设备,占地面积较大,且对pH和盐度均有较高要求,因此,比较适用于难处理的高浓度含氟工业废水[6-7]。在目前众多的除氟方法中,化学混凝沉淀法由于其除氟步骤简单、除氟药剂相对便宜、具有较强的普适性和工艺条件较为宽松等优点,比较适用于钨冶炼行业的高盐含氟废水的处理[8-9]。
对于钨冶炼行业的高盐氨氮废水,通常使用吹脱法、化学沉淀法、折点氯化法、离子交换法和高级氧化法等对氨氮进行处理,其中吹脱法适用于高浓度氨氮废水中氨氮的脱除,能达到一定的去除效果,但将氨氮处理至达标的能耗较高,处理费用昂贵[10];化学沉淀法工艺较为简单,影响因素少,且能将氨进行回收实现废水资源化利用,但该方法药剂用量较大,从而致使处理成本较高,在高盐废水中沉淀产物杂质较高回收利用难[11];折点氯化法是工业中应用较为广泛的一种除氨氮方法,该方法的处理效率较高,处理效果稳定,且不受水温的影响,但其运行费用较高,副产物容易导致水质的二次污染[12];离子交换法在非高盐废水中除氨氮能够取得一定的效果,具有吸附速率快且可再生的优点,但在高盐废水中,由于废水杂质离子浓度较高,导致树脂用量大、再生难、运行费用高[13]。电化学氧化法经过了多年的摸索,该方法现已较为成熟,作为一种绿色高效的污水处理技术,其可以同时去除工业废水中的COD 和氨氮,且除氨氮效果明显,目前正逐渐被工业化应用并且已有不少工业应用实例[14-16]。因此,基于CaO-CaCl2混凝沉淀法和电化学氧化法对钨冶炼废水污染物处理方面的优势,本研究采用钙盐混凝沉淀法处理钨冶炼废水中氟超标的问题,采用电化学氧化法处理钨冶炼废水中氨氮超标的问题,并分析不同工艺条件对污染物处理的影响,探讨钨冶炼废水中氟和氨氮的去除效果,该方法既可以避免氟对电极的腐蚀,又能将氟和氨氮去除,达到钨冶炼废水处理目的。
1 试验部分
1.1 试验原料
试验所用原料为江西省某钨冶炼企业经过低钨交换吸附钨之后的酸性低钨交后液,pH 值约为3~4,主要污染物为氟和氨氮,其主要污染物成分及排放标准如表1 所示。试验采用LH-T725 多参数水质检测仪(浙江陆恒环境科技有限公司)检测氨氮[17],玻璃电极法检测pH[18],离子选择电极法检测氟[19],试验所用的CaCl2、CaO 和硫酸等化学试剂均为分析纯。由表1 可以看出,试验所用低钨交后液中的氟含量超过污水综合排放标准36 倍,氨氮含量超过污水综合排放标准6 倍。
1.2 试验方法
采用自制装置进行试验,如图1 所示,取低钨交后液300 mL 加入烧杯中,在较优的pH 和石灰投加量条件下搅拌反应一定时间进行第一次除氟,在较优的pH和CaCl2投加量条件下搅拌反应一定时间进行第二次除氟,将反应后的溶液倒入漏斗中进行澄清过滤,取上清液检测其中F–的浓度。取除氟后的上清液,采用钌铱钛电极作为阳极,钛网作为阴极,在较优的电流密度和pH 条件下进行电解除氨氮,电解完成后,取上清液检测其中氨氮的浓度。
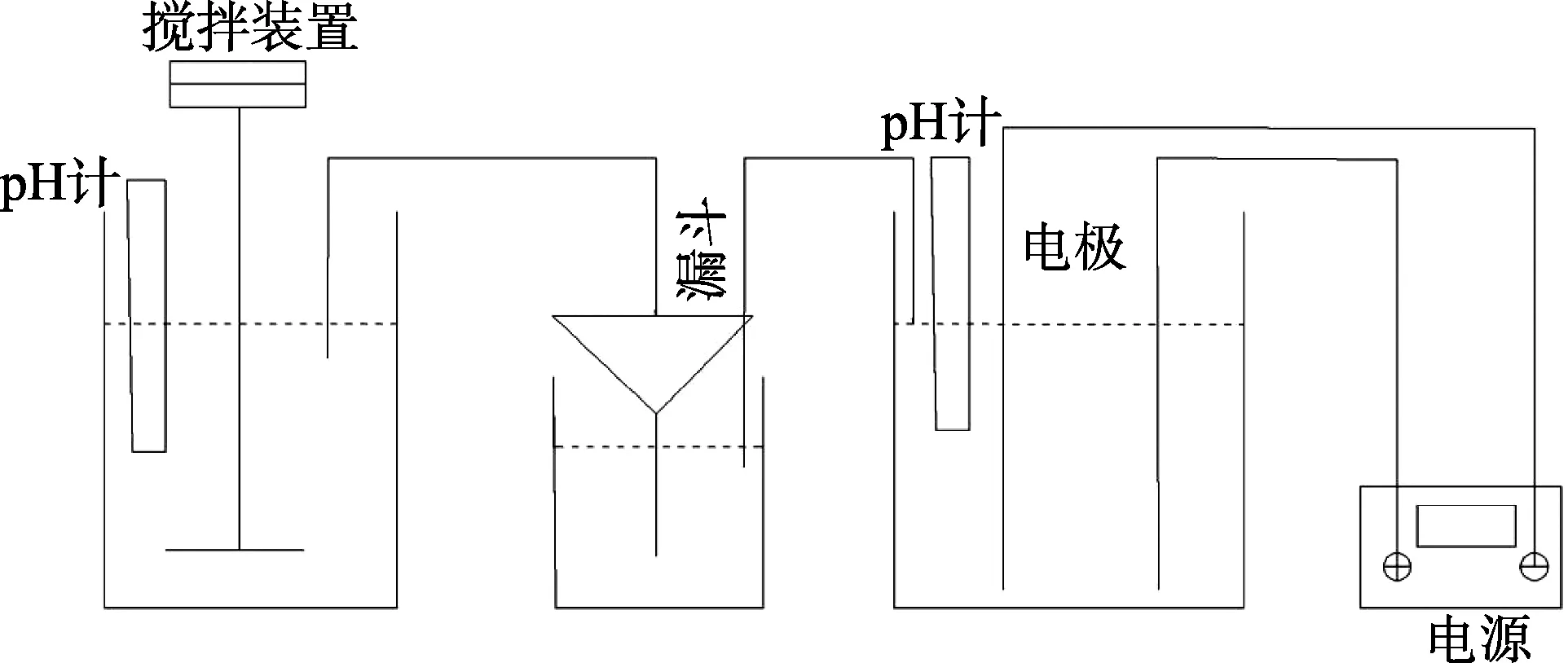
图1 试验装置简易图Fig.1 Simplified diagram of experimental setup
1.3 试验原理
化学混凝沉淀法是在一定的pH 值下,通过添加的试剂和目标污染物反应生成不溶性络合物或胶体物质,通过自然沉降将这些沉淀物或胶体物质分离出来,达到去除污染物的目的[20-21]。本研究联合使用不同钙盐混凝沉淀处理低钨交后液中的氟,钙离子与氟离子进行反应生成难溶性的氟化钙,其中钙离子又与水发生反应形成混凝沉淀,以便于固液分离[22-24],最后利用同离子效应,将除氟效率最大化,具体反应式如式(1)~式(2)。
电化学氧化法去除氨氮按照氧化机理可分为直接氧化和间接氧化,污染物的去除过程是由直接氧化和间接氧化共同作用的综合反应[25]。污染物直接在阳极表面失去电子被氧化的过程称为直接氧化,反应方程式如式(3)所示,污染物被阳极与废水反应产生的强氧化剂氧化去除的过程称为间接氧化,反应方程式如式(4)~式(6)所示。
2 结果与讨论
2.1 CaO 浓度对除氟效果的影响
常温下量取低钨交后液300 mL 于烧杯中,分别加入CaO 1.00 g/L、1.50 g/L、2.00 g/L、2.50 g/L、3.00 g/L、3.50 g/L、4.00 g/L 和4.50 g/L 进行搅拌反应,反应2 h 后过滤沉淀,检测上清液中F–的浓度,考察不同CaO 浓度对废水除氟效果的影响,试验结果如图2 所示。
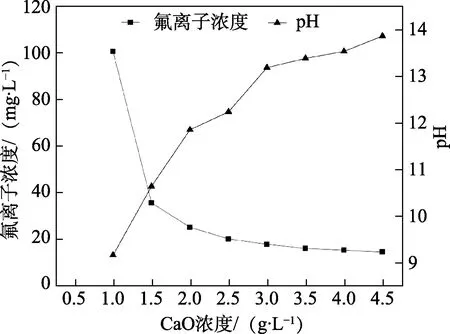
图2 CaO 浓度对除氟效果的影响Fig.2 Effect of CaO concentration on fluoride removal
从图2 可以看出,废水中F–浓度随着CaO 浓度的升高而逐渐降低,pH 随CaO 浓度的升高而逐渐升高;当CaO 加入量超过3.50 g/L 之后,继续加入CaO 对F–去除效果开始变得不明显,此时,pH 已经超过13,水中OH–与F–进行竞争反应,OH–与Ca2+进行反应,逐渐生成大量的氢氧化钙沉淀,导致增加沉淀量和CaO 的成本。根据文献报道[26],常温时CaF2在水中的饱和溶解度为16.5 mg/L,当CaO 浓度为3.50 g/L 时,废水中残余F–浓度为17.68 mg/L,已经接近氟化钙的饱和溶解度,而当CaO 浓度达到4 g/L 时,废水中残余F–浓度为16.18 mg/L,说明CaO 已经加入过量,Ca2+不再主要与F–进行反应,转而大量与OH–进行反应,导致无法将F–除至达标(《污水综合排放标准》(GB 8978—1996)一级标准),因此,考虑试剂消耗成本,选择CaO 的加入量为3.50 g/L 为宜,此时,废水溶液pH 为13 左右。
2.2 CaCl2 浓度对除氟效果的影响
单独使用CaO 进行除氟,很难将废水的F–除至10 mg/L 以下(《污水综合排放标准》(GB 8978—1996)一级标准),因此,在加入CaO 进行第一次除氟后,再加入CaCl2,利用同离子效应进行第二次除氟,并探索CaCl2浓度对除氟效果的影响。常温下量取300 mL 滤液(CaO 处理后的低钨交后液,F–浓度为17.68 mg/L,pH 为13)于500 mL 烧杯中,加入硫酸调节pH 为12,分别加入0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L、0.6 g/L 的CaCl2搅拌反应2 h,过滤沉淀并检测上清液中F–浓度,试验结果如图3 所示。

图3 CaCl2 浓度对除氟效果的影响Fig.3 Effect of CaCl2 concentration on fluoride removal
从图3 可以看出,随着CaCl2加入量的增加,低钨交后液中F–浓度呈现逐渐降低的趋势。当CaCl2投加量为0.5 g/L 时,可将低钨交后液中F–浓度去除至8.21 mg/L,达到了《污水综合排放标准》(GB 8978—1996)一级标准,继续增加CaCl2投加量至0.6 g/L,仅可将低钨交后液中F–浓度除至7.44 mg/L,F–浓度下降不明显,但增加了CaCl2药剂的用量,导致药剂成本上升,因此,选择最佳的CaCl2加入量为0.5 g/L。
2.3 pH 对CaCl2 除氟的影响
常温下量取300 mL 滤液(CaO 处理后的低钨交后液,F–浓度为17.68 mg/L,pH 为13)于500 mL烧杯中,用硫酸分别调节滤液pH 值为4.0、6.0、8.0、10.0、12.0、13.0,投加0.5 g/L CaCl2进行二段除氟,搅拌反应2 h,不同pH 值下CaCl2对滤液的除氟效果如图4 所示。
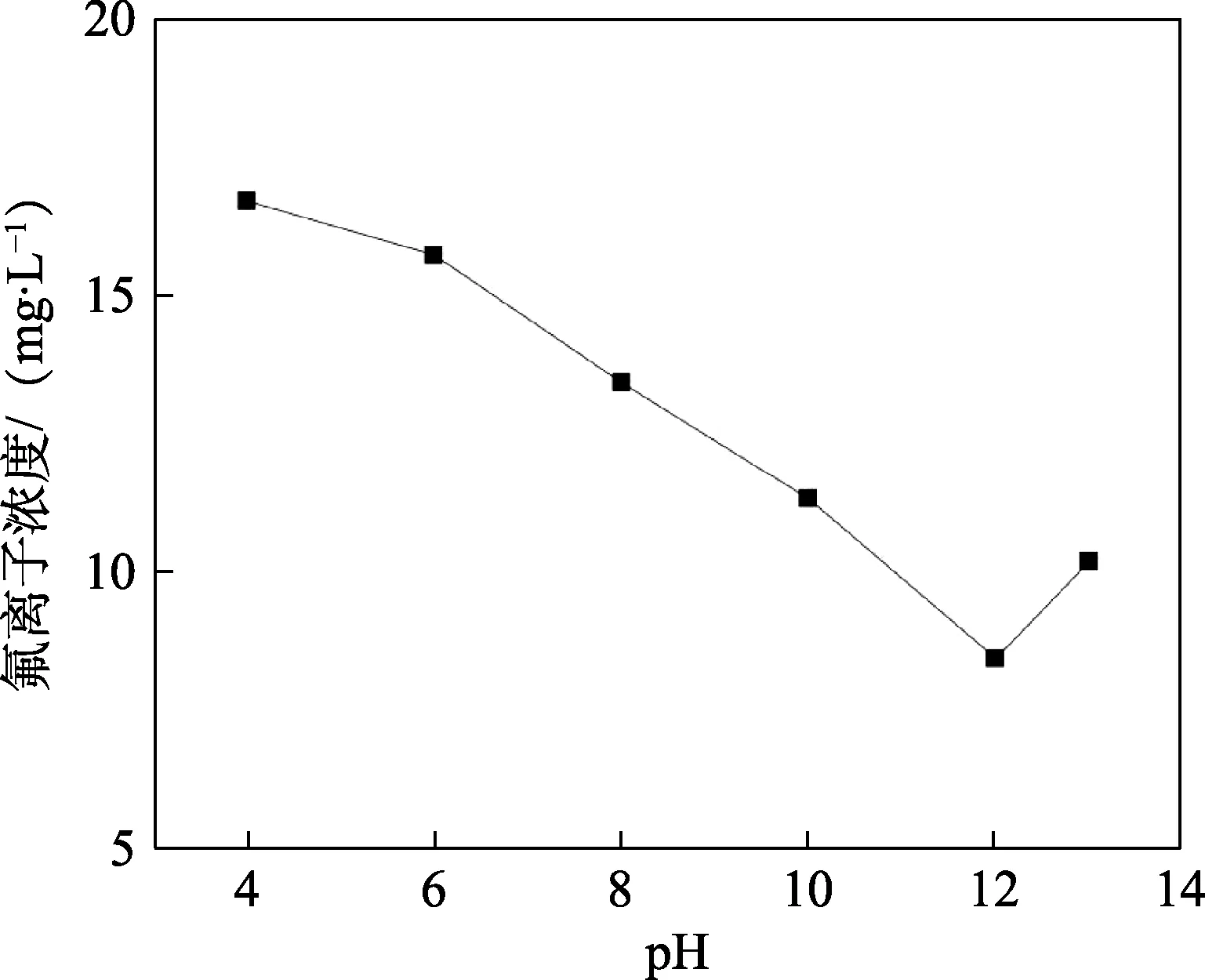
图4 不同pH 值对CaCl2 除氟效果的影响Fig.4 Effect of different pH values on the removal of fluoride by CaCl2
从图4 可以看出,F–浓度随着pH 值的升高而逐渐降低,当pH<6 时(酸性条件下),F–浓度下降缓慢,当pH>8 时,低钨交后液中残余F–浓度开始迅速下降,当pH 为12 时,低钨交后液中残余F–浓度降低至9.24 mg/L,达到排放标准(10 mg/L),继续增加pH 导致Ca2+与大量的OH–进行反应,残余F–浓度开始回升。因此,试验选择CaCl2最佳除氟pH 为12。
2.4 电流密度对电化学氧化法除氨氮的影响
常温下取300 mL 低钨交后液,用CaO 和CaCl2除氟后置于电解槽中,使用钌铱钛网作为阳极,钛网作为阴极,极板间距10 mm,用硫酸调节pH 至9,分别在不同的电流密度下进行电解,每隔2 min 取样检测一次氨氮浓度,分析电流密度对氨氮反应达标所花时间和能耗的影响,结果如图5 所示。
由图5 可知,随着电流密度的增加,氨氮浓度达到排放标准所花时间逐渐减少,氨氮完全降解的时间从22 min 降至约6 min,当电流密度为140 A/m2时,电极反应效率最低,反应时间较长,由于析氧等副反应较少,因此氨氮降解能耗也最低,约为32 kWh/kg。当电流密度达到260 A/m2后,电极反应效率最高,由于析氧等副反应增加,氨氮降解能耗增加至48.73 kWh/kg,由此可见,电流密度过大或过小均会导致成本的增加。当电流密度增加至200 A/m2后氨氮降解时间和氨氮降解能耗减小和增加速率均趋于稳定。综合考虑氨氮去除速率和能耗之间的关系,采用电流密度为200 A/m2作为最佳试验电流密度,此结果与前人的研究一致[14]。
2.5 pH 对电化学氧化法除氨氮的影响
常温下取300 mL 低钨交后液,用CaO 和CaCl2除氟后置于电解槽中,使用钌铱钛网作为阳极,钛网作为阴极,极板间距10 mm,用片碱调节不同pH,在200 A/m2的电流密度下进行电解,每隔2 min 取样检测一次氨氮浓度,分析溶液pH 对氨氮反应达标所花时间和能耗的影响,结果如图6 所示。
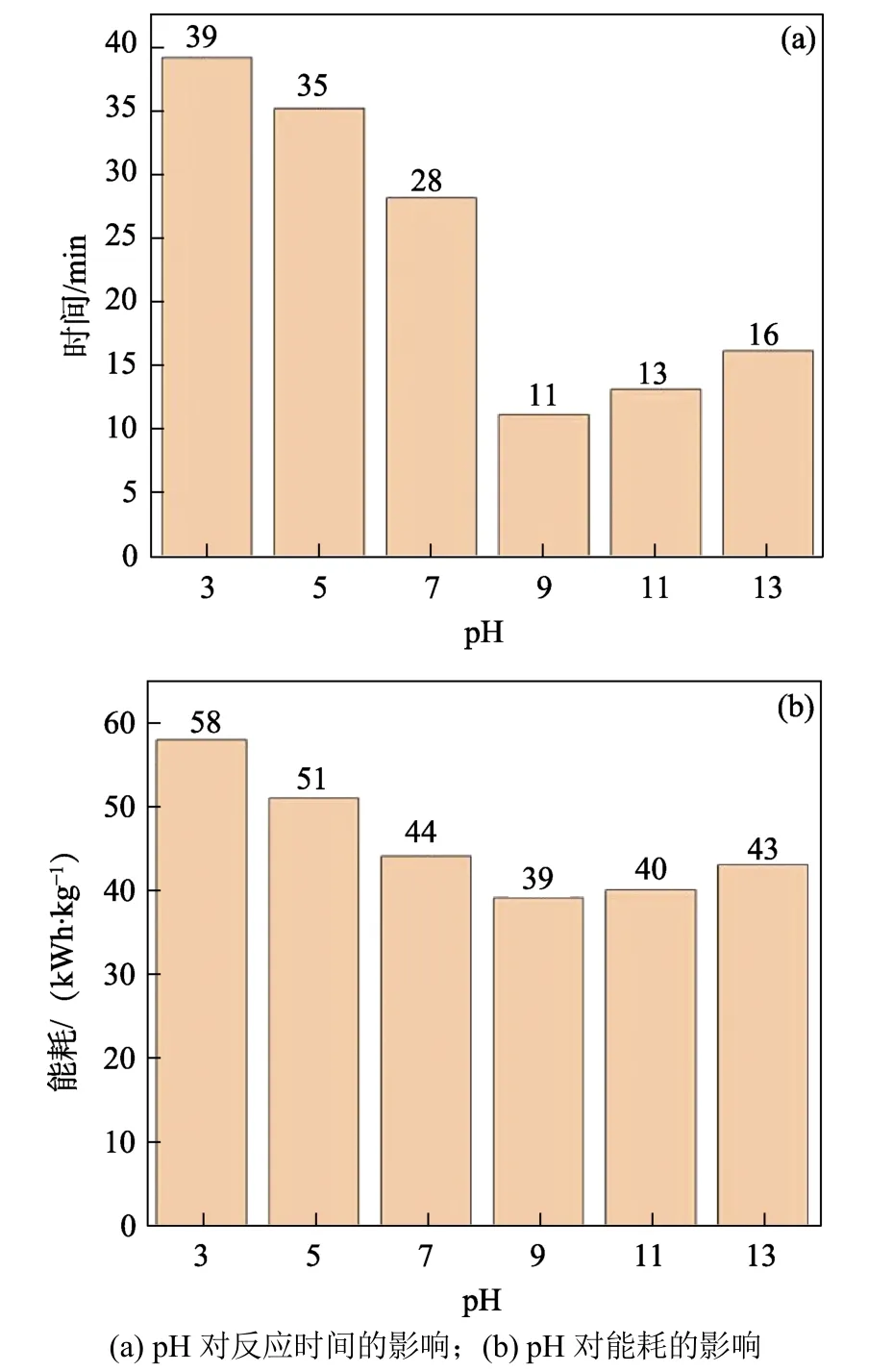
图6 pH 对反应时间和能耗的影响Fig.6 Effect of pH on reaction time and energy consumption
由图6 可以看出,随着低钨交后液pH 值的升高,氨氮去除速率逐渐加快,电解能耗逐渐下降,当pH 为9 时氨氮去除速率最大,电解能耗由58 kWh/kg 的最高点逐渐降到39 kWh/kg 的最低点,当pH 升高至11 时,氨氮去除速率开始降低,电解能耗又逐渐增加。这是由于氨氮在酸性条件下,主要以NH4+离子形态存在,在碱性条件下,主要以NH3分子形态存在,NH4+离子形态比NH3分子形态更难降解,另外,在酸性条件下,反应中产生的有效氯会逐渐形成氯气溢出,导致溶液中强氧化性物质浓度降低,而在强碱性条件下部分氯气又会转化为高氯酸,而高氯酸几乎不参与降解氨氮,导致在强碱性条件下氨氮去除率下降,此外,pH 过高还会发生歧化反应,导致总氮浓度偏高[14],因此,电解除氨氮最佳pH 值应控制在9 左右。
3 结 论
使用CaO 对低钨交后液进行第一次除氟,较优的工艺条件为:加入3.50 g/L 的CaO 后pH 为13 左右搅拌2 h 可以将氟浓度除至17.68 mg/L 左右。使用CaCl2进行第二次除氟,较优的工艺条件为:在pH为12 左右的条件下加入0.5 g/L CaCl2搅拌2 h 可将氟除至9.24 mg/L,达到《污水综合排放标准》(GB 8978—1996)一级标准。
在除氟后,使用电化学氧化法除低钨交后液中的氨氮,较优的工艺条件为:在pH 为9 左右,电流密度在200 A/m2的条件下电解,可在较高反应速率,较低能耗的情况将氨氮除至《污水综合排放标准》(GB 8978—1996)一级标准。
