单纯原发性卵巢鳞癌1例报告并文献复习
2024-01-22王洁严雪冰陈珏薛金俊
王洁 严雪冰 陈珏 薛金俊
原发性卵巢鳞癌(primary ovarian squamous cell carcinoma,PSCC)很罕见,在所有类型的卵巢恶性肿瘤中发病率不足1%[1]。PSCC绝大部分为成熟囊性畸胎瘤恶性转化,少数起源于卵巢Brenner瘤或子宫内膜异位症恶变,而无卵巢基础疾病,由卵巢表面上皮组织鳞状化生的单纯PSCC是极为罕见的类型[2]。本文报道本院1例罕见的单纯PSCC并进行文献复习。
1 病例资料
病人为绝经后女性,63岁。既往体健,无肿瘤家族史。2021年8月出现右下腹隐痛,进行性加重,伴发热,行抗感染治疗疗效差。2021-09-03至我院查胸腹部CT:右侧附件占位,不规则形肿块影,密度不均,局部见液性低密度影,直径约8.5 cm,卵巢癌可能性大;大网膜污垢样改变;腹盆腔少许积液(见图1A)。肿瘤标志物检测:癌胚抗原(CEA)、糖类抗原(CA)125、鳞状细胞抗原(SCC)、CA199水平均升高,CA153、甲胎蛋白(AFP)水平正常。宫颈液基薄层细胞学检查(TCT):非典型鳞状细胞、p16/Ki-67双染显示p16单阳。胃镜:慢性胃炎、胃多发息肉。肠镜:直肠、结肠黏膜未见异常。
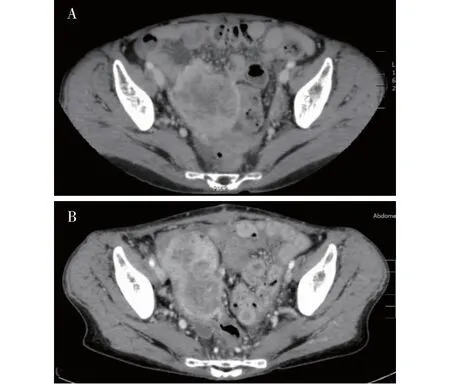
图1 腹部CT影像
排除其他常见部位肿瘤卵巢转移情况,考虑为原发性卵巢癌。于2021-09-13行经腹全子宫切除术+双侧输卵管卵巢切除术+结肠病灶切除术+大网膜切除术+盆腔粘连松解术。术中见:无腹水,子宫正常大小,形态规整,右侧卵巢肿瘤直径6 cm粘连于阔韧带后叶,右侧输卵管与右卵巢肿瘤粘连融合,与乙状结肠粘连。术中冰冻:右附件恶性肿瘤;术后病理:ER(-),PR(-),p63(+),p40(+),CA125(-),CK7(部分+),Pax-8(-),CerbB-2(0),p53(+),Ki-67(60%热点区域+)。右附件见类圆形肿物一枚,大小8 cm×5 cm×5.5 cm,切面均为灰白色,质地中等。右卵巢中-高分化鳞状细胞癌,癌组织呈巢状排列,见有角化珠,部分区域见坏死。右输卵管见癌组织累及。宫颈慢性炎伴鳞状上皮增生。后病理送至复旦大学附属肿瘤医院会诊:右卵巢中-低分化鳞状细胞癌,灶区伴腺样分化;肿瘤伴显著坏死,输卵管见癌累及;萎缩性宫内膜;宫颈慢性炎。免疫组化:p63(+),Pax-8(-),CK7(部分+),p16(-),ER(-),PR(-)。卵巢没有任何其他相关病变的证据,包括畸胎瘤、子宫内膜异位症或Brenner瘤,左附件正常。因此,根据国际妇产科联合会(FIGO2014),该病人被诊断为ⅡB期的单纯PSCC。
术后病人反复诉下腹部隐痛、大便干结难解、少许便血,予对症治疗无缓解。2021-10-17复查胸腹部CT:卵巢癌术后改变,累及乙状结肠;盆腔种植转移;盆腔少许积液;结肠内容物较多、干结(见图1B)。术后短期内盆腔转移复发,其中乙状结肠受侵犯最明显,引起便血、不完全机械性肠梗阻。立即行抢救性化疗1个周期,结合病人一般体力状况[体表面积1.18 m2,美国东部肿瘤协作组(ECOG)评分1分],方案采用白蛋白紫杉醇100 mg第1天、第8天(180 mg/m2,每3周1次)和顺铂30 mg 第1~3天(75 mg/m2,每3周1次),无法联合抗血管生成药物。化疗后症状无缓解,复查SCC、CEA水平升高,且CT提示盆腔病灶增大增多。对病人的肿瘤组织进行二代测序基因检测,结果示:体细胞突变10个(TP53、PIK3CA、MSH6、TERT、LRP1B、KDM6A、LAMA2、ZFHX4、CYP2C8、ARID1A);胚系变异:在69个肿瘤易感基因中未检测到胚系已知/疑似致病变异;肿瘤突变负荷(TMB):2.51 muts/Mb;微卫星稳定(MSS);细胞程序性死亡-配体1(PD-L1)蛋白表达(免疫组化):联合阳性分数(CPS)=2,阳性。2021-11-09调整为替雷利珠单抗200 mg化疗前1 d+白蛋白紫杉醇200 mg第1天、100 mg第8天+顺铂30 mg第1~3天(每3周1次)方案治疗,但化疗期间出现肠道及肺部感染、真菌败血症,最终出现心肺功能衰竭。2021-12-03病人死亡,总生存期仅3个月。
2 讨论
原发性卵巢癌是女性生殖系统第二个最常见的恶性肿瘤,其中组织学类型为鳞状细胞癌比例<1%[1]。大多数情况下,PSCC来源于成熟囊性畸胎瘤,囊性畸胎瘤恶性转化发生率为0.17%~2%,其中80%以上转化为鳞状细胞癌[3]。其他来源见Brenner肿瘤或子宫内膜异位症恶变,仅由卵巢上皮组织化生的单纯PSCC极为罕见。
转移性卵巢癌占所有卵巢肿瘤的5%~6%,其中鳞癌占转移性卵巢癌的2%,最常见的原发肿瘤是宫颈癌[4],但非常罕见,有文献报道其发生率Ⅰb期为0.22%,Ⅱa期为0.75%,Ⅱb期为2.17%[5]。研究发现,近1/3的PSCC病人有早期或同时发生的宫颈上皮内瘤变或原位鳞癌,故最广泛接受的解释是致癌刺激物引起的“场效应”,即致癌刺激物在组织学或胚胎学相似的组织中引起同步或异时性肿瘤形成[4,6],而不考虑宫颈鳞癌卵巢转移。有研究提出,人乳头瘤病毒(HPV)感染能引起“场效应”[7-9],是常见致癌因子,通过编码E6和E6相关蛋白,使得野生型p53蛋白降解失活[10]。Lwasa等[11]对21例畸胎瘤恶化的卵巢鳞癌病人进行分析,发现14例(66.6%)鳞状细胞中观察到p53蛋白过表达,4例(19.0%)发生TP53基因的点突变;18例(85.7%)观察到p16蛋白表达下降,11例(52.4%)发生p16基因改变(高甲基化和点突变),提出p53和p16-Rb通路的改变有助于囊性畸胎瘤到卵巢鳞癌的恶性转化。其他参与肿瘤发生的分子机制可能有复杂染色体畸变、Cox-2表达、上皮-间质转化(EMT)[10]。本病例肿瘤免疫组化:p53(+)、p16(-),存在TP53突变,预示着p53和p16-Rb通路可能也在单纯PSCC发生过程中起到重要作用。
国内外报道了38例PSCC[1,2,4,6-9,12-29]。有32例获得了随访信息,随访时间为9 d至14年,其中死亡19例,无瘤存活10例,带瘤存活3例。不同分期病人的生存曲线见图2,表明FIGO分期是一个重要的预后因素(P=0.000 2)。早期病人在最佳肿瘤切除术后可以达到治愈。晚期(Ⅲ~Ⅳ期)病人即使在积极的手术、放疗、化疗等联合治疗手段下,仍无法长期存活,中位生存期仅6个月,远远低于上皮型卵巢肿瘤病人。
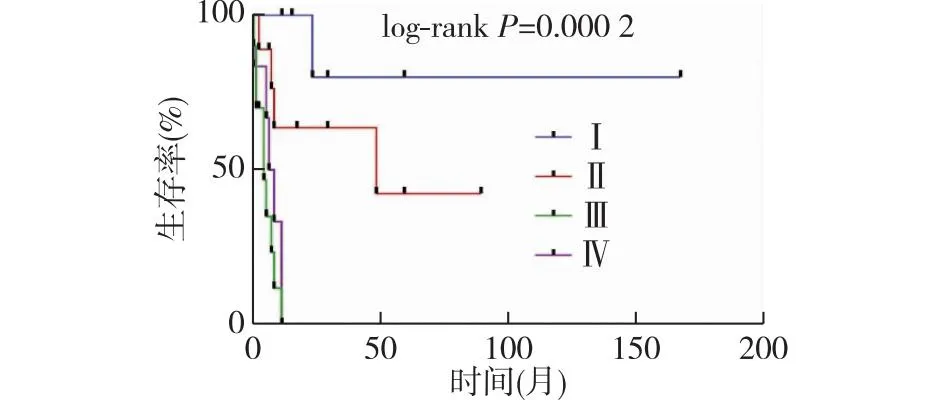
图2 不同FIGO分期病人的生存曲线
本病例及文献复习的38例病人中,发病年龄为14~90岁,平均(51.7±16.2)岁;肿瘤平均直径为10.3 cm(1.5~26 cm);84.6%(33/39)的病人肿瘤发生在单侧卵巢,15.4%(6/39)为双侧卵巢受累;单纯PSCC的术前主要症状为腹痛腹胀、发热、腹部肿块,其他症状有咳嗽、阴道或直肠出血、腿痛,均为肿瘤相关性。还有3例病人无症状,在体检中发现。
多项研究肯定了血清SCC水平在成熟囊性畸胎瘤恶化成卵巢鳞癌中的临床应用价值[30-32],然而对单纯PSCC的肿瘤标记物研究未见报道。包括本报道共有4篇报道发现SCC在疾病诊疗过程中存在与病情变化相一致的动态改变,提示SCC在单纯PSCC的术前诊断和病情监测中具有肯定的临床价值。
有证据表明,术后放疗不能改善PSCC晚期病人的预后,但化疗可以延长病人的生存期[25, 31],而目前尚无公认的辅助化疗方案。在众多囊性畸胎瘤转化的卵巢鳞癌研究中,Li等[3]认为含铂化疗方案可以提高病人总体生存率,最常用的全身化疗方案是紫杉醇/铂类[6]。由于单纯PSCC的极其罕见性以及诊断偶然性,其最佳治疗方法仍不清楚。本病例及文献复习中所有病人均接受手术切除,主要为子宫和双侧输卵管卵巢切除术。化疗方案均采用含铂为基础的联合化疗,10例病人采用紫杉醇联合铂类方案,其中6例病人采用该化疗方案有效,有效率达60%。考虑到肿瘤生物学特性,笔者认为单纯PSCC的标准治疗可与畸胎瘤恶化的卵巢鳞癌类似,参照卵巢上皮癌,包括全面分期手术和最大程度减瘤手术,以及选用紫杉醇/铂类为基础的辅助化疗方案。对于肿瘤高负荷或复发疾病的病人采用更积极的治疗方案,从其他部位的鳞状细胞癌研究中推断,化疗联合表皮生长因子受体(EGFR)/血管内皮生长因子(VEGF)抑制剂、程序性死亡受体1(PD1)/PD-L1免疫抑制剂,可能增加治疗疗效,已有文献报道了生存获益[33-34]。
本病例中,病人行肿瘤根治性切除术,术后不足1个月出现盆腔广泛转移,肿瘤快速生长,且对白蛋白紫杉醇和顺铂的联合化疗方案无效,认为其存在固有耐药性。化疗耐药的分子机制有多方面,包括转运蛋白、癌基因(EGFR、PI3K/Akt、Erk和NF-κB)、肿瘤抑制基因(p53)、线粒体改变、DNA修复、自噬、EMT、肿瘤干细胞和外泌体[35]。TP53突变可导致p53表达缺失或突变型p53蛋白的产生。本病例中检测出TP53突变,p53(+),预示着机体表达突变型p53蛋白,大量突变型p53蛋白失去野生型功能,获得促进肿瘤发生及持续增殖、抗细胞凋亡、化疗耐药、激活侵袭和转移等功能[36]。另有报道EMT在单纯PSCC的肿瘤发生过程中发挥着作用[25],EMT可促进肿瘤干细胞的形成,而肿瘤干细胞通过调节多种机制,如ABC转运体、缺氧、活性氧生成和EMT来促进化疗耐药性[37]。Deng等[38]发现,通过抑制PI3K/Akt/mTOR信号通路,逆转EMT,可降低卵巢上皮癌细胞中肿瘤干细胞标志物的表达,减弱化疗耐药性。本病例中存在PIK3CA突变,可激活PI3K/Akt/mTOR信号通路,促进化疗耐药性。故从基因上看,肿瘤增殖迅速,对化疗耐药,其中TP53、PIK3CA突变起到重要作用,而其他基因发挥的作用需进一步研究。
Cooke等[39]研究发现,畸胎瘤恶化的卵巢鳞癌中TP53、PIK3CA和CDKN2A的突变率高,其突变频率与肺鳞状细胞癌相似,推测卵巢鳞癌可以像肺鳞癌一样受益于免疫检查点抑制剂,并且目前也有治疗成功的病例报道[34]。本病例二代测序结果显示,TP53、PIK3CA突变,TMB及PD-L1表达偏高,提示免疫治疗可能有所获益。然而病人未到免疫治疗评估时间窗即死亡,故无法评估免疫治疗的效果。
总之,单纯PSCC是一种极其罕见的恶性肿瘤,主要见于绝经后女性。FIGO分期Ⅰ期病人的预后远远好于晚期病人。但大多数病人确诊时即为晚期,尽管采用手术、放疗、化疗的联合治疗手段,生存期仍很短。由于罕见的发病率,大规模的前瞻性临床试验不可行,无法研究病人的最佳治疗手段,建议进一步研究单纯PSCC的基因组特征,了解肿瘤的分子机制,或许可从中寻找到治疗靶点及选择使用相应的靶向或免疫药物来延长晚期病人的生存期。
