胃癌病人AHNAK表达与巨噬细胞浸润及预后的相关性
2024-01-22孙洁查秀芳徐瑾赵君宁何伟张楠楠
孙洁 查秀芳 徐瑾 赵君宁 何伟 张楠楠
胃癌(GC)为仅次于肺癌和结直肠癌(死亡率分别为18.4%和9.3%)的第三大癌症相关的死因[1]。大多数GC病人早期无特异性症状,因此确诊时多已进展至晚期GC。尽管目前早期GC治疗的成功率有所提高,但晚期GC病人预后仍较差,其5年生存率<20%[2]。肿瘤微环境(TME)的结构成分主要包括基质细胞和免疫细胞。AHNAK也称桥粒蛋白,最初被认为是神经母细胞瘤细胞类型中的一种大分子肿瘤相关核蛋白,在血脑屏障形成、细胞结构和迁移、心脏钙通道调节和肿瘤转移等多种过程中发挥重要作用[3]。肿瘤免疫治疗是继靶向治疗的另一种具有巨大潜力的治疗策略,而TME是影响免疫治疗反应的重要因素,结合TME中多种免疫调节机制的新型免疫疗法将可能改善GC病人的预后[4]。然而,AHNAK在GC预后中的作用及与免疫细胞浸润之间的关系尚不明确。本研究通过生物信息数据库,分析GC组织中AHNAK的表达与免疫细胞浸润水平之间的关系以及其对GC病人预后的预测作用,为GC的诊断、预后评估、肿瘤免疫治疗提供理论依据。
1 资料与方法
1.1AHNAK表达水平分析 利用UALCAN[5](http://ualcan.path.uab.edu/index.html)数据比较AHNAK基因在GC组织与正常组织中的表达水平。UALCAN是一个基于TCGA数据库的相关癌症数据进行在线分析和挖掘的网站工具,可对研究的癌症查看整体的基因表达情况,获得基因表达热图,并且对相关基因进行鉴定、表达谱分析、生存分析以及亚组分析等。
1.2 肿瘤免疫细胞浸润评估 使用TIMER 2.0[6](http://timer.cistrome.org/)分析AHNAK的表达水平与GC免疫细胞浸润水平及免疫细胞标志物表达水平的相关性。TIMER数据库主要采用RNA-Seq表达谱数据,其中,免疫细胞主要包括以下6种细胞:B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞。
1.3 GC病人的生存分析 根据AHNAK表达水平的中位数将GC病人分为高表达组和低表达组。使用Kaplan-Meier Plotter[7](http://kmplot.com/analysis/)分析AHNAK不同表达水平对总生存期(OS)的影响。下载TCGA数据库中GC病人的相关临床资料,分析不同临床特征对GC病人预后的影响。
1.4 统计学处理 使用SPSS 24.0软件进行统计学分析,采用log-rank检验比较2组生存曲线间的差异;各指标间的相关性采用Spearman相关分析;采用Cox回归分析可能影响GC病人预后的因素。使用RMS包将影响预后的相关因素构建预测GC病人1、3、5年生存概率的列线图,并进行校准分析与可视化。以P<0.05为差异有统计学意义。
2 结果
2.1AHNAK在GC病人中的表达情况 UALCAN数据库分析显示,与正常组织相比,AHNAK在GC组织中低表达(P<0.05),见图1A;进一步对GC病人的年龄进行分组,结果显示,41~60岁、61~80岁、81~100岁GC病人的AHNAK表达量明显低于正常组织(P<0.01),且41~60岁及61~80岁GC病人的AHNAK表达量高于81~100岁GC病人(P<0.05),见图1B。
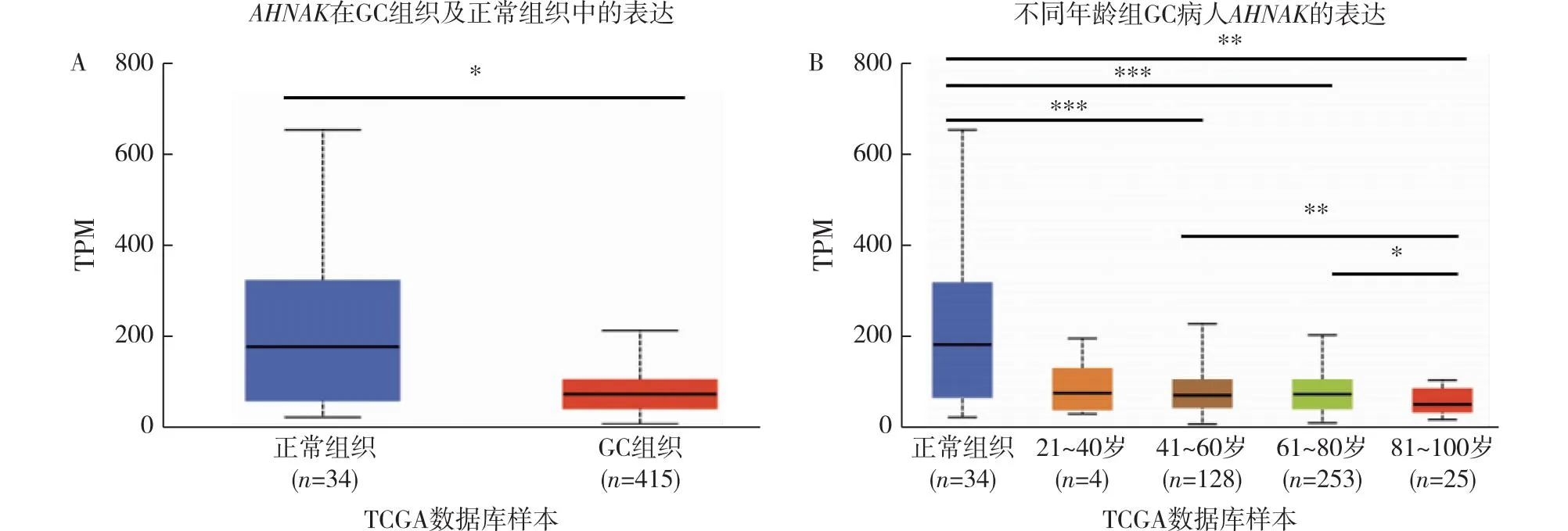
注:A:AHNAK在GC组织与正常组织的表达情况比较;B:AHNAK在不同年龄GC病人中的表达情况比较;TPM:transcript per million。图1 AHNAK在GC病人中的表达情况
2.2AHNAK与免疫细胞浸润的关系以及二者对GC病人OS的影响 TIMER数据库分析结果显示,AHNAK表达水平与巨噬细胞、中性粒细胞、树突状细胞、B细胞、CD4+T细胞、CD8+T细胞浸润水平均存在相关性(P<0.05),见图2A;进一步分析发现,高巨噬细胞浸润水平的GC病人的OS更短(P=0.004),其他免疫细胞浸润水平对GC病人的OS无显著影响(P均>0.05),见图2B。Kaplan-Meier Plotter数据库分析显示,AHNAK低表达的GC病人的OS更短(P<0.01,图2C)。
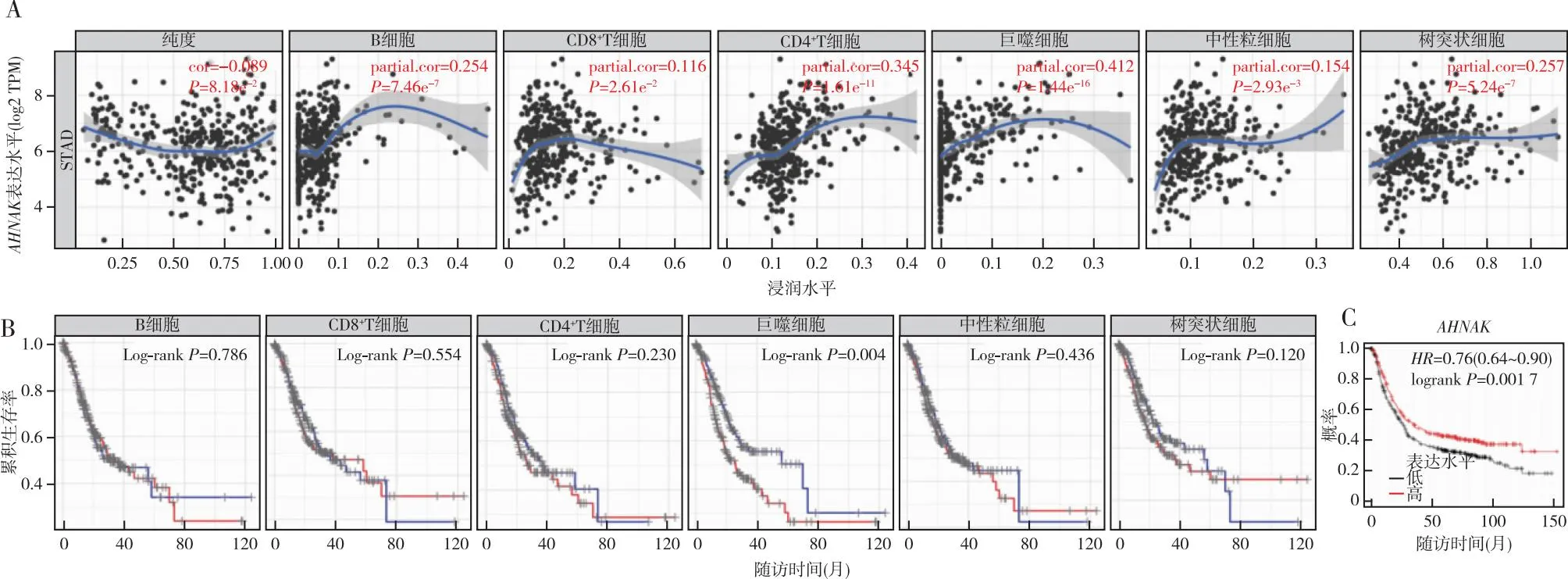
注:A:AHNAK与免疫细胞浸润的相关分析;B:不同免疫细胞浸润水平与GC病人预后的Kaplan-Meier曲线(蓝线为低浸润水平,红线为高浸润水平);C:不同AHNAK表达水平病人预后的Kaplan-Meier曲线。图2 AHNAK与免疫细胞浸润的关系及二者对GC预后的影响
2.3AHNAK与不同分化类型巨噬细胞浸润及其标记物之间的关系 TIMER数据库分析结果显示,AHNAK的表达水平与M2型巨噬细胞浸润水平呈正相关(P<0.001)与M1型巨噬细胞浸润水平无关(P=0.204),见图3A;进一步分析AHNAK与M2型巨噬细胞相关基因表达水平之间的关系,结果显示,AHNAK表达水平与RAI14、PCOLCE2、CTSK、MS4A4A、CD163、VSIG4基因表达水平均呈正相关(P<0.001),见图3B。
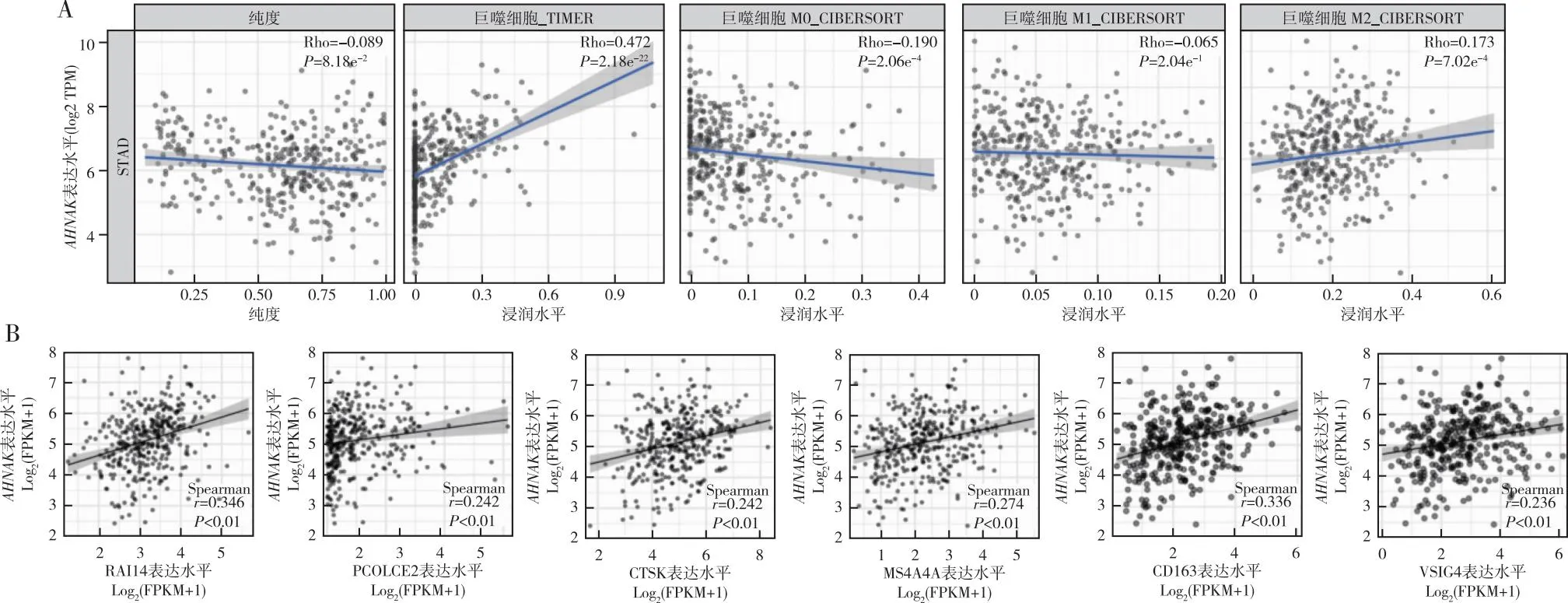
注:A:AHNAK与不同分化类型巨噬细胞浸润的相关分析;B:AHNAK与M2型巨噬细胞相关基因的相关分析。
2.4 Cox回归分析不同临床病理特征对GC病人预后的影响 将TCGA数据库中GC病人的相关资料与预后情况先进行单因素Cox回归分析,再将单因素Cox回归分析中P<0.1的因素纳入多因素回归分析,结果显示,N分期、M分期、AHNAK表达水平、年龄是GC病人预后的独立影响因素(P<0.05)。见表1。
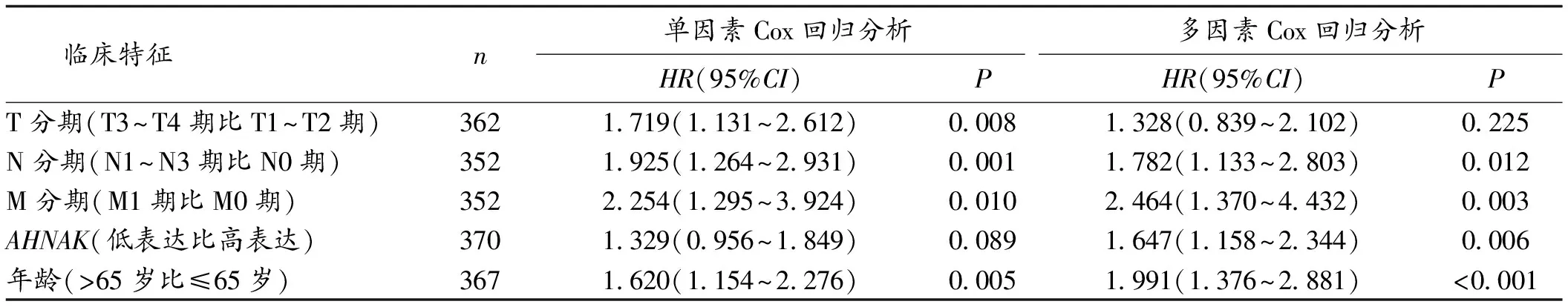
表1 Cox回归分析不同临床病理特征对GC病人预后的影响
2.5 预测GC病人1、3、5年生存概率的列线图及校准曲线的构建 将N分期、M分期、年龄、AHNAK表达水平纳入RMS包构建预测GC病人1年、3年、5年生存概率的列线图,见图4A。图4B为列线图的校准曲线,图中的偏差修正线接近理想曲线,表明预测值与观测值之间具有良好的一致性。
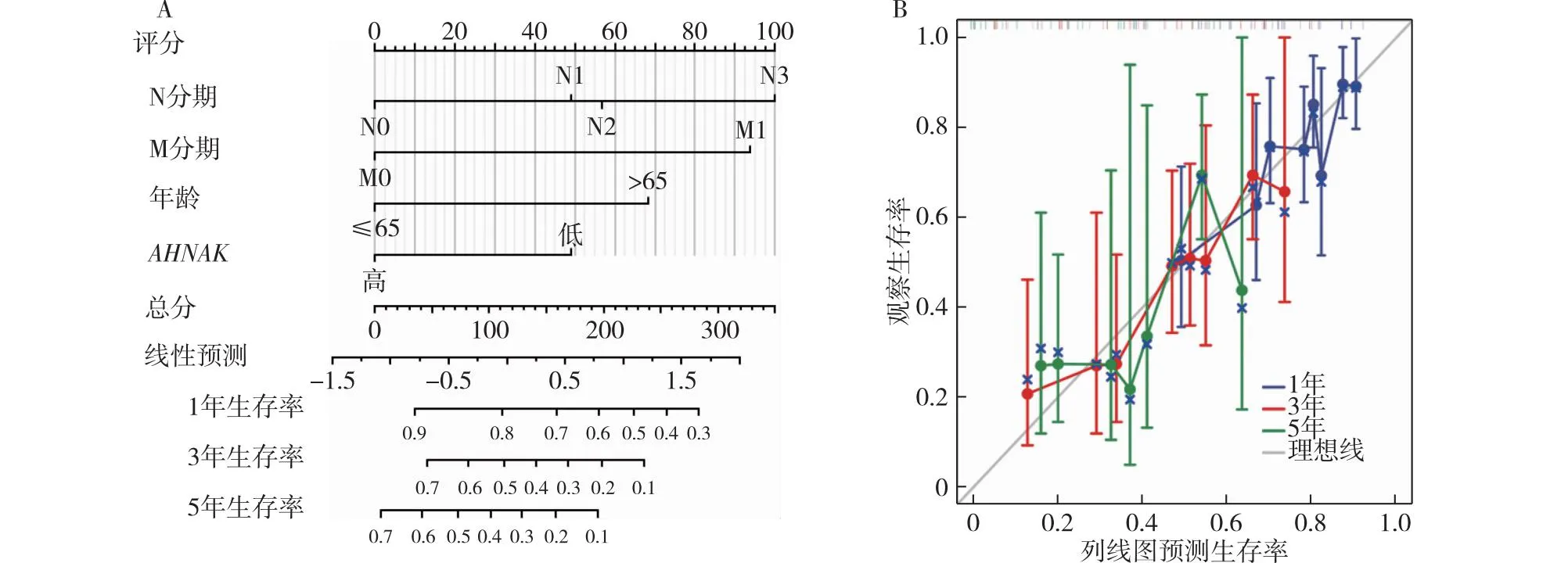
注:A:预测GC病人1、3、5年生存概率的列线图;B:预后校准图验证列线图的预测效果。
3 讨论
GC是我国最常见的癌症之一,早期诊断GC有治愈可能,但晚期GC多已表现为广泛浸润和转移,预后较差[8]。TME是围绕肿瘤细胞的动态复杂环境,包括各种免疫细胞、细胞外基质、成纤维细胞、信号分子和血管。肿瘤免疫细胞浸润是影响癌症发展和治疗的关键因素,其中,肿瘤相关巨噬细胞(TAM)在肿瘤的进展中发挥重要作用,其与癌症转移和较差的预后有关[9]。研究表明,M2型巨噬细胞分泌的转化生长因子-β、血管内皮生长因子等细胞因子在诱导肿瘤细胞侵袭和迁移方面具有不同的功能[10]。因此,深入了解不同巨噬细胞分化类型在TME中的潜在分子机制及其对肿瘤细胞侵袭和迁移的影响,对探索新的诊断方法和治疗靶点非常重要。
近年来,多项研究表明,AHNAK在不同类型的癌症中发挥不同的作用。有研究发现,AHNAK2基因在肺腺癌肿瘤组织中显著过表达,是肺腺癌病人的独立预后预测指标。本研究通过对权威数据库进行分析,发现与正常组织相比,AHNAK在GC组织中低表达,且41~60岁及61~80岁GC病人的AHNAK表达量高于81~100岁GC病人(P<0.05),提示年龄与GC病人AHNAK的表达密切相关,且高龄老年人的AHNAK表达量较低。
研究表明,AHNAK的表达与活化B细胞、CD8+T细胞和未成熟B细胞浸润呈负相关,与CD4+T细胞、TAM、M1型巨噬细胞和M2型巨噬细胞浸润呈正相关[11]。本研究免疫浸润分析结果显示,AHNAK的表达水平与巨噬细胞、中性粒细胞、树突状细胞、B细胞、CD4+T细胞、CD8+T细胞浸润水平均存在相关性,其中高巨噬细胞浸润水平与GC病人较差的预后相关;此外,AHNAK表达水平与M2型巨噬细胞中的RAI14、PCOLCE2、CTSK、MS4A4A、CD163、VSIG4标记性基因的表达水平均呈正相关(P<0.001),从而进一步提示AHNAK可能通过影响M2型巨噬细胞浸润改变TAM,并影响GC进展。
本研究多因素Cox回归分析结果显示,年龄>65岁、AHNAK低表达、高NM分期为GC病人预后差的独立危险因素,此外,利用上述危险因素构建的预测GC病人预后的列线图,其预后校准图提示预测值与观测值具有较好的一致性。综合以上数据表明,AHNAK可作为预测GC病人OS有价值的生物标志物,且在>65岁的老年病人中具有重要的预后价值,可作为辅助临床诊疗的参考依据。
本研究存在一定的局限性。首先,本文是通过使用公共数据库的回顾性数据进行分析和验证的,因此,未来仍需要前瞻性的临床及实验数据来验证其临床实用性。其次,由于数据信息有限,未能进行更为详细的亚组分析,将来需收集更为详细的数据以便进行深入分析。总之,AHNAK的表达水平与GC病人预后和免疫细胞浸润水平相关,AHNAK可能在免疫细胞浸润中发挥重要作用,可作为预测老年GC病人预后的候选标志物。
