基于网络药理学和分子对接的白藜芦醇治疗口腔鳞状细胞癌的机制研究
2024-01-22陈虹君雷奇王治林钟晓武邱亚李丽华
陈虹君, 雷奇, 王治林, 钟晓武, 邱亚, 李丽华
1.川北医学院附属医院口腔科,四川 南充(637000); 2.川北医学院口腔医学系,四川南充(637000); 3.川北医学院附属医院检验科,四川南充(637000); 4.川北医学院附属医院医学研究中心,四川南充(637000)
2020 年全球口腔癌新增病例约37 万例,死亡病例约17 万例[1],2020 年中国口腔癌新增3 万例,中国口腔癌发病率增长速度较世界平均水平的趋势更快。尽管治疗技术在不断发展,但口腔癌患者的5 年生存率仍然低于50%[2-3],因此寻求一种新的治疗方案是近年来亟待突破的重点和难点。白藜芦醇(resveratrol,RES)为一种天然多酚化合物,可以调节细胞代谢,具有抗炎和抗肿瘤作用[4],是临床上比较理想的抗癌药物[5-7]。现有研究表明白藜芦醇可抑制口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)的发生发展[8],然而其作用机制尚不明确。本研究基于大数据库,采用网络药理学及分子对接等方法,探索白藜芦醇治疗OSCC的作用机制,采用细胞实验进一步评估,旨为后续研究及临床应用提供参考。
1 资料和方法
1.1 主要材料与仪器
白藜芦醇(北京索莱宝科技有限公司,中国);OSCC 细胞株HSC-3(广州吉妮欧生物科技有限公司,中国);DMEM 培养基(上海格来塞公司,中国);RIPA 裂解缓冲液、青-链霉素溶液、0.25%胰酶细胞消化液、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、PBS 缓冲液(武汉博士德生物工程有限公司,中国);BCA 试剂盒(上海易色医疗科技有限公司,中国);表皮生长因子受体(epidermal growth factor receptor,EGFR)、雌激素受体基因1(estrogen receptor gene 1,ESR1)、Src 酪氨酸激酶(Src tyro-sine kinase,SRC)、磷酸化磷酸肌醇3 激酶(phosphorylated phosphotylinosital 3 kinase,p-PI3K)、磷酸化蛋白激酶B(phosphorylated AKT protein,p-AKT)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(兔抗人)以及羊抗兔二抗IgG(杭州华安生物公司,中国);预染蛋白Marker(北京迪拜尔生物科技,中国);聚丙烯酰胺凝胶快速配置试剂盒(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)(北京迪拜尔生物科技,中国);ECL 化学发光液(南京唯赞生物科技,中国);蛋白电泳设备(PowerPac HC,Bio-Rad,美国);恒温金属浴仪(BL-10A,上海比朗仪器有限公司,中国);化学发光成像仪(FUSION FX7,VILBER LOURMAT 公司,法国);细胞培养箱(3111,Thermo Fisher,美国);酶标仪(Spectra-Max,Molecular Devices 公司,美国);光学显微镜(CKX53SF,OLYMPUS,日本);台式低温离心机(Sorvall ST 16R,Thermo Fisher,美国)。
1.2 实验方法
1.2.1 白藜芦醇靶点筛选 从PubChem(https://pubchem.ncbi.nlm.nih.gov)中获取白藜芦醇的SMILES 格式文件,将白藜芦醇SMILES 格式文件分别导入Swiss Target Prediction 数据库(http://www.swisstargetprediction.ch),SEA 数 据 库(http://sea.bkslab.org)、Pharm mapper 数据库(http://lilab-ecust.cn),物种选择为“人类”(Homo sapiens),进行靶点预测,选取“probability”值大于0 的潜在作用靶点。在Swiss ADME(http://www.swissadme.Ch)中,白藜芦醇符合Lipinsk、Ghose、Veber、Egan、Muegge这四种类药性原则,表明它具有良好的成药潜力;结果显示肠胃吸收(gatrointestinal absortion,GIabsortion)的为“High”,表示白藜芦醇具有较好的口服生物利用度(Bioavailability Score:0.55)。
1.2.2 OSCC 靶点搜集及与白藜芦醇共同靶点获取 在DISGENET(www.disgenet.org)、OMIM(https://omim.org)、GeneCards(https://www.genecards.org)数据库检索关键词“oral squamous cell carcinoma”,得到OSCC 相关靶点。将白藜芦醇的预测靶点与OSCC 相关靶点取交集后得到交集基因,重合的靶点即为白藜芦醇作用于OSCC 的相关靶点。
1.2.3 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建及核心基因筛选 采用Cytoscape 3.7.2 构建可视化“药物-靶点-疾病-通路”网络图,将白藜芦醇与OSCC 的交集基因导入String数据库(https://string-db.org),以Interaction score>0.4 挑选交集基因,并摘除游离基因,将得到的PPI信息结果导入Cytoscape 3.7.2 软件,得到PPI 网络图。
1.2.4 分子对接验证 从PubChem(https://pubchem.ncbi.nlm.nih.gov)下载白藜芦醇结构式,并通过Open Babel 2.4.1 软件将该结构文件的格式保存为*mol2。然后在Autodock Tools 1.5.6 软件中优化处理配体小分子,对其进行加氢原子、加载电荷等操作后得到优化的结构并储存为pdbqt 结构文件。将PPI 网络中度(degree)值前三的3 个核心蛋白被选取用于分子对接。从PDB 数据库(http://www.resb.org/)得到EGFR、ESR1、SRC 的三维结构pdb 格式文件。使用PyMOL2.4 作图软件去除蛋白中的水分子以及无关配体,之后在AutodockTools 1.5.6 分子对接软件中,对预处理过的大分子蛋白进行再次修饰,包括加氢、加载Gasteiger 电荷等操作。最后将其作为受体分子并保存成pdbqt 格式文件,并用Autodock Vina 进行小分子与蛋白对接,将对接结果导入PyMOL 进行分子对接制图。
1.2.5 富集分析 利用DAVID 网站(https://david.ncifcrf.gov)对白藜芦醇治疗OSCC 潜在靶点相关生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)和信号转导通路进行富集分析与数据整理,建立数据文件。确定BP、CC、MF 涉及的相关条目。根据P<0.05 确定KEGG(Kyoto encyclopedia of genes and genomes)中涉及的信号通路,并根据P值大小取前20 条绘制气泡图,采用Cytoscape 制作可视化药物-疾病-靶点-通路网络图。
1.2.6 细胞培养及干预 将HSC-3 细胞悬液接种于培养皿,置于37 ℃、5% CO2培养箱中培养。实验分为空白对照组和白藜芦醇药物干预组,空白对照组不做药物处理,药物干预组分别使用浓度为50 μmol/L 和100 μmol/L 白藜芦醇干预。待细胞处于对数生长期时进行给药处理24 h。
1.2.7 Western blot 检测蛋白表达 收集各组细胞加入增强型RIPA 裂解液冰上孵育45 min,将裂解液在12 000 g,4 ℃下离心10 min 提取蛋白。蛋白浓度使用BCA 蛋白定量试剂盒检测。将总蛋白与上样缓冲液混合,进行SDS-PAGE 电泳,凝胶常规处理后,将蛋白转移到PVDF 膜,5%脱脂牛奶封闭1 h,加入合适浓度的GAPDH(内参),SRC、EGFR、ESR1、p-PI3K、p-AKT 一抗4 ℃孵育过夜,与抗兔辣根过氧化物酶偶联抗体在室温下孵育1 h,孵育后常规洗膜处理,ECL 化学发光显影,使用Bio-Rad 凝胶成像系统观察蛋白表达。Image J 软件对目的条带进行统计分析,蛋白相对表达水平=目的条带灰度值/GAPDH 条带灰度值。
1.3 数据处理
处理数据使用GraphPad Prism 8,数据检测至少重复3 次。组间比较采用方差分析,方差齐性时,用oneway ANOVA 检验,两两比较则用LSD-t检验;方差不齐时,采用KruskalWallisH检验。P<0.05 表示有统计学差异。
2 结 果
2.1 白藜芦醇及OSCC 潜在靶点获取
在PubChem 软件里找到白藜芦醇的SMILE 格式文件将其导入Swiss Target Prediction、SEA 数据库、Pharm mapper 数据库,将3 个数据库收集的靶点去重,一共得到243 个白藜芦醇相关靶点。将Gene Card 数 据 库、DISGENET 数 据 库、OMIM 数 据库3 个数据库收集的靶点去重,一共得到OSCC 相关靶点有6 094 个。利用Venn 图取交集得到116 个交集基因(图1)。
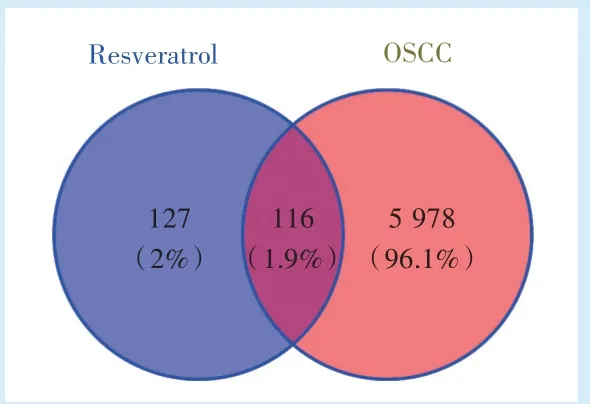
Figure 1 Venn diagram图1 维恩图
2.2 白藜芦醇与OSCC PPI 网络构建及核心基因筛选
将白藜芦醇与OSCC 的共有靶点导入String 数据库构建PPI 网络,见表1 及图2。表1 分析结果显示,度值前三的靶点为EGFR、ESR1、SRC,与白藜芦醇治疗OSCC 的作用机制相关度较高。将116 个潜在靶点,导入Cytoscape3.7.2 软件,绘制出白藜芦醇-OSCC-靶点-通路(网络图)(图3),图中可以看出,白藜芦醇通过多靶点作用于OSCC。
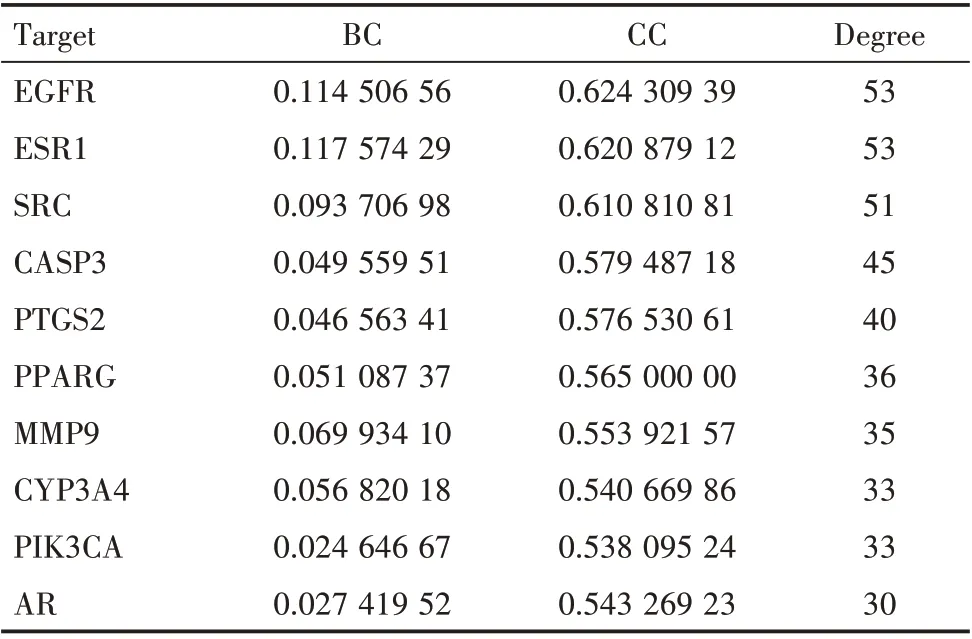
表1 白藜芦醇抗OSCC 关键靶点拓扑分析(前10 位)Table 1 Topological analysis of the core target of resveratrolin the OSCC treatment (top 10)
2.3 白藜芦醇与OSCC 关键靶点蛋白分子对接验证
将PPI 网络中度值前三的3 个核心蛋白进行分子对接验证。通常认为结合能<-5 kcal/mol 表示两者可以结合,<-7 kcal/mol 表示两者有较好的结合能力。EGFR 与白藜芦醇、ESR1 与白藜芦醇、SRC 与白藜芦醇分子对接的蛋白结合能分别为-5.7 kcal/mol、-5.46 kcal/mol、-6.46 kcal/mol,EGFR、ESR1、SRC 均能与白藜芦醇结合。
图4 为蛋白分子对接结合位点模拟图,提示白藜芦醇对OSCC 的稳定性:白藜芦醇与EGFR 的分子对接图(图4a)中氢键的距离小于传统的3.5A,对稳定小分子化合物起着重要作用,说明白藜芦醇能够较好地匹配EGFR 蛋白的活性口袋;白藜芦醇与蛋白ESR1 氢键的形成(图4b)说明两者结合良好;白藜芦醇与蛋白SRC 结合(图4c)形成了6个氢键,氢键数量多且平均键长较短,说明二者结合紧凑,结合能力较强。
2.4 白藜芦醇治疗OSCC 潜在靶点通路富集分析
利用DAVID 数据库对靶点进行GO 生物过程的富集分析。研究白藜芦醇-OSCC 相关靶点的生物过程(BP)、细胞组分(CC)和分子功能(MF),根据P<0.01,确定了250 个GO 条目。
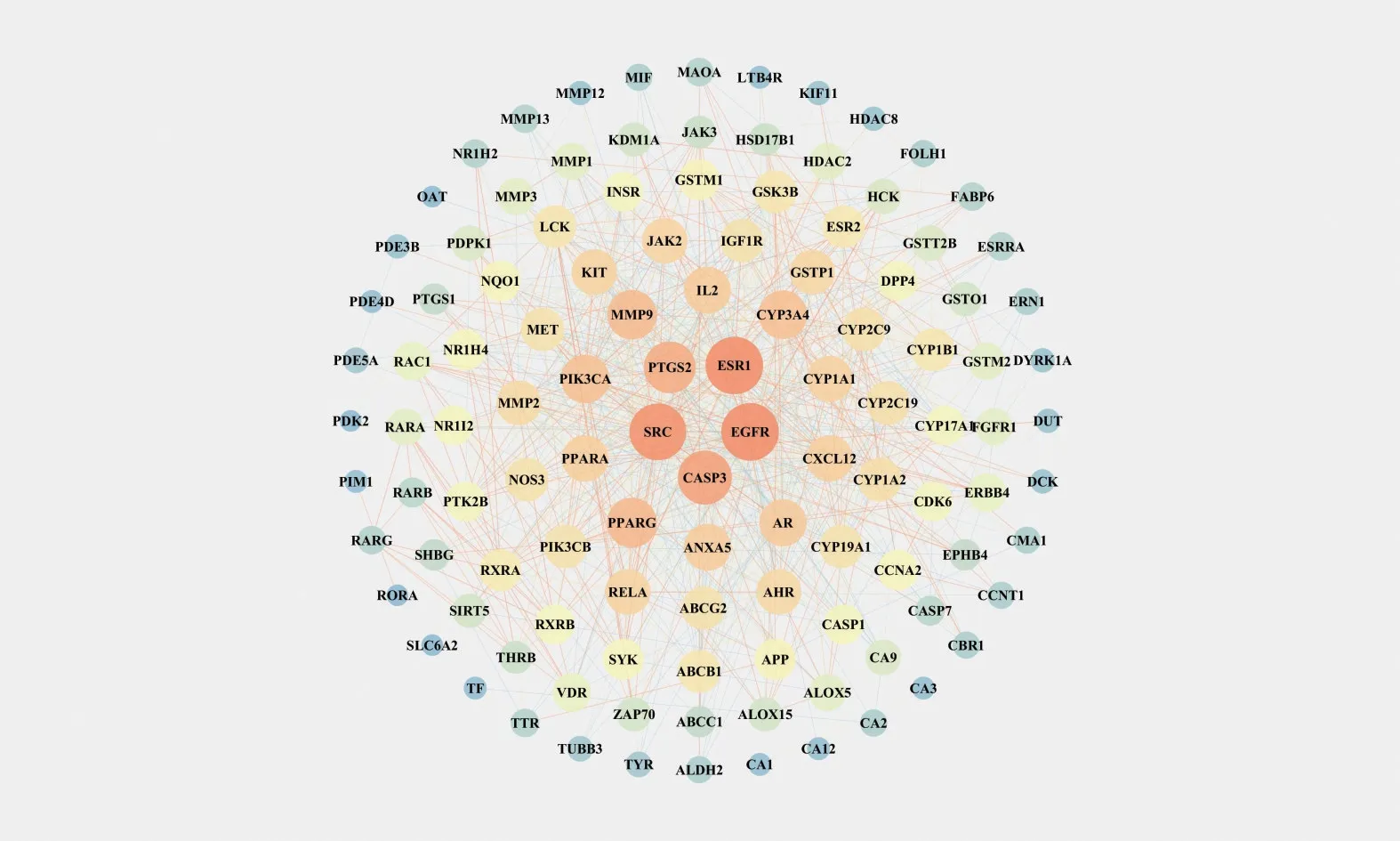
Figure 2 Protein-protein interaction network in OSCC treatment by resveratrol图2 白藜芦醇治疗OSCC 的蛋白质-蛋白质相互作用网络
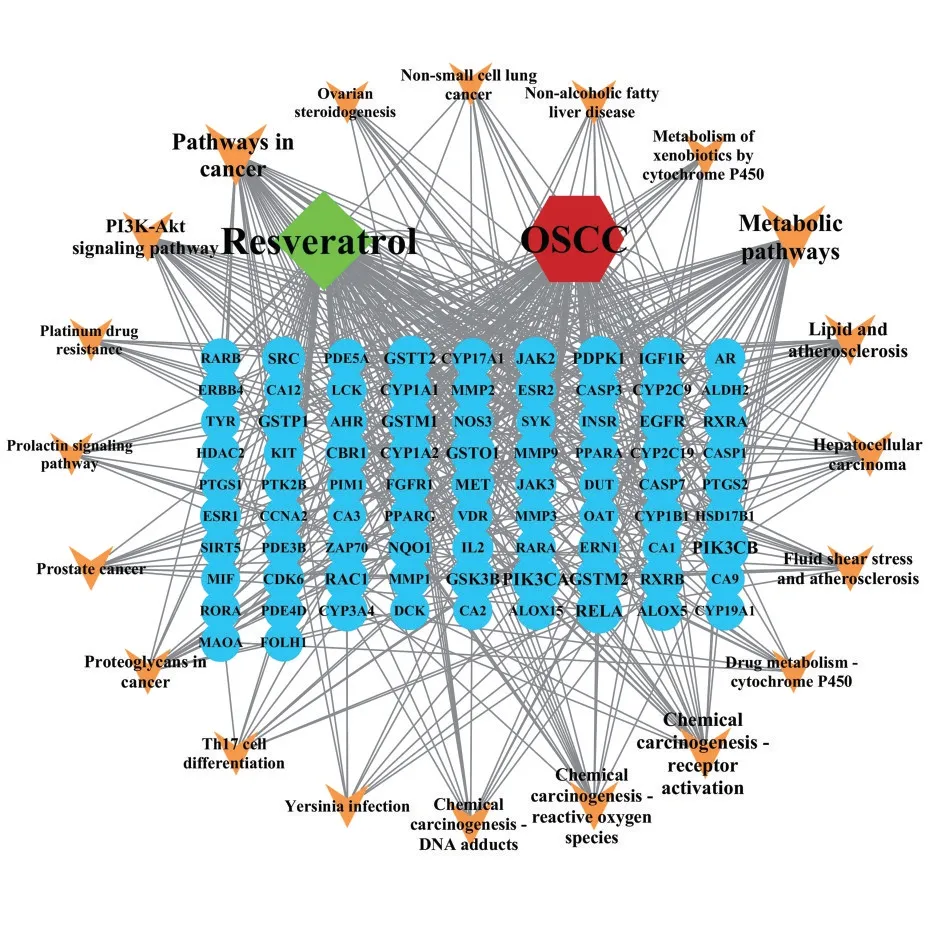
Figure 3 Resveratrol-OSCC-target-pathway network diagram图3 白藜芦醇-OSCC-靶点-通路网络图
其中,BP 相关条目160 个,主要涉及蛋白质自磷酸化、肽基酪氨酸磷酸化、跨膜受体蛋白酪氨酸激酶信号通路、RNA 聚合酶Ⅱ启动子转录的正调控、视黄酸受体信号通路、蛋白质磷酸化等。CC 相关条目22 个,主要涉及细胞质、受体复合体、质膜细胞质侧的外源成分、胞质溶胶、染色质、RNA 聚合酶Ⅱ转录因子复合物等。MF 相关条目68 个,主要涉及RNA 聚合酶Ⅱ转录因子活性,配体激活的序列特异性DNA 结合、跨膜受体蛋白酪氨酸激酶活性、蛋白酪氨酸激酶活性、酶结合、锌离子结合、序列特异性DNA 结合、血红素结合、非跨膜蛋白酪氨酸激酶活性等(表2)。
KEGG 分析得到112 条信号通路(表3),根据P<0.01,筛选出86 条通路,绘制气泡图(图5)。KEGG 分析结果表示白藜芦醇抗OSCC 的相关靶点主要集中在PI3K/AKT 信号通路,脂质、流体剪应力与动脉粥样硬化,化学致癌-DNA 加合物,细胞色素P450 对外源性物质的代谢等有关。
2.5 白藜芦醇对HSC-3 细胞SRC、EGFR、ESR1、p-PI3K、p-AKT 蛋白表达的影响
根据网络药理学和临床样本分析的数据,在核心靶基因中选择排名前3 位的EGFR、ESR1、SRC进行初步验证,进一步探究白藜芦醇对相关靶基因及信号通路的影响。
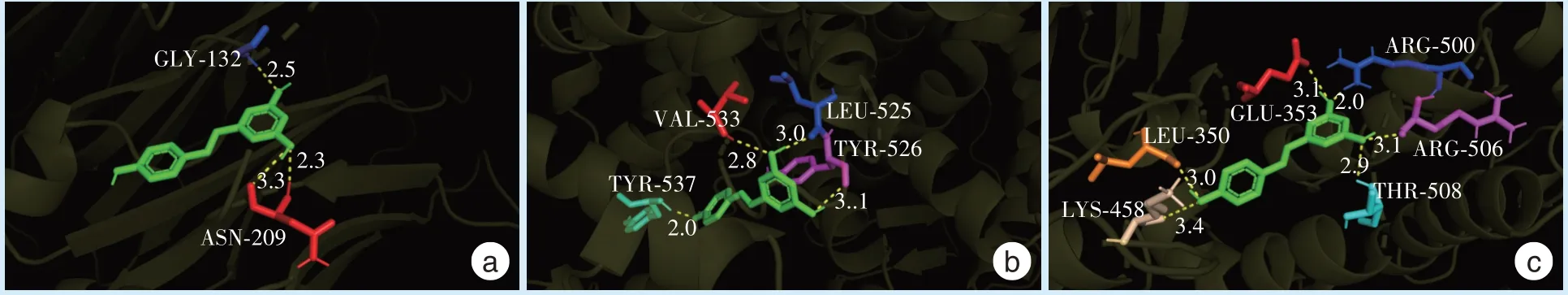
Figure 4 The docking result mode of resveratrol with OSCC core targets including EGFR, ESR1, SRC图4 白藜芦醇与OSCC 核心靶点EGFR、ESR1、SRC 对接结果模式

表2 白藜芦醇治疗OSCC 的潜在靶点GO 富集分析主要结果Table 2 Main results of GO enrichment analysis of potential targets of resveratrol for the OSCC treatment

表3 白藜芦醇治疗OSCC 的潜在靶点KEGG 富集分析信号通路主要结果Table 3 Signal pathway main results of KEGG enrichment analysis of potential targets of resveratrol for OSCC treatment

Figure 5 Signal pathway bubble map of KEGG enrichment analysis of potential targets of resveratrol for OSCC treatment图5 白藜芦醇治疗OSCC 潜在靶点的KEGG 富集分析信号通路汽泡图
根据KEGG 富集分析,PI3K/AKT 通路具有较强的生物学意义,为进一步分子生物学实验验证提供了方向。因此,使用不同浓度(50、100 μmol/L)的白藜芦醇处理HSC-3 细胞,利用Western blot 实验进行初步探究白藜芦醇对靶蛋白EGFR、ESR1、SRC 及其下游PI3K/AKT 信号通路蛋白的影响。Western blot 结果显示,与空白对照组相比,白藜芦醇药物干预抑制了HSC-3 细胞中SRC、EGFR、ESR1、p-PI3K、p-AKT 的活性并以剂量依赖的方式降低了蛋白的表达,差异具有统计学意义(P<0.05)(图6)。

Figure 6 Effect of resveratrol with different concentrations on the protein expression of SRC, EGFR, ESR1,p-PI3K, p-AKT in HSC-3 cells图6 不同浓度白藜芦醇对HSC-3 细胞SRC、EGFR、ESR1、p-PI3K、p-AKT 蛋白表达的影响
3 讨 论
近期研究发现,白藜芦醇不仅能够促进细胞的凋亡、坏死,而且还具有显著的抗肿瘤作用,白藜芦醇可以通过调节Bcl-2、Bax 来激活线粒体通路,使cyt-c 向胞浆内释放激活caspase3,最后诱导OSCC 发生凋亡[5]。白藜芦醇还能通过NF-κB、Sirt1、PI3K 等来抑制癌细胞生长、侵袭和增殖[6]。此外,白藜芦醇还能激活肿瘤微环境中的免疫细胞,如自然杀伤细胞、CD8+淋巴细胞等,增强免疫细胞的活性,引起TNF-α 的释放从而诱导癌细胞的凋亡[7]。而且与其他抗癌药比较,白藜芦醇不仅可以增强癌细胞对放化疗的敏感性,还可以保护正常组织细胞[6]。此外,研究显示白藜芦醇通过调控NF-κB 信号通路、上皮间质转化等途径抑制癌细胞的迁移[9]。白藜芦醇对abc 转运蛋白、谷胱甘肽S 移换酶(glutathione S-transferase,GST)、细胞色素P4503A4 酶(cytochrome P450 3A4,CYP3A4)的活性均有明显的抑制作用[10]。白藜芦醇既具有拓扑异构酶抑制活性,又具有Cu2+依赖的DNA 切割活性,这有助于其DNA 复制、抗肿瘤作用[11],白藜芦醇还能调节Wnt 信号通路的上游介质Sirt1 和转化生长因子β(transforming growth factor-β,TGF-β)来影响Wnt 信号通路,从而达到抗肿瘤作用[12]。
本研究利用网络药理学及分子对接技术,探讨白藜芦醇与OSCC 的作用靶点和机制。经GO 和KEGG 的富集分析表明,白藜芦醇可通过调节PI3K/AKT 信号通路等途径,抵御OSCC 的侵袭。
PI3K/AKT 信号通路在细胞存活、迁移、增殖、分化、蛋白质合成等生理过程中发挥着重要的作用,且参与许多肿瘤的致癌过程。研究显示,PI3K/AKT 信号通路在OSCC 的发病机制中起着重要作用。PI3K 的激活导致磷酯酰肌醇二磷酸(phosphatidylinositol 4, 5-bisphosphate,PIP2)底物被转换为三磷酸磷脂酰肌醇(phosphatidylinositoltriphosphate,PIP3),PIP3 与AKT 的结合,导致AKT 的磷酸化激活;AKT 一旦被异常激活,将会引起细胞的蛋白合成、生长分化、代谢一系列异常反应[13]。PI3K/AKT 通路的高度表达能够诱导OSCC 肿瘤细胞生长[14],为抗癌治疗的靶点[15-16]。多项研究结果显示,PI3K/AKT 信号通路的过度激活存在于OSCC 的发生发展过程中[17-18]。因此抑制PI3K/AKT 信号通路成为控制OSCC 的有效手段[14]。
分子对接结果验证了白藜芦醇能够与EGFR、ESR1、SRC 受体蛋白自发结合,该结果说明了预测的可信性。其中,EGFR 属于Ⅰ型受体酪氨酸激酶家族,是一种跨膜糖蛋白,是人表皮生长因子家族的主要成员之一,广泛参与细胞和机体的生长调控,并且在80%~90%的头颈部肿瘤中高表达[19-21],引起PI3K/AKT 信号传导途径的变化,从而影响到肿瘤细胞的增殖[22]。EGFR 与Erb 家族的其他成员人表皮生长因子受体2、人表皮生长因子受体3 和人表皮生长因子受体4 形成同源或异源二聚体,然后激活其磷酸化和下游信号传导通路,主要涉及RAS/RAF/MEK/ERK 通路和PI3K/AKT/mTOR 通路,这些通路在促进转录激活、有丝分裂、抗凋亡、细胞增殖等方面发挥重要作用[23-24]。白藜芦醇可以抑制EGFR 和c-Met、AKT、ERK1/2 的磷酸化活化[25],因此推测白藜芦醇可通过抑制OSCC 细胞的EGFR 起到治疗效果。
ESR1 是一种配体依赖的转录因子,是雌激素及选择性雌激素受体调节剂生物学效应的主要介导者。ESRl 参与了非基因型效应的膜信号途径,其在乳腺癌中与雌激素结合后,可以快速激活生长因子的下游信号通路,如MAPK/ERK、PI3K/AKT信号通路,从而促进癌细胞的增殖[26]。因此,推测ESR1 作为关键靶点可能在白藜芦醇治疗OSCC 的过程中发挥重要作用。
SRC 是一类能够调控肿瘤细胞多种生物学行为的酪氨酸蛋白激酶,SRC 是Src 家族激酶的核心成员,作为关键介质影响OSCC 的发生发展。SRC已被证实可通过介导基质金属蛋白酶2(matrix metalloproteinase,MMP2)、MMP9、MMP11 等通路降解细胞外基质,促进OSCC 细胞迁移和淋巴结转移[27-28]。SRC 还参与并调节多种与OSCC 血管、淋巴管重建相关的信号通路[29]。因此,推测白藜芦醇可通过抑制OSCC 的SRC 起到治疗效果。
Western blot 结果提示白藜芦醇抑制了HSC-3细胞中SRC、EGFR、ESR1、p-PI3K、p-AKT 的蛋白表达,提示白藜芦醇可通过多靶点、多通路协同发挥抗OSCC 的作用,其中ESR1、SRC、EGFR 可能是其核心治疗靶点,而PI3K/AKT 可能是其主要作用通路。
综上所述,本研究基于网络药理学与实验验证初步揭示了白藜芦醇治疗OSCC 的可能潜在机制,为今后进一步研究提供了参考。
【Author contributions】Chen HJ designed the study, performed the experiments, analyzed the data and wrote the article.Lei Q, Wang ZL,Zhong XW, Qiu Y performed the experiments and analyzed the data.Li LH designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
