电化学脱合金Ti6Al4V 基台对人牙龈成纤维细胞的影响
2024-01-22蔡东轩李毅王岚张燕李广文张玉梅
蔡东轩, 李毅, 王岚, 张燕, 李广文, 张玉梅
1.口颌系统重建与再生全国重点实验室 国家口腔疾病临床医学研究中心陕西省口腔医学重点实验室第四军医大学口腔医院修复科,陕西 西安(710032); 2.西北有色金属研究院,陕西 西安(710016)
钛基材料因其优良的生物相容性和机械性能在口腔种植领域得到了广泛应用[1]。虽然种植体骨结合是发挥支持功能的基础[2],但建立和维持种植体跨黏膜区域的软组织结合(soft tissue integration,STI)对于口腔种植体的长期稳定至关重要[3]。然而传统的Ti6Al4V 基台采取光滑表面,其STI 质量显著低于天然牙,上皮中半桥粒少见且分布范围小;结缔组织中成纤维细胞比例低(3%),胶原纤维组织排列方向单一,仅平行于种植体表面[4]。这些因素导致种植牙的骨组织相较于天然牙更容易受到口腔微生物的入侵,进而引起种植体周围炎,出现种植体周围进行性骨丧失的情况[5]。如何提高传统钛基材料的STI 质量是目前临床上亟待解决的问题。
电化学脱合金是一种以合金各组分间电极电位差为驱动力,通过原位蚀刻进而形成三维网状结构的表面改性技术[6],其形成的孔洞尺寸与脱去合金晶相大小相关,范围从几十纳米到几百微米不等[7]。三维网状结构有助于营养物质的扩散和细胞代谢物的更替,进而强化细胞功能[8],且通过原位蚀刻形成的三维网状结构与原材料基底间无分层[9],形成的三维网状结构具有优良的机械稳定性[10]。研究发现,通过在钛表面构建TiO2纳米网状结构有利于Ca/P 化合物的形成,可将传统的生物惰性钛基材料转换为生物活性材料[11]。碱性条件下,对Al-Ti 合金进行电化学脱合金处理,可在其表面形成有序均一的三维纳米网状结构,能够实现钛基材料生物活性的提高[12],使得增强钛基材料的STI 质量成为可能。
本研究采用电化学脱合金技术处理Ti6Al4V基台材料,在其表面构建适宜的三维纳米网状结构,评估其表面形貌及亲水性等表面理化特性,并基于HGFs 的增殖、黏附等行为,对电化学脱合金技术处理后的Ti6Al4V 生物学性能进行评价,为种植基台表面改性设计提供指导。
1 材料和方法
1.1 主要试剂和仪器
圆形钛合金试样(TC4 型,弘森,中国);脱合金电源装置(TRP6010S,GRALLEN,中国);扫描电镜(S4800,HITACHI,日本);接触角测量仪(DSA25,Kruss,德国);激光共聚焦显微镜(A1R plus,Nikon,日本);荧光酶标仪(Infinite200,Taken,瑞士);实时荧光定量PCR 仪(CFX96,Bio-rad,美国);体式显微镜(M205,Nikon,日本)。人牙龈成纤维细胞(human gingival fibroblasts,HGFs)系(HGF-1,ATCC,美国);CCK-8 试剂盒(Incellgen,美国);含DAPI 封片剂(Beyotime,中国);异硫氰酸荧光素标记鬼笔环肽(MedChemExpress,美国);qRT-PCR 引物(擎科生物,中国);兔抗人vinculin 蛋白单克隆抗体、594山羊抗兔二抗(Proteintech,中国);天狼猩红染色液(LEAGENE,中国)。
1.2 试样处理及实验分组
将钛试样采用砂纸从400~7 000 目依次打磨抛光至光滑镜面,使用丙酮、无水乙醇、去离子水依次超声荡洗15 min 后备用。电化学脱合金处理方法参考文献报道[12]和前期预实验结果。处理时间不足,形成的微纳结构难以覆盖整个试样表面,当试样表面形成均一的三维网状纳米结构后,延长反应时间不会改变其表面结构特征;电解液浓度相差不大时,表面结构特征无明显变化,浓度过高时,表面形成的三维网状纳米结构不均一,最终选择将钛试样在NaOH 溶液中进行阳极氧化处理1 h,电压控制为文献报道[12]的标准反应电压2 V,通过调整NaOH 溶液浓度为1 mol/L 和5 mol/L 形成不同的结构,处理后的试样用蒸馏水和乙醇超声清洗20 min,并在室温下干燥。按照试样不同的表面进行分组:NC 组(阴性对照组,光滑表面无其他处理)、NM-1 组(纳米网-1 组,1 mol/LNaOH 中电化学脱合金处理)、NM-2 组(纳米网-2,5 mol/LNaOH中电化学脱合金处理)。
1.3 试样表面表征观察
采用扫描电镜观察各组试样表面形貌;液滴法在接触角测量仪上测量各组试样表面亲水性,湿度45%条件下,滴加2 μL 去离子水于试样上,拍摄液滴与试样表面接触后5 s 后图像,使用接触角测量仪对图像上的液滴形态进行曲线拟合得到接触角。每组试样任选4 个位点测量。
1.4 细胞培养
采用HGFs 进行细胞实验,使用含10%FBS 和1%青霉素/链霉素的DMEM 培养基进行培养,隔天换液,待细胞融合至80%,胰蛋白酶消化进行细胞接种。钛试样消毒后放置在24 孔板内,细胞悬液按照2×104个/孔的数量进行接种。
1.5 细胞增殖检测
HGFs 在不同试样表面培养1、3、5 d 后将试样转移至新的孔板内,每孔加入含10% CCK-8 的完全培养基1 mL,在孵箱中孵育1 h,将上清液转移至96孔板中,采用酶标仪测定450 nm 波长处的吸光度值。
1.6 细胞黏附观察
HGFs 在 不 同 试 样 表 面 培 养24 h 后,PBS 清 洗3 次,2.5%戊二醛固定过夜,乙醇(30%、50%、70%、90%、95%、100%)梯度脱水,每个梯度脱水15 min。再于六甲基二硅烷胺中浸泡30 min,后置于通风橱干燥,喷金,扫描电镜下观察细胞在各组钛试样表面的黏附形态。
1.7 细胞黏附相关基因检测
HGFs 在不同试样表面培养24 h 后,使用Trizol试剂盒提取总RNA,使用酶标仪测定所分离的总RNA 纯度和数量。将提纯后的RNA 逆转录为cDNA,放入CFX96 Touch Real-Time PCR Detection System 中进行qRT-PCR 反应,以GAPDH 为内参基因,采用2-ΔΔCt法对目的基因的相对表达水平进行定量分析,得到各目的基因差异表达情况,引物信息见表1。

表1 qRT-PCR 引物Table 1 The primers for qRT-PCR
1.8 黏着斑蛋白vinculin 表达检测
HGFs 在不同试样表面培养24 h 后,使用PBS清洗3 次,4%多聚甲醛室温固定30 min,0.3%Triton X-100 透化处理10 min,弃去透化液加入封闭液室温封闭30 min。加入vinculin 一抗,4 ℃孵育过夜,次日换用荧光二抗工作液室温下避光孵育2 h,随后使用含DAPI 的封片剂封片处理后,激光共聚焦显微镜下观察并采集图像,在Image J 软件中进行量化分析。
1.9 天狼猩红染色检测胶原分泌
HGFs 在不同试样表面培养3 d 后,使用PBS 清洗3 次,2.5%戊二醛4 ℃过夜。天狼猩红染色液染色2 h,用0.1 mol/L 的醋酸溶液漂洗3 次,洗去多余染色液,室温下干燥后,体式显微镜下观察着色情况并采集图像。随后将其放入24 孔板中,每孔加入500 μL 0.2 mol/L NaOH 溶液去染,将上清着色液转移至96 孔板中,采用酶标仪测定540 nm 波长处的吸光度值。
1.10 统计学分析
使用SPSS19.0 进行统计学分析,检测各组数据均符合正态性,采用单因素方差分析比较不同组间整体差异,经Levene’s 方差齐性检验,方差齐性者采用Bonferroni 进行两两分析比较,若方差不齐者,采用Tamhane’s T2 进行两两分析比较,检测水准为双侧α=0.05。
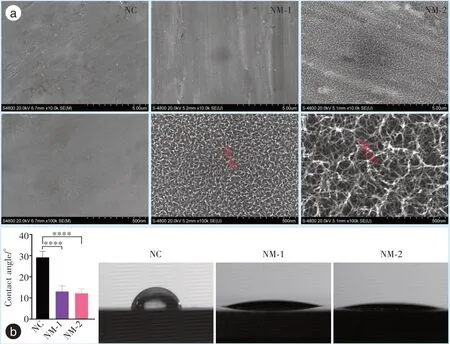
Figure 1 Surface morphologies and static contact angle for samples in different treatment groups图1 不同处理组试样表面形貌和静态接触角
2 结 果
2.1 试样表面表征
扫描电镜观察,低倍镜下NC 组和NM-1 组表面无明显结构特征,可见方向一致的抛光痕迹,NM-2 组可见较为明显的网状结构,高倍镜下NC 表面仍为光滑特征,NM-1 组和NM-2 组表面形成了有序均一的三维网状结构,NM-1 组网格直径约为30 nm,NM-2 组网格直径约为150 nm(图1);接触角测量结果显示NC 组表面水接触角为29.1°±2.8°,NM-1 组和NM-2 组接触角显著下降,为13.0°±2.6°和12.2°±2.1°(P<0.000 1),NM-1 组和NM-2 组间差异无统计学意义(P>0.05)。
2.2 细胞增殖
细胞增殖实验结果显示,随着培养时间的延长,各组试样表面细胞的增殖活力均逐渐增强,1 d时各组间细胞增殖活性无显著性差异,3、5 d 时纳米网状结构表面细胞的增殖活性均有所增强,其中NM-1 组的细胞增殖能力始终优于NC 组(P<0.05),NM-1 组和NM-2 组差异无统计学意义(图2)。
2.3 细胞早期黏附
HGFs 在不同试样表面黏附24 h 后,扫描电镜低倍镜下细胞在各组表面黏附良好,呈现多边形状态,其中在NM-1 组、NM-2 组表面伸展面积较大,形态更为纤长。高倍镜下三组表面均可见细胞伪足,但NC 组细胞伪足粗短且稀少,NM-1 组、NM-2组细胞伪足较NC 组更为发达,细长且密集(图3)。

Figure 2 Proliferation of HGFs adhering to samples in different treatment groups图2 不同处理组试样表面黏附的HGFs 增殖

Figure 3 Early morphology of HGFs adhering to samples in different treatment groups图3 不同处理组试样表面黏附的HGFs 的早期形态
2.4 黏附相关基因表达
HGFs 在不同试样表面培养24 h 后,采用qRTPCR 分析黏着斑复合物必需基因的表达情况,NM-1组中COL1A1、COL3A1、FN1、FAK、VCL 的表达水平显著高于NC 组和NM-2 组(P<0.01),而ITGB1的表达水平与NM-2 组无显著性差异(P>0.05);NM-2 组中ITGB1、FAK 的表达水平比NC 组较高,差异有统计学意义(P<0.01);ITGA2 在3 组间的差异无统计学意义(P>0.05)(图4)。
2.5 黏着斑蛋白vinculin 表达
采用免疫荧光染色对HGFs 中vinculin 蛋白进行分析,绿色荧光表示肌动蛋白标记的细胞骨架,蓝色荧光表示细胞核,红色荧光表示vinculin。24 h时HGFs 在三组表面均铺展得较为充分,vinculin 蛋白在NM-1 组和NM-2 组中丰度更高,NM-1 组可见vinculin 蛋白在细胞伪足边缘大量表达(图5a)。对标记为红色的vinculin 蛋白和黏着斑数量进行量化分析,结果显示,NM-1 组表面HGFs 的vinculin 蛋白丰度最高,与其余两组有显著性差异(P<0.05,图5b);NM-1 组和NM-2 组表面单个HGFs 黏着斑数量高于NC 组,其中NM-1 组单个细胞黏着斑数量最多,差异有统计学意义(P<0.01,图5c)。
2.6 胶原纤维的分泌合成
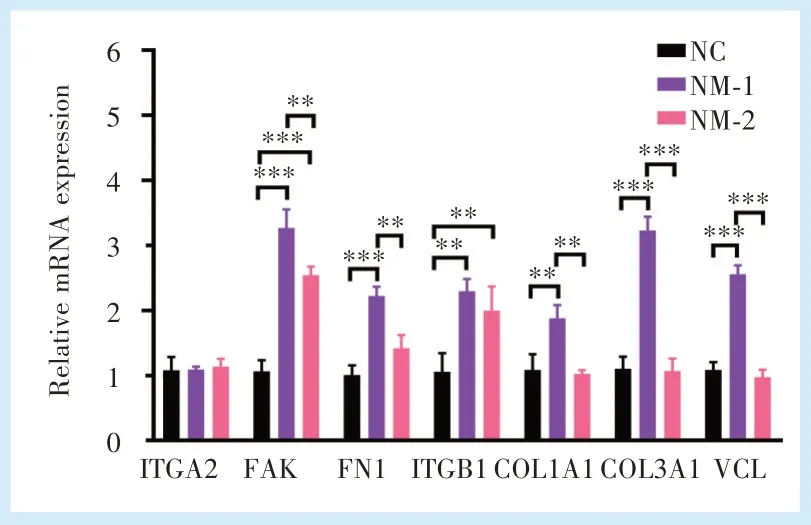
Figure 4 Adhesion-related gene expression of HGFs in samples from different treatment groups图4 不同处理组试样表面HGFs 黏附相关基因的表达情况

Figure 5 Expression of vinculin in HGFs on the surface of samples in different treatment groups图5 不同处理组试样表面HGFs 的vinculin 蛋白表达情况
电化学脱合金处理组的胶原纤维分泌合成量显著高于NC 组(P<0.000 1,图6a),相较于NM-2组和NC 组,NM-1 组的HGFs 可以在试样表面分泌合成更多的胶原纤维。体式显微镜下,NC 组红色染料零星分布在试样表面,NM-2 组染料分布范围较NC 组变大,但未能覆盖整个材料表面,NM-1 组红色染料几乎覆盖整个试样表面(图6b),结合540 nm 波长处的吸光度值统计结果(图6a),说明电化学脱合金处理后的试样可以促进HGFs 分泌合成更多的胶原纤维,其中网格直径较小的NM-1组效果最显著(P<0.000 1)。
3 讨 论
3.1 试样表面表征
相比于纯钛,钛合金具有更强的机械强度,因此目前认为采用Ti6Al4V 的钛合金才能满足应力集中且中空的基台部件的机械强度要求[13]。一般认为,光滑表面能最大限度减小细菌定植,并有利于清洁[14],是目前较为理想的穿龈部分表面设计方式[15]。然而越来越多的研究证实,基台穿龈部分的STI 质量对于对抗细菌侵袭具有更为重要的意义[16],相比牺牲STI 获得容易清洁的表面,良好的STI 是预防种植体周围感染不容忽视的策略[17]。实际上,已有许多研究采用表面修饰活化技术提升穿龈部分的STI,包括采用相转变方法构建的淀粉样蛋白[18]、细胞因子加载[19]等,均可显著提升基台的STI 能力。然而这些化学修饰的“加法”策略与基底结合有限[20],在体内长期服役的过程中会不可避免地发生降解[21]。与之相反,采用“减法”的策略在钛合金表面刻蚀出特定结构则能在提升表面活性的同时具有优异的稳定性[22]。在已有研究中,电化学脱合金技术是在钛合金表面高效、快速刻蚀出纳米多孔网状结构的策略[23],由于其未改变材料基底的结构特性,仅仅在原子级别脱去部分活泼元素,因此所形成的结构本身即为基底材料的一部分,具有极强的基底结合力[24]。本研究通过电化学脱合金技术在Ti6Al4V表面构建出2 种规格的纳米网状形貌,显著提高了其亲水性能,可为后期的生物学实验提供参考。

Figure 6 Secretion and synthesis of collagen fibers in HGFs on the surface of samples in different treatment groups图6 不同处理组试样表面HGFs 的胶原纤维分泌合成情况
3.2 细胞增殖与黏附
通过细胞活力的CCK-8 检测证实,脱合金后的钛合金表面不仅未对HGFs 增殖活性产生抑制作用,在合适尺度内反而促进了HGFs 的增殖。通常而言,钛合金具有极强的稳定性[25],在细胞培养环境下发生元素析出的量非常少,不足以产生细胞效应[26]。因此,虽然脱合金能够去除对细胞增殖不利的Al 元素[27],但细胞增殖能力的提升可能更大程度上来自于表面纳米网状结构的作用。在高等生物体内,细胞黏附与细胞外基质密切相关,层粘连蛋白、纤维连接蛋白以及胶原蛋白等胞外蛋白聚合成纤维,进而搭建出纳米尺度的网状结构作为细胞的黏附位点[28]。相比于光滑表面,脱合金后的钛合金表面所形成的纳米网状结构在物理结构上高度仿生细胞外基质[29],为细胞黏附创造了有利条件。通过扫描电镜观察可见,在纳米网状结构表面,细胞的伸展面积更大,伪足形成更为丰富、细长。这些细胞形态学的变化提示,脱合金形成的纳米网状结构能够显著促进牙龈成纤维细胞的生长、附着和运动,对于稳定的STI 建立具有重要意义。
3.3 细胞黏附分子表达
通过进一步分子生物学检测,对细胞黏附相关分子的表达进行基因水平的广泛筛查,可以看出脱合金处理能够显著促进细胞内黏着斑相关蛋白基因的表达,VCL、ITGB1 基因表达量明显提高,特别是黏着斑激酶FAK 的表达提升最为显著。同时与细胞黏附密切相关、由细胞分泌的细胞外基质蛋白相关基因COL1A1、COL3A1、FN1 的表达量也显著提高。在本研究中,vinculin 免疫荧光结果表明,脱合金处理可以提高钛合金表面HGFs 中vinculin 蛋白表达水平,其表面细胞伪足边缘黏着斑复合物数量相比光滑表面显著提升。而天狼猩红染色的实验结果也表明,脱合金表面HGFs 分泌合成的胶原纤维量显著提高,提示脱合金表面三维网状纳米结构可能通过调控黏着斑复合物的形成,以及细胞外基质蛋白的分泌合成两种途径来促进细胞的黏附。通常人体内蛋白生物大分子的大小约10 nm[30],因此纳米尺度的网状结构有利于细胞外基质蛋白在其空间内的募集,增加细胞在其表面的黏着斑复合物数量,进而促进FAK 和ERK1/2 信 号 通 路 的 激 活[31]。研 究 发 现FAK 的 上调也与其信号通路下游细胞增殖、迁移、分化等多种细胞功能密切相关[32-34],而这正有可能是脱合金表面HGFs 后期胶原纤维分泌合成增加的原因。本实验构建了两种网格直径大小的纳米网状结构,NM-1 组直径约为30 nm,NM-2 组直径约为150 nm,各个实验结果均表明直径较小组的细胞活性强于直径较大组,考虑这与不同网格直径三维网状结构的蛋白吸附能力有差异密切相关。有研究者发现,多孔材料中孔径的大小会显著影响其蛋白吸附水平,孔径小于10 nm 时,孔径的物理大小会成为蛋白吸附的限制因素,孔径大于100 nm 时,蛋白吸附量会随着有效比表面积的减小而降低,当孔径在10~100 nm 时,蛋白吸附水平最佳[35]。
综上所述,本研究成功地通过电化学脱合金的方法在Ti6Al4V 表面构建出两种不同网格直径大小的纳米网状结构,其除了对HGFs 的增殖和黏附有较强的促进作用,还能提高HGFs 胶原纤维分泌合成量,同时也发现网格直径较小的纳米网状结构对HGFs 的刺激作用更为明显,这可为临床上Ti6Al4V 基台表面改性技术提供一种新思路。
【Author contributions】Cai DX performed the experiments, analyzed the data and worte the article.Li Y, Wang L, Zhang Y, Li GW performed the experiments and revised the article.Zhang YM designed the study and revised the article.All authors read and approved the final manuscript as submitted.
