电针对膜迷路积水豚鼠耳蜗V2R、AQP2、ENaC-α表达的影响
2024-01-22蒋丽元叶恬恬杨俊文
蒋丽元,叶恬恬,杨俊文
1.杭州市中医院针灸康复科,浙江杭州 310007;2.浙江中医药大学第一临床医学院,浙江杭州 310053;3.浙江中医药大学第二临床医学院,浙江杭州 310053
美尼尔综合征(Meniere’s disease,MD)是一种特发性的内耳疾病,常单侧起病,表现为低频-中频听力下降、耳鸣、耳闷胀感,阵发性眩晕,严重影响患者生活质量[1]。近年来流行病学调查显示,其发病率为190/100000,男女性发病比例为1.89∶1,发病率随着年龄增长呈逐渐升高趋势[2]。MD 的基本病理改变是内耳膜迷路积水。研究表明,与罹患慢性中耳炎的患者相比,难治性MD 患者血浆的血管加压素(arginine vasopressin,AVP)升高。采用内淋巴囊引流术治疗难治性MD,分别于术后1 周、1 年、2 年期观察MD 患者眩晕及感音神经性耳聋发作情况,并检测患者血浆AVP 水平,发现其眩晕及感音神经性耳聋发作与血浆AVP 水平呈现正相关性[3]。实验研究表明,AVP 是一种9 肽类激素,主要在下丘脑的视上核和室旁核中合成,经由下丘脑-垂体束到达神经垂体后释放入血,AVP 通过与其G 蛋白藕联受体结合发挥生物学作用。AVP 在内耳的作用主要涉及离子通道及水通道机制[4]。血管加压素受体2(vasopressin type 2 receptor, V2R)是G-蛋白偶联受体家族成员之一,其基因突变或表达异常与多种疾病相关,在肾脏疾病的研究较为深入[5]。水通道蛋白2(aquaporin 2,AQP2)是水通道蛋白家族成员中对AVP 敏感的亚型之一[6]。上皮细胞钠通道(epithelial sodium channel,ENaC)主要参与AVP 在内耳中的离子通道调节机制,ENaC 主要由α、β、γ3 个亚单位组成。研究表明,AVP 与V2R 结合后,引起cAMP 表达上调,使ENaC-α 表达及功能增强,促使离子浓度发生变化及水液转运,参与内耳膜迷路积水的发生、发展过程[7-8]。此外,AVP 通过与耳蜗及内淋巴囊中的V2R结合,激活AVP-AQP2系统,使内耳中的AQP2 mRNA 及蛋白表达增加,内淋巴腔内液体增加,发生膜迷路积水。针刺具有改善MD患者眩晕发作的作用,而关于其具体机制未明[9]。本研究通过AVP 腹腔注射建立膜迷路积水豚鼠模型,从耳蜗V2R、AQP2、ENaC-α 蛋白角度探讨针刺调节膜迷路积水豚鼠耳蜗积水程度的潜在机制。
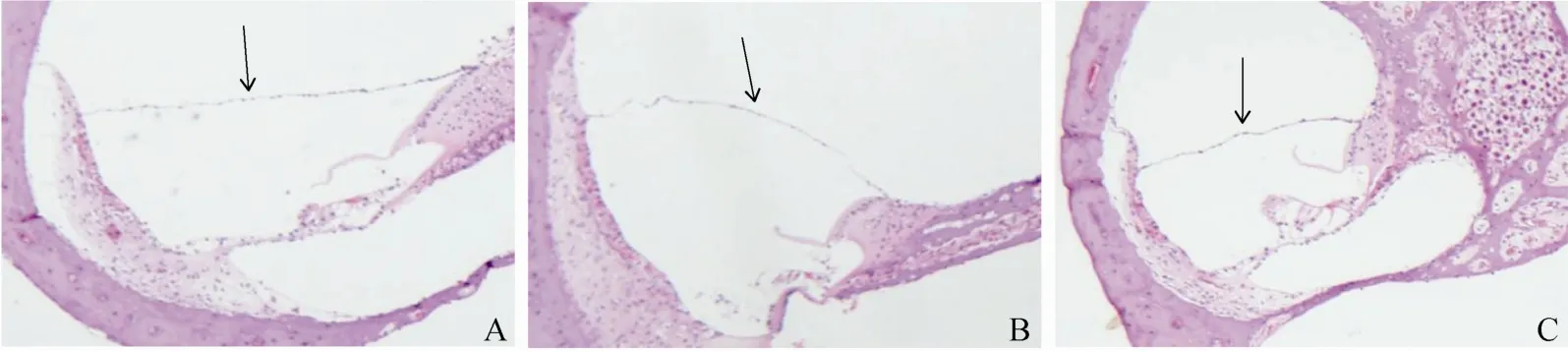
图1 3 组豚鼠耳蜗(HE 染色图片,×40,箭头所示为前庭膜)
1 资料与方法
1.1 实验动物与分组
健康清洁级6 周龄雄性白毛红目豚鼠36 只,体质量为350~400g,购自新昌县大市聚欣健兔场[生产许可证号:SCXK(浙)2013-0060],饲养于浙江中医药大学动物实验研究中心,清洁级动物实验室。饲养环境为恒温[(22±1)℃]、恒湿(65%~70%),每日光照12h,所有豚鼠可自由进食水,适应性饲养3 日后按体质量随机分为正常组、模型组、电针刺组,每组12 只。实验过程中遵循科技部颁布的《关于善待实验动物的指导性意见》。该项目实验过程符合动物保护、动物福利和伦理原则,动物实验伦理由浙江中医药大学动物实验管理与伦理委员会审批通过(伦理审批号:IACUC-20180820-06)。
1.2 主要试剂与仪器
醋酸去氨加压素(deamino arginine vasopressin,DDAVP,批准文号∶20170701,海南中和制药股份有限公司,规格:1ml∶4μg);V2R 抗体(批准文号:ab213708,英国Abcam 公司,规格:100μl);AQP2抗体(批准文号:ab199975,生产单位:英国Abcam公司,规格:10μl);ENaC-α 抗体(批准文号:PA1-920A,美国Thermo Fisher 公司,规格:100μg);GAPDH 抗体(批准文号:ab181602,英国Abcam 公司,规格:100μl);一次性无菌针灸针(0.22mm×13.00mm,北京中研太和医疗器械有限公司);HANS-100A 型韩氏疼痛治疗仪(南京济生医疗科技有限公司)。
1.3 模型制备方法
模型组及电针刺组豚鼠给予醋酸去氨加压素腹腔注射,先按照4μg/kg 给药,每日1 次,连续7 日,第8 日起按照6μg/kg 给药,每日1 次,连续给药3 日,共给药10 日[10]。造模成功以病理切片观察到耳蜗积水为标准[11]。
1.4 干预方法
电针刺组豚鼠以自制的木板与布条结合的固定装置固定,用0.22mm×13.00mm 针灸针直刺左侧“听宫”(位于耳屏前凹陷处)穴3~5mm,平刺“百会”(位于颅顶骨正中央)穴3~5mm,连接HANS-100A 型韩氏疼痛治疗仪,采用连续波100Hz,电针强度1mA,干预时间20min。豚鼠“百会”、“听宫”穴定位参照《实验针灸学》[12]中的描述,采用动物比较学方法定位。正常组、模型组豚鼠装入固定装置中固定20min。每日干预1 次,连续10 日。
1.5 检测指标及方法
1.5.1 苏木精-伊红染色法观察豚鼠耳蜗形态学变化 豚鼠断头处死后,剪取左侧耳蜗组织,将耳蜗周围组织剔除干净,放入4%多聚甲醛溶液中固定,经脱钙,修块后石蜡包埋盒中包埋,于切片机上沿耳蜗蜗轴中央平面切成约4.5μm 的薄片,选取耳蜗最大切面,制作豚鼠耳蜗切片,脱蜡后苏木精-伊红染色(hematoxylin-eosin staining, HE)封片,光学显微镜下观察并测量耳蜗中阶与前庭阶面积。计算耳蜗中阶/(耳蜗中阶+前庭阶面积)的比值R 值,即可判定耳蜗积水程度,R 值越大,积水程度越重,反之越轻[11]。
1.5.2 免疫印迹试验(Western blot,WB)法检测豚鼠耳蜗V2R、AQP2 及ENaC-α 蛋白表达 豚鼠断头处死后,于冰上迅速剥离出左侧耳蜗,加入液氮研磨后放入–80℃冰箱内保存。通过Western blot 法测定耳蜗V2R、AQP2 及ENaC-α 蛋白含量。配制8%~12%分离胶和5%浓缩胶,每个孔60μg 总蛋白进行上样,每孔10~15μl,浓缩胶60V,分离胶80V 进行电泳,转膜,封闭。一抗溶液(V2R 浓度1∶800,AQP2 浓度1∶400,GAPDH 浓度1∶10000)4℃冰箱中过夜孵育;二抗溶液(1∶5000)室温条件下孵育60min。显影液显影,曝光仪中显影曝光,使用Image J软件分析V2R、AQP2及ENaC-α蛋白与内参GAPDH的灰度值,以V2R、AQP2 及ENaC-α 蛋白与内参GAPDH 的灰度值比值作为目标蛋白的相对表达量。
1.6 统计学方法
应用SPSS 20.0 统计学软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,数据符合正态分布,组间比较采用单因素方差分析,进一步两两比较采用LSD 检验法,计数资料以例数(百分率)[n(%)]表示。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般行为学观察
正常组豚鼠精神状态佳,行动步态自如,自活动多,对声音反应灵敏。模型组豚鼠普遍出现精神差,行动迟缓,活动减少,对声音反应迟钝。电针刺组豚鼠精神状况、行动、自发活动与模型组无差别,但对声音反应敏感度与模型组比较,有所改善。
2.2 电针对耳蜗膜迷路积水的影响
正常组耳蜗前庭膜平直无膨隆,无积水。模型组耳蜗前庭膜隆起,出现膜迷路积水。电针刺组前庭膜可见隆起,但膨隆程度较正常组减轻,见图1。
与正常组比较,模型组豚鼠R 值升高(P<0.01),与模型组比较,电针刺组豚鼠R 值下降(P<0.01),见表1。
表1 3 组豚鼠耳蜗R 值、V2R、AQP2、ENaC-α 相对表达量比较(±s , n=6)
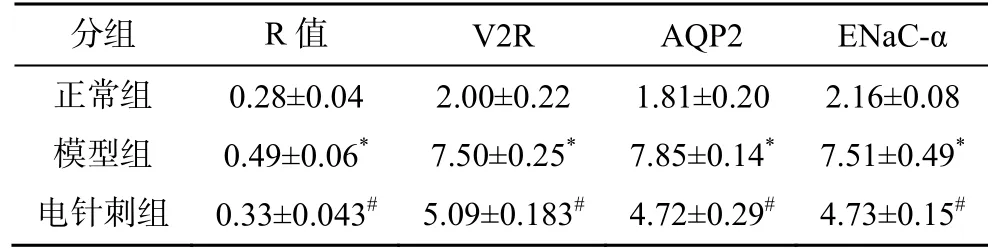
表1 3 组豚鼠耳蜗R 值、V2R、AQP2、ENaC-α 相对表达量比较(±s , n=6)
注:与正常组比较,*P<0.01;与模型组比较,#P<0.01
分组 R 值 V2R AQP2 ENaC-α正常组 0.28±0.04 2.00±0.22 1.81±0.20 2.16±0.08模型组 0.49±0.06* 7.50±0.25* 7.85±0.14* 7.51±0.49*电针刺组 0.33±0.043# 5.09±0.183# 4.72±0.29# 4.73±0.15#
2.3 电针对膜迷路积水模型豚鼠耳蜗V2R蛋白表达的影响
与正常组比较,模型组耳蜗V2R 蛋白表达明显升高(P<0.01);与模型组比较,电针刺组V2R 蛋白表达量降低(P<0.01),见表1、图2。

图2 3 组豚鼠耳蜗V2R、AQP2、ENaC-α 蛋白表达的比较(WB 法)
2.4 电针对膜迷路积水模型豚鼠耳蜗AQP2 蛋白表达的影响
与正常组比较,模型组耳蜗AQP2 蛋白表达明显升高(P<0.01);与模型组比较,电针刺组AQP2蛋白表达量降低(P<0.01),见表1、图2。
2.5 电针对膜迷路积水模型豚鼠耳蜗ENaC-α 蛋白表达的影响
与正常组比较,模型组耳蜗ENaC-α 蛋白表达明显升高(P<0.01);与模型组比较,电针刺组ENaC-α蛋白表达量降低(P<0.01),见表1、图2。
3 讨论
从中医学来看,针刺耳周及头部穴位可治疗耳部疾病有相关理论支撑。听宫穴首次提出在经典古籍《灵枢》中“刺其听宫,中其眸子,声闻于耳,此其输也”。听宫别名多所闻穴、多闻穴,是手太阳小肠经腧穴,围绕耳前,亦为手足少阳、手太阳交会穴,刺之能通窍活络聪耳窍。《胜玉歌》:“头痛眩晕百会好。”《针灸大成》亦描述百会主治,云:“头痛目眩,食无味,百病皆治。”在文献统计的治疗MD 常用腧穴中,百会穴使用频率最高[13]。百会配伍听宫是治疗内耳眩晕的常用组穴。针刺两穴,有助于调整耳内微循环,改善水液代谢功能而止眩晕,并恢复听觉[14]。本研究结果显示,电针刺“百会”“听宫”穴能显著减轻膜迷路积水模型豚鼠的耳蜗积水程度,与课题组前期研究结果一致[15]。本研究中,电针频率采用的100Hz,其依据主要基于课题组前期的研究工作基础。笔者所在课题组前期研究工作中采用假电针及不同频率电针(2Hz、15Hz、100Hz)干预膜迷路积水,结果显示,假电针及2Hz、15Hz、100Hz 电针均有良好的治疗作用。各治疗组间比较,100Hz 电针疗效最佳,作为前期工作的延续,故选用100Hz 作为电针干预频率。
本实验运用AVP 腹腔注射诱导膜迷路积水豚鼠模型,AVP 腹腔注射后通过AVP-V2R-水/离子蛋白信号通路引起耳蜗膜迷路内淋巴液增多,造成膜迷路积水[16]。本研究中与正常组豚鼠相比,膜迷路积水豚鼠耳蜗积水程度增加,耳蜗V2R、AQP2 及ENaC-α 蛋白表达升高,与文献报道结果一致,与MD 膜迷路积水病理改变相符,说明AVP 成功复制了MD 病理特征,是较为理想的MD 膜迷路积水模型[7,17]。本研究中,与模型组相比,电针刺组R 值下降,与既往研究结果一致,与模型组相比,电针刺组耳蜗V2R、AQP2 及ENaC-α 蛋白表达降低,说明电针通过调节耳蜗水与离子蛋白表达参与了MD 膜迷路积水的治疗[18-20]。
研究表明,AVP 通过与V2R 受体结合,激活其下游AQP2,调控水液代谢平衡。V2R 基因缺失或表达水平下降与尿崩症发生密切相关。过表达则有可能发生抗利尿激素分泌失调综合征[5]。受启发于肾脏病的研究,研究者在接受内淋巴管阻塞手术的MD患者内耳内淋巴囊中检测到了V2R、AQP2 的表达,并通过动物实验证实了AVP-V2R-AQP2 信号通路参与了内耳水液代谢的调节,与内耳膜迷路积水的发生、发展密切相关[21-23]。ENaC-α 通道主要位于上皮细胞,是允许Na+流过,维持盐和水体内平衡的重要离子通道蛋白。多种体液因子如肾素-血管紧张素-醛固酮系统、表皮生长因子、AVP 均对ENaC-α 蛋白表达有调控作用[24]。在多种情况下,肾素-血管紧张素-醛固酮系统与AVP 系统被相同的刺激共同激活,在多个水平上相互影响,参与ENaC-α 的表达调控,实现水液代谢调节作用[24-25]。肾脏的研究中,AVP 对AQP2 及ENaC-α 表达调控亦存在交互作用。即AVP 与V2R 结合后,通过调控AQP2 的表达使肾脏集合管对水的重吸收增加,尿渗透压增加,尿流量减少,尿液浓缩AVP 又可以激活ENaC-α 的表达。AVP 对ENaC-α 的刺激通过促进尿浓度在水稳态中起着重要作用[24]。文献中少见AVP-V2R-水/离子蛋白信号通路在人体肾以外器官水液代谢失衡性疾病中的研究。本实验中,与正常组比较,膜迷路积水模型组豚鼠耳蜗V2R、AQP2 及ENaC-α 蛋白表达上调,说明其参与了内耳膜迷路积水的发生过程。电针刺后引起V2R、AQP2 及ENaC-α 蛋白表达下调,说明降低耳蜗V2R、AQP2 及ENaC-α 蛋白表达可能是电针调节膜迷路积水模型豚鼠耳蜗积水程度的潜在机制。
综上所述,电针刺可改善膜迷路积水豚鼠耳蜗积水程度,其机制可能与下调耳蜗V2R、AQP2 及ENaC-α 蛋白表达有关,本研究结果为该法的临床运用提供了实验支持,但电针刺降低耳蜗V2R、AQP2及ENaC-α 蛋白表达的相关环节还有待进一步研究,AVP-V2R-AQP2/ENaC-α 信号通路将是其切入点之一。
