NLRP3信号通路在胰腺癌发生发展中的作用机制研究进展
2024-01-21郑立平沈亦钰胡春东陈徐艰费发明王兢
郑立平,沈亦钰,胡春东,陈徐艰,费发明,王兢
嘉兴市第二医院 肝胆外科,浙江 嘉兴 314000
NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)依据蛋白质的结构与功能划分为N端热蛋白结构域(pyrin domain,PYD)、中间的NACHT结构域(NOD)和C 端富含亮氨酸的重复结构域(leucine-rich repeat,LRR)3个部分。PYD可与凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)末端PYD区域结合,形成NLRP3-ASC复合物,从而诱导ASC的Caspase募集结构域(caspase recruitment domain,CARD)招募天光氨酸激酶-1前体(pro-Caspase-1),进而形成NLRP3-ASCCaspase-1多蛋白复合体,即NLRP3炎症小体(NLRP3 inflammasome)。NOD属于腺苷三磷酸酶(NTPase)超家族成员,其通过Walker区域结合并水解ATP释放能量,对下游蛋白发挥重要调控作用[1]。LRR具有正电性,可通过离子能与无丝分裂基因A相关蛋白激酶7(never in mitosis gene A related kinase 7,NEK7)形成NEK7-NLRP3复合物,易被泛素化而处于自身抑制状态。见图1。
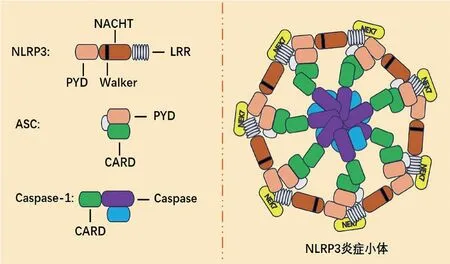
图1 NLRP3、ASC、Caspase-1及NLRP3炎症小体结构示意图
NLRP3炎症小体的活化,能促使Pro-Caspase-1发生水解,产生具有酶活性的Caspase-1,从而促进IL-1β、IL-18的成熟与释放,参与调控炎症反应和细胞凋亡等过程[2]。近年来,研究显示NLRP3 信号通路与乳腺癌、结直肠癌、肝癌及胰腺癌等多种肿瘤的发生发展密切相关[3-4]。其中,胰腺癌是一种发病隐匿、高度侵袭性的恶性肿瘤,早期诊断困难,临床预后较差,其发病机制仍不十分明确。本文通过对胰腺癌中NLRP3信号通路的研究进行综述,可以加深对胰腺癌发生机制的了解,为该疾病的诊断和治疗提供新的思路。同时,进一步探究胰腺癌中相关信号通路的表达及其意义,有助于揭示胰腺癌的发展过程和预后评估的新指标。
NLRP3信号通路的调控主要分为两个阶段,即NLRP3炎症小体的启动和NLRP3炎症小体的活化[5]。NLRP3炎症小体的启动是指通过Toll样受体4(Tolllike receptor 4,TLR4)/核转录因子kappa B(nuclear factor kappa-B,NF-κB)通路上调NLRP3、pro-IL-1β和pro-IL-18的mRNA过程,为NLRP3炎症小体形成、IL-1β和IL-18的成熟与释放提供物质准备。NLRP3炎症小体的活化是指在损伤相关模式分子(damageassociated molecular patterns,DAMPs)或病原体相关模式分子(pathogen-associated molecular patterns,PAMPs)等激动剂的刺激下,组装NLRP3炎症小体、活化Caspase-1的过程,最终介导IL-1β和IL-18的成熟、释放和细胞焦亡。IL-1β的大量释放,进一步促进胰腺癌细胞上皮-间质转化(epithelial-mesenchymal transition,EMT),诱导胰腺癌细胞的迁移、侵袭[6]。IL-18作用于靶基因基质金属蛋白酶3(MMP-3)/基质金属蛋白酶9(MMP-9)/原癌基因(c-myc)/细胞周期蛋白D1(cyclin-D1),诱导胰腺癌细胞的增殖和侵袭[7]。见图2。

图2 NLRP3信号通路启动/抑制以及活化/抑制示意图
1 NLRP3炎症小体在胰腺癌中的启动调控与启动抑制机制
1.1 NLRP3炎症小体在胰腺癌中的启动调控机制
在PAMPs如脂多糖(lipopolysaccharide,LPS)的刺激下,TLR4 与胞内髓样分化分子2(myeloid differentiation factor 2,MD2)形成TLR4-MD2-LPS二聚体复合物[8],通过髓样分化因子88(myeloid differentiation factor 88,MyD88)激活IL-1受体相关激酶(IL-1 receptor associated kinase 1,IRAK1)/肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,TRAF6)通路,促使NF-κB抑制剂(inhibitor of NF-κB,IκB)在IκB激酶(IKKs)的作用下发生磷酸化,释放NF-κB并易位入核,启动转录过程。Youn等[9]研究显示,TLR4的表达仅在胰腺癌细胞中检测到,在正常胰腺细胞中未检测到,且高表达TLR4的胰腺癌细胞的迁移被选择性TLR4抑制剂以剂量依赖的方式减少。杨静等[10]在胰腺癌患者循环肿瘤细胞中检测到TLR4、MyD88 的大量表达。Yin等[11]通过皮下小鼠胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)模型研究发现,LPS通过TLR4/MyD88/NF-κB通路重塑肿瘤微环境(tumor microenvironment,TME),并与细胞程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)检查点阻断协同作用。
1.2 NLRP3炎症小体在胰腺癌中的启动抑制机制
TLR4/NF-κB通路是NLRP3炎症小体的启动关键,因此阻断其中任何一个环节都将抑制其信号转导。三棱内脂(sparstolonin)是一种异香豆素化合物,作为TLR4 的选择性拮抗剂,通过NF-κB信号通路抑制胰腺癌细胞的增殖、转移和侵袭[12]。ST2825是MyD88的特异性小分子抑制剂,通过抑制MyD88的二聚化进而抑制NF-κB通路,诱导胰腺癌G2/M期细胞的阻滞和凋亡[13]。肿瘤坏死因子α(TNF-α)诱导蛋白3(TNFAIP3),也称为A20,是一种泛素编辑酶,能显著抑制TNF-α上调的NF-κB信号转导,从而降低胰腺癌细胞的增殖能力[14]。青藤碱(sinomenine)是一种生物碱单体,亦能通过抑制TNF-α上调的NF-κB信号通路,抑制胰腺癌细胞的增殖并诱导其凋亡[15]。IKKs抑制剂Bay 11-7082,通过抑制IκB磷酸化从而阻断NF-κB入核,能有效抑制人胰腺癌细胞株SW 1990增殖,诱导细胞发生凋亡[16]。细胞因子诱导杀伤(cytokine-induced killer,CIK)细胞,兼具NK细胞和细胞毒性T细胞特征,不仅可以直接杀伤胰腺癌细胞,而且还可恢复免疫受损胰腺细胞的免疫应答[7]。
2 NLRP3炎症小体在胰腺癌中的活化调控与活化抑制机制
2.1 NLRP3炎症小体在胰腺癌中的活化调控机制
目前,研究较多的NLRP3 炎症小体活化途径主要包括高尔基体解体、内质网线粒体结构偶联(endoplasmic reticulum-mitochondria contacts,ERMC)异常、跨膜离子流动(K+外流、Ca+内流、Cl-外流、Na+内流)、溶酶体损伤和Caspase-4/5/11非经典炎性小体活化等。
2.1.1 高尔基体解体 激动剂引发高尔基体反面网状结构(trans-Golgi network,TGN)解体,形成分散的小型囊泡状结构(dispered TGN,dTGN),随后dTGN膜上富集的负电性磷脂酰肌醇-4-磷酸激酶(phosphatidylinositol-4-phosphate,PtdIns4P)通过离子能招募并激活细胞质中无活性的NLRP3,进而诱导ASC寡聚化、NLRP3炎症小体活化[17]。
2.1.2 ERMC异常 ERMC是连接内质网和线粒体的动态结构,基本成分包括位于内质网或线粒体外膜上的Ca2+通道、各种分子伴侣蛋白、蛋白激酶等。ERMC应激可促进内质网内Ca2+转移至线粒体内,引起线粒体钙超载,生成大量活性氧(reactive oxygen species,ROS)并促进线粒体内心磷脂(cardiolipin)和线粒体DNA(mtDNA)的释放,进而诱导NLRP3炎症小体的活化[18]。研究证实,在胰腺癌患者中,ROS水平显著升高,其介导的DNA损伤和各种炎性细胞因子的异常释放,促进了胰腺癌细胞的发生和恶性转化,从而促进癌细胞的存活和肿瘤的进展[19]。此外,在RNA病毒的激动下,ERMC还能招募线粒体抗病毒信号蛋白(mitochondrial antiviral-signaling protein,MAVS),而MAVS与NLRP3的N末端氨基酸序列连接,促进NLRP3炎症小体活化[20]。
2.1.3 跨膜离子流动 胞内K+外流被普遍认为是绝大多数激动剂活化NLRP3炎症小体的共同途径。在胞外ATP的激动下,细胞膜上的ATP-配体门控离子通道P2X7受体(P2X7R)与K+双孔洞通道(TWIK2)共同调控胞内K+外流,从而活化NLRP3炎症小体[21]。P2X7R已被证实在胰腺癌中高表达,并调节胰腺癌细胞的增殖、侵袭和转移[22]。此外,穿孔素可以直接在细胞膜上形成小孔,促使K+外流,进而激活NLRP3 炎症小体。NLRP3 炎症小体的活化还可能依赖于Ca2+流动。内质网是胞内Ca2+的主要储存器,Ca2+通过膜通道肌醇1,4,5-三磷酸受体(IP3R)释放至胞质中,直接激活NLRP3 炎症小体[23]。然而,也有研究显示Ca2+流动是Caspase-1 的下游事件,不是NLRP3炎症小体活化的必要条件[24]。胞内Cl-通道蛋白(chloride intracellular channel proteins,CLICs)定位于胞质内和细胞器上,ROS可诱导CLICs移位至胞膜并形成离子通道引发Cl-外流,进而诱导ASC寡聚化、NLRP3炎症小体活化,这一过程依赖ROS[25]。阳离子-氯离子联合转运蛋白(cation chloride cotransporter,CCC)是一组转运Na+、K+、Cl-进出细胞的膜蛋白,除了调控胞内K+、Cl-外流外,还影响胞外Na+内流[26]。
2.1.4 溶酶体损伤 在各种微粒或晶体类激动剂的刺激下,溶酶体发生破裂,导致其内组织蛋白酶(cathepsin)释放至胞质中,同时伴有Ca2+内流和K+外流,进而激活NLRP3炎症小体[27]。组织蛋白酶B(CTSB)已被证实在胰腺癌组织中高度表达,并在其发生、生长、血管生成及侵袭转移中起到关键作用[28]。
2.1.5 Caspase-4/5/11 非经典炎性小体活化Caspase-4/5/11 是LPS胞内受体,主要通过诱导细胞焦亡介导机体固有免疫应答。在LPS的激动下,Caspase-4/5/11与LPS形成复合物并寡聚化,诱导Caspase-4/5/11 非经典炎性小体活化。活化的Caspase-4/5/11 非经典炎性小体可对肖皮素D(gasdermin D,GSDMD)进行剪切,产生GSDMD的N端结构,GSDMD-N寡聚化后插入细胞膜中形成小孔,引发细胞焦亡[29]。此外,活化的Caspase-4/5/11非经典炎性小体还可促使NLRP3炎症小体的组装与活化,进一步诱导细胞焦亡和IL-1β、IL-18的成熟与释放[30]。在TNF-α刺激Panc-1 细胞系的实验中,证实GSDMD与Caspase-4的基因表达量明显上调,并释放大量炎症因子IL-1β和IL-18[31]。
研究显示,胰腺癌组织中NLRP3、ASC、Caspase-1及IL-1β的表达明显高于癌旁正常组织,且与临床分期、淋巴结状态及预后密切相关[14,32]。同时,IL-1β还可介导肿瘤微环境中的免疫抑制,这种免疫抑制可能是通过促进耐受性T淋巴细胞分化来驱动的[33]。郭兴军等[7]研究显示,IL-18在胰腺癌组织中的表达量明显高于癌旁正常组织,且与临床分期、分化程度及预后密切相关。同样,Kandikattu等[34]研究显示,IL-18介导的嗜酸性粒细胞增多能促进胰腺恶性肿瘤的特征。
2.2 NLRP3炎症小体在胰腺癌中的活化抑制机制
Nimbolide是一种源自印楝树花和叶子的三萜化合物,可以沉默超氧化物歧化酶2(superoxide dismutase 2,SOD2)诱导高水平的ROS生成,导致细胞凋亡增加,降低胰腺癌细胞的增殖和转移[35]。MCC950是一种特异性NLRP3拮抗剂,通过靶向结合NOD上的Walker区域,使其构象发生改变,从而抑制NLRP3 活性,进而降低胰腺癌细胞的活力[36]。3,4-亚甲二氧基-β-硝基苯乙烯(MNS)亦是一种特异性NLRP3抑制剂,通过结合NOD和LRR区域而阻断NLRP3的激活,能有效抑制胰腺癌细胞的增殖和迁移[37]。近来研究显示,P2X7R有望成为胰腺癌的潜在治疗靶点[38]。其中,大黄素(emodin)是一种天然蒽醌衍生物,作为P2X7R拮抗剂,通过抑制P2X7/NLRP3信号通路,减轻ATP诱导的急性胰腺炎胰管细胞损伤,在预防和治疗胰腺癌方面可能具有一定的价值[39]。需要指出的是,P2X7R抑制剂在胰腺癌临床治疗中的作用是双向的[38]。因此,P2X7R靶向药物在胰腺癌临床治疗中的作用有待进一步探讨。
3 小结与展望
研究表明,TLR4、MyD88、NF-κB、NLRP3、ASC、Caspase-1、IL-1β/IL-18等分子在胰腺癌的发生和发展过程中起到了重要的作用,并与肿瘤的病理特征和预后密切相关。这些研究结果为胰腺癌的治疗和预测提供了新的思路和方法。但目前的研究还存在不足之处。首先,虽然诸多研究对各个分子在胰腺癌中的表达及临床意义进行了总结和分析,但还需要进一步验证和完善这些分子的功能和临床应用价值;其次,相关信号通路的表达对胰腺癌的发展具有重要意义,但由于其作用机制复杂又多样,需要进一步深入研究,以改善我们对此机制的理解;最后,一些NLRP3信号通路抑制剂虽然在体外和体内的模型中表现出良好的有效性,但是仍处于临床试验阶段,安全性有待进一步验证。因此,未来的研究应该基于这些问题进行更深入的探索,以进一步理解胰腺癌的发病机制,最终达到寻找治疗靶点和改善患者预后的目的。
