粉煤灰基NaA/NaX双晶型沸石分子筛构建及其协同吸附氨氮性能
2024-01-20蔡元韬郭欣辰卢莹怡张慧琦韩熠垚谢云龙叶向荣
蔡元韬 王 坤 郭欣辰 卢莹怡 张慧琦 韩熠垚 谢云龙*,,2 叶向荣*,,2
(1浙江师范大学行知学院,化学与材料科学学院,金华 321004)
(2浙江光电子研究院,金华 321004)
0 引 言
随着我国社会经济高速发展,越来越多含氨氮的生活污水和工业废水排入湖泊和河流中,造成大面积的水体污染[1]。氨氮污染成为急需解决的环境问题,研究污水中含氮污染物的处理具有重要意义和应用价值。
粉煤灰是煤燃烧后的烟气中收集下来的细灰,目前是我国排量最大的工业固体废弃物之一和最大的单一固体污染源[2],对生态环境和人体健康造成了严重危害[3,4]。现阶段粉煤灰已被广泛应用于水泥、混凝土、陶瓷、玻璃、土壤调理回填材料、合成沸石和介孔材料等的开发与生产[5-9]。
以廉价的固体废料粉煤灰制备沸石分子筛,不仅实现粉煤灰的资源化利用,而且制得的沸石分子筛能够有效去除水中污染物。粉煤灰制备沸石分子筛常见方法有传统水热法、碱熔水热法[10]、微波辅助合成[11]和超声辅助水热法[12]等,所构建的沸石分子筛包括硅铝比1∶1 的立方晶系结构NaA 型[13]、骨架硅铝比1.4∶1 的六方晶系结构NaX 型[14]以及NaA/NaX双晶型等。NaA/NaX 双晶型沸石分子筛具备更加丰富的晶型结构、孔隙结构和更好的离子交换能力,对金属离子污染物有较好的吸附性[15],但对氨氮的吸附性能研究较少,且常见的混合晶型构建方法耗时较长,成本较高[16]。
本工作以粉煤灰为原料,废旧玻璃为外加硅源,在传统碱熔水热法[17]基础上,设计了耗时短、成本低的“联合改性三步合成法”,构建出硅铝比为1.27∶1的NaA/NaX 双晶型沸石分子筛,系统表征了所构建分子筛的组成、结构和形貌,并对其氨氮吸附性能和相应的吸附热力学、动力学进行了研究探索。
1 材料与方法
1.1 实验材料
粉煤灰样品和废旧玻璃为市售,均破碎后过200 目筛,由表1 和图1 可知,粉煤灰主要矿物相为莫来石[2](PDF No.79-1453),由Si、Al、Ca 和Fe 等元素的氧化物组成;废旧玻璃主要矿物相为石英[18](PDF No.85-1053),SiO2含量达71.91%。氢氧化钠(AR)购自天津市科密欧化学试剂有限公司,氯化铵(AR)购自浙江汉诺化工科技有限公司,酒石酸钾钠(AR)购自中国上海试剂一厂,磷酸二氢钠(AR)、盐酸(37%)和纳氏试剂购自国药集团化学试剂有限公司,二次蒸馏水为自制。

图1 (a)粉煤灰和废旧玻璃的XRD图;(b)粉煤灰、(c)废旧玻璃的SEM图Fig.1 (a)XRD patterns of fly ash and waste glass;SEM images of(b)fly ash and(c)waste glass

表1 粉煤灰和废旧玻璃的化学组分Table 1 Chemical composition of mass fly ash and waste glass
1.2 粉煤灰合成沸石分子筛
1.2.1 粉煤灰的预处理
将原粉煤灰破碎过200 目筛,在750 ℃下煅烧3 h后与6 mol·L-1HCl溶液以5∶1的液固质量比混合,然后在70 ℃下加热搅拌2 h 后过滤、洗涤、干燥、磁吸除铁即得到预处理后的粉煤灰。
1.2.2 GFS沸石分子筛制备
GFS 沸石分子筛通过“联合改性三步合成法”——废旧玻璃碴/13X 型分子筛晶种/NaH2PO4浸渍三阶段联合超声辅助碱熔微波晶化法合成。将4 g 预处理后粉煤灰与NaOH、废旧玻璃碴按1∶1.4∶0.25 的质量比均匀混合、研磨后放入马弗炉,600 ℃高温煅烧1.5 h后取出;加入蒸馏水调至固液质量比为1∶8,并加入0.1 g 13X 沸石分子筛作为晶种,在超声清洗器(型号UC-2H、100 W)辅助下老化1.5 h得到分子筛前驱体;将老化后的前驱体转移至微波消解仪(上海屹尧WX-6000、2 450 MHz)中,105 ℃下微波晶化3 h 后,在2 g·L-1NaH2PO4溶液中浸渍30 min,用去离子水洗涤3 次,放入60 ℃烘箱中烘干得到GFS沸石分子筛。
1.2.3 对比样FS沸石分子筛制备
FS 沸石分子筛通过传统碱熔水热法合成。将4 g 预处理后粉煤灰与NaOH 按1∶1.4 的质量比均匀混合、研磨后放入马弗炉,600 ℃高温煅烧1.5 h后取出,加入蒸馏水调至固液质量比为1∶8,常温静置老化1.5 h,并转移至水热反应釜中于105 ℃烘箱中水热晶化3 h。自然冷却至室温。并用去离子水洗涤3次,然后,60 ℃烘箱中烘干得到FS沸石分子筛。
1.2.4 对比样WFS沸石分子筛制备
WFS 沸石分子筛通过“三步合成法”——超声辅助碱熔微波晶化法合成。将4 g 预处理后粉煤灰与NaOH 按1∶1.4的质量比均匀混合、研磨后放入马弗炉,600 ℃高温煅烧1.5 h后取出后,加蒸馏水调至固液质量比为1∶8,在超声清洗器(型号UC-2H、100 W)辅助下老化1.5 h得到分子筛前驱体;将老化后的前驱体转移至微波消解仪(上海屹尧WX-6000、2 450 MHz)中,105 ℃下微波晶化3 h,自然冷却至室温。并用去离子水洗涤3 次,然后在60 ℃烘箱中烘干后得到WFS沸石分子筛。
1.3 样品表征
采用美国ThermoFisher ARL ADVANT′X 4200型X射线荧光光谱仪对原料粉煤灰和废旧玻璃进行化学成分的测定,工作电压为60 kV,工作电流100 mA。采用德国Bruker D8 Advance 型X 射线粉末衍射仪分析了材料的物相组成,辐射源为CuKα,波长为0.154 06 nm,扫描范围为5°~60°,扫描速率为12(°)·min-1,工作电压40 kV,工作电流40 mA。采用德国蔡司GeminiSEM300 扫描电子显微镜对沸石分子筛进行表面形貌的观察,扫描加速电压5 kV,分辨率3 nm。采用AZtecOne X-MaxN 50 型X 射线能谱仪(EDS)对沸石分子筛材料表面的主要元素进行成分分析,加速电压为15 kV。采用NEXUS670型傅里叶红外光谱仪分析沸石分子筛的化学成分变化,光谱范围4 000~400 cm-1。采用BSD-PS(M)型比表面分析仪测定材料N2吸附-脱附等温线并计算Brunauer-Emmett-Teller比表面积(SBET)和孔径大小。
1.4 NH4+吸附实验
控制反应体系温度为25 ℃、pH为6,将50 mg合成沸石分子筛,加入至50 mL一定浓度NH4+溶液中,在恒温水浴锅中搅拌吸附,达到吸附平衡后,取上层清液,过0.45µm 滤膜,采用纳氏试剂分光光度法测定NH4+浓度,计算NH4+去除率R(%)和吸附量qe(mg·g-1)。
式中,R为氨氮去除率,qe(mg·g-1)为平衡时氨氮吸附量,ρ0(mg·L-1)为吸附前的氨氮质量浓度,ρe(mg·L-1)为平衡时的氨氮质量浓度,V(L)为铵溶液的体积,m(g)为改性沸石分子筛的质量。
2 结果与讨论
2.1 沸石分子筛的形貌表征
图2 为FS、WFS 和GFS 沸石分子筛的SEM 图。由图2a1、2b1和2c1可知,沸石分子筛的颗粒大小为FS(2.7µm)>WFS(2.2µm)>GFS(1.5µm),通过传统碱熔水热法制备的FS 沸石分子筛呈现规整的立方体结构;通过超声辅助碱熔微波方法制备的WFS 沸石分子筛在立方体结构各个表面长出四面体,晶粒结构发生改变;通过三阶段联合改性制备的GFS 沸石分子筛进一步长成八面体结构,且单个结晶体粒径有所减小。由图2a2、2b2 和2c2 对比可知,FS 的大部分立方体晶粒相互堆叠程度大;WFS 和GFS 的各个晶粒堆叠程度小,分散均匀,证明在超声和微波在老化、晶化过程中各个晶粒分散性更强且均匀生长,堆叠程度减小。

图2 (a)FS、(b)WFS、(c)GFS沸石分子筛的SEM图Fig.2 SEM images of(a)FS,(b)WFS and(c)GFS zeolite
FS、WFS 和GFS 沸石分子筛的各元素含量由EDS 测得,详见表2,可知FS 沸石分子筛硅铝比为1.11∶1,接近NaA 型沸石分子筛硅铝比(1∶1),故采用传统碱熔水热法制备的FS为NaA型沸石分子筛;在不改变硅铝比(1.11∶1)的条件下采用超声辅助微波碱熔法制备的WFS 含有NaX 型分子筛,在该制备条件下采用低硅铝比也能制备出一部分NaX 型分子筛;GFS 沸石分子筛在废旧玻璃和13X 晶种的引入下,硅铝比上调至1.27∶1,有利于更多NaX型分子筛的生成。

表2 FS、WFS和GFS沸石分子筛各元素比例Table 2 Element proportions of FS,WFS and GFS zeolite
为了进一步验证FS、WFS 和GFS 沸石分子筛的晶型结构,采用XRD 对这几种样品进行了表征,结果如图3 所示。由图可知FS 沸石分子筛在2θ=7.18°、10.16°、12.46°、16.11°、21.66°、23.98°、27.84°和29.94°出现了明显衍射峰,分别对应于NaA 型分子筛的(200)、(220)、(222)、(420)、(442)、(622)、(642)和(820)晶面,与NaA 型分子筛[19](PDF No.43-0142)一致。WFS 和GFS 沸石分子筛在2θ=6.10°、9.97°、11.73°、15.45°、23.34°、26.68°和30.97°也出现了衍射峰,分别对应于NaX 型分子筛的(111)、(220)、(311)、(331)、(533)、(642)和(751)晶面[20](PDF No.38-2037),表明WFS 和GFS 沸石分子筛同时具备NaA 型分子筛和NaX 型分子筛的晶型,说明超声辅助碱熔微波晶化法通过超声和微波的方法改进制备的分子筛晶型发生改变,使制得的WFS 和GFS 沸石分子筛晶型从NaA 型分子筛向NaX 型分子筛过渡,最终形成了NaA/NaX 双晶型沸石分子筛。此外,GFS 沸石分子筛中NaX 型分子筛的衍射峰强度增加,说明掺杂废旧玻璃和引入13X 型晶种的能够进一步提高硅铝比,引入目标晶型,促使更多的NaX晶型形成。

图3 FS、WFS和GFS沸石分子筛的XRD图Fig.3 XRD patterns of FS,WFS and GFS zeolite
图4 为FS、WFS 和GFS 沸石分子筛的FTIR 对比图谱。其中光谱区在3 400~3 500 cm-1之间的峰归属于吸附水的羟基伸缩振动峰,1 650 cm-1左右归属于吸附水的O—H 弯曲振动吸收峰。在400~1 000 cm-1之间出现的吸收峰主要是Si—O 和Al—O振动所引起的。通过改性前FS 与改性后WFS 和GFS 对比,可知在951、741、538、449 cm-1处发生偏移,在741 cm-1产生新峰,这可能是NaX 型沸石分子筛的形成使不同峰兼并叠加,从而导致谱带位置发生偏移[21]。其中WFS 和GFS 红外谱峰无明显差异,说明三阶段联合改性对沸石分子筛基团种类影响较小。

图4 FS、WFS和GFS沸石分子筛的红外光谱对比图Fig.4 FTIR spectra of FS,WFS and GFS zeolite
为了研究FS、WFS 和GFS 沸石分子筛的孔径分布,采用N2吸附-脱附测试进行了分析。由图5 可知,FS、WFS 和GFS 沸石分子筛在1.5 nm 以下和3~4.5 nm 均有孔径分布,说明3 种沸石分子筛均为微介孔分子筛,WFS 和GFS 沸石分子筛1.5 nm 和3~4.5 nm 孔面积均明显大于FS 沸石分子筛,证明采用超声辅助碱熔微波晶化法制备沸石分子筛,使沸石分子筛的微介孔结构得以丰富。3 种分子筛的等温线均为Ⅳ型等温线,且有典型的介孔结构材料滞后环,表明3 种分子筛中均存在介孔结构[22]。由等温曲线可知,在较高的相对压力区没有出现吸附极限,表明3种分子筛中均存在微孔。

图5 FS、WFS和GFS沸石分子筛孔径分布对比图Fig.5 Pore size distribution curves of FS,WFS and GFS zeolite
N2吸附-脱附测试结果如表3所示,WFS分子筛的比表面积(361 m2·g-1)比FS 分子筛的比表面积(15 m2·g-1)增加了23 倍,表明通过超声辅助碱熔微波晶化法改进实验,使得沸石分子筛比表面积大幅增加,这与SEM 的结果一致。而3 种分子筛的孔容和平均孔径大小依次为GFS>WFS>FS,说明采用联合改性三步合成法制备的GFS 沸石分子筛的孔容最大,孔径得以丰富。结合XRD 测试结果可知,NaX型分子筛占比增加,又因为NaA 型分子筛粒径小于NaX型分子筛,所以改性后材料的孔容和孔径增大。

表3 FS、WFS和GFS沸石分子筛的比表面积、孔容和平均孔径值Table 3 Specific surface area,pore volume and average pore width values of FS,WFS and GFS zeolite
2.2 吸附等温线
吸附等温线可以用来描述吸附剂与溶液中溶质之间的吸附平衡关系,了解吸附剂对溶质的吸附能力、吸附速率、吸附容量等性质[23]。为了研究FS、WFS 和GFS 的吸附能力,分别在质量浓度为4、10、20、40、60、80、100、200、400 mg·L-1的50 mL 氨氮溶液中加入50 mg 沸石分子筛吸附剂,控制反应体系温度为25 ℃、pH 为6。在恒温水浴锅搅拌吸附平衡后(1 h)取样过0.45µm膜,用紫外分光光度计测定剩余NH4+的吸光度。并采用Langmuir(式3)、Freundlich(式4)和Sips(式5)等温线模型得到了平衡吸附等温线。3 种沸石分子筛氨氮吸附等温线参数和吸附等温线见表4 和图6a~6c。Langmuir 模型相关系数(R2>0.97)大于Sips isotherm 模型相关系数(R2>0.94),也大于Freundlich 模型相关系数(R2<0.94),故本实验吸附更符合Langmuir 模型,同时3 种沸石分子筛由Langmuir 等温线得到的最大吸附量与实验测得的吸附量基本一致,说明这3 种分子筛吸附氨氮是单层吸附,吸附的活性位点均匀分布,且吸附位点与氨氮一一对应。通过方法改进和物质改性使沸石分子筛氨氮吸附性能分别提高23.70%和40.91%,其中,GFS 分子筛的1/n值最大,不均一性最为显著,证明通过方法改进和物质改性能够改善分子筛不均一性,从而大大提高了沸石分子筛氨氮吸附性能。

图6 (a)FS等温线拟合;(b)WFS等温线拟合;(c)GFS等温线拟合;三种沸石分子筛的(d)Langmuir吸附等温线、(e)Freundlich吸附等温线、(f)Sips吸附等温线Fig.6 Isotherm fitting of(a)FS,(b)WFS and(c)GFS;(d)Langmuir adsorption isotherms,(e)Freundlich adsorption isotherms,(f)Sips isotherms of three zeolite

表4 FS、WFS和GFS分子筛氨氮吸附等温线参数Table 4 FS,WFS and GFS zeolite ammonia nitrogen adsorption isotherm parameters
式中,qe(mg·g-1)为平衡时氨氮吸附量,ρe(mg·L-1)为平衡时的氨氮浓度,KL为Langmuir 吸附系数,KF为Freundlich吸附系数,KS为Sips吸附系数,n是与吸附强度相关的经验参数。
2.3 吸附动力学研究
为了考察反应体系的吸附速率,在温度为25 ℃、pH 为6的条件下,将50 mg合成沸石分子筛加入到50 mL NH4+溶液(40 mg·L-1)中进行吸附动力学实验,并采用准一级动力学模型(式6)、准二级动力学模型(式7)和粒子内扩散模型(式8)拟合沸石分子筛吸附氨氮的数据。吸附动力曲线拟合参数见表5,动力学曲线见图7。由表5 和图7a 可知,3种沸石分子筛对初始浓度为40 mg·L-1氨氮溶液进行吸附,均在20 min 左右达到平衡,吸附速率较快,同时易得在此氨氮溶液浓度下吸附量大小依次为GFS、WFS、FS。

图7 FS、WFS和GFS沸石分子筛吸附氨氮的(a)动力学吸附曲线、(b)一级动力学模拟、(c)二级动力学模拟、(d)粒子内扩散模拟Fig.7 (a)Kinetic adsorption curve,(b)first order model,(c)second order model,(d)intra-particle diffusion of adsorption of ammonia nitrogen by FS,WFS and GFS zeolite

表5 氨氮吸附动力学曲线拟合参数Table 5 Fitting parameters of ammonia nitrogen adsorption kinetic curve
式中,k1为准一级动力学模型中的吸附速率常数,k2为准二级动力学模型中的吸附速率常数,kp为颗粒内扩散模型中的吸附速率常数。
为了进一步研究吸附动力学机理,通过吸附动力学公式对3 种沸石分子筛进行准一级动力学、准二级动力学和粒子内扩散模型拟合。对照表5和图7b~7d可知,准二级方程的相关系数(R2>0.99)高于粒子内扩散方程的相关系数(R2>0.25),也高于准一级方程的相关系数(R2<0.16)。同时由表5 得准二级动力学拟合出的qe,cal和实验测得的qe,exp更为接近,因此准二级方程能更好的反映这3种沸石分子筛对氨氮的吸附特性,表明NaA 型沸石分子筛和NaA/NaX双晶型沸石分子筛对氨氮吸附过程更符合准二级动力学[24-25],且3种材料的氨氮去除能力与CEC的趋势(GFS>WFS>FS)一致,表明3 种沸石分子筛吸附氨氮过程均是以离子交换为主的吸附。沸石分子筛氨氮吸附机理见图8,沸石分子筛通过自身Na+与氨氮废水中的NH4+进行交换,从而达到吸附废水氨氮的目的。

图8 沸石分子筛吸附氨氮机理示意图Fig.8 Mechanism schematic diagram of zeolite adsorption of ammonia nitrogen
2.4 吸附热力学研究
为了探究温度对GFS 沸石分子筛吸附性能的影响,通过式9~11 计算得热力学参数焓变(ΔH⊖)、熵变(ΔS⊖)和吉布斯自由能变(ΔG⊖)。热力学参数和3个温度下等温线拟合见表6 和图9。由表6 可知在278.15、298.15 和318.15 K 时,计算得到的ΔG⊖分别为-12.799、-12.521 和-12.455 kJ·mol-1。ΔG⊖均为负值,表明GFS 沸石分子筛吸附NH4+能够自发进行,ΔG⊖随温度的升高而升高,证明低温促进氨氮吸附,高温抑制氨氮吸附[26]。ΔH⊖(-14.98 kJ·mol-1)小于零,表明GFS沸石分子筛吸附NH4+是放热反应[27]。ΔS⊖(-8.26 J·mol-1·K-1)小于零表明,表明GFS沸石分子筛吸附NH4+过程中混乱度降低[28]。
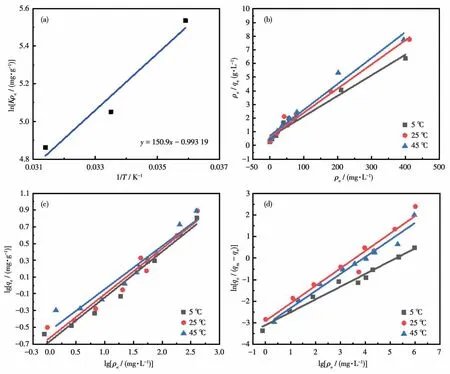
图9 (a)ln(Kρe)与1/T关系图;不同温度下GFS分子筛氨氮吸附等温线:(b)Langmuir吸附;(c)Freundlich吸附;(d)Sips吸附Fig.9 (a)ln(Kρe)and 1/T relationship diagram;(b)Langmuir adsorption isotherms,(c)Freundlich adsorption isotherms,(d)Sips isotherms of GFS zeolite at different temperatures

表6 GFS分子筛氨氮吸附的热力学参数Table 6 Ammonia nitrogen adsorption thermodynamic parameters of GFS zeolite
式中,K为吸附经验平衡常数,T为绝对温度;R=8.314 J·mol-1·K-1,为理想气体常数。
2.5 吸附材料性能对比
表7 是本文中的GFS 沸石分子筛与其他参考文献的氨氮吸附效果对比,可以看出,本研究方法合成的NaA/NaX 双晶型沸石分子筛吸附量最大。且与传统合成方法相比,本研究方法具有合成周期短,方法简便,原料低廉易得等特点,同时具备“废物利用”和“以废制废”的理念,具有较好的应用前景。

表7 不同沸石分子筛的氨氮吸附效果Table 7 Ammonia nitrogen adsorption effect of different zeolite molecular sieves
3 结 论
以价格低廉、大量存在的固体废弃物粉煤灰为原料,通过新型的“联合改性三步合成法”——超声辅助碱熔微波晶化法联合废旧玻璃碴/13X 型分子筛晶种/NaH2PO4浸渍三阶段改性,成功制备出比表面积为295 m2·g-1、平均孔径为2.71 nm 的微介孔的NaA/NaX双晶型GFS沸石分子筛。通过与传统碱熔水热法和未联合改性的“三步合成法”所制备的FS和WFS 沸石分子筛进行形貌结构和氨氮吸附性能对比,GFS 沸石分子筛显示出较大的比表面积和优异的氨氮废水处理性能。吸附结果表明,GFS 沸石分子筛对NH4+的吸附动力学和热力学数据与二级吸附动力学模型和Langmuir 模型高度吻合,表明NH4+在该沸石分子筛的吸附过程为以离子交换为主的吸附,且为自发放热过程,低温利于吸附。本研究制备的沸石分子筛最大氨氮吸附量为56.01 mg·g-1,高于其他方法制备的沸石分子筛氨氮吸附量,且本研究方法合成周期远远小于其他制备方法。以上结果表明,本研究方法制备的沸石分子筛具有原料低廉环保、制备周期短、吸附效果优良的优点,有望推广为处理氨氮废水的优良吸附剂。
