数据挖掘联合网络药理学探讨苦木抗肿瘤活性研究及验证
2024-01-20刘亚群张振霞黄琼露杨培奎陈良辉王俊利郑玉忠
刘亚群,张振霞,黄琼露,杨培奎,陈良辉,王俊利,郑玉忠,⋆
(1.韩山师范学院 生命科学与食品工程学院,广东 潮州 521041; 2.右江民族医学院 临床医学院,广西 百色 533000)
癌症已经成为严重威胁全球健康的主要公共卫生问题之一,其发病率和死亡率呈逐年持续上升趋势,防控形势严峻.目前,化疗是临床治疗肿瘤的常见并有效的方法,已有大量抗肿瘤化疗药物被批准上市,然而化疗药物伴随着毒副作用、靶标选择性差和肿瘤多药耐药性等问题[1].众所周知,中药因具有整体观念、药物毒副作用较小等优势,未来在抗肿瘤制剂的发展前景非常广阔[2].但是中药抗肿瘤已呈现出扎堆开发态势,规范性和可操作性问题已凸显,同时中药成分杂靶点多,传统逐一靶点验证研究方式过于繁琐,无法全面性地探索药物机制[3].网络药理学以其多成分-多靶点-多通路的新理念,为中药抗肿瘤系统研究提供了新思路,为临床治疗及新药开发提供了参考[4].
苦木(Picrasma quassioides)是苦木科(Simaroubaceae)苦木属(Picrasma)植物,产于我国黄河流域以南各地.其以干燥枝和叶入药,性寒,味苦,小毒.具有清热,祛湿,消炎等功效,临床上主治感冒、上呼吸道感染、急性扁桃体炎、肠炎、细菌性痢疾等炎症疾病[5].苦木的现代药理研究多聚焦于抗菌抗炎[6-7],本研究利用数据挖掘和网络药理学技术对苦木进行了成分检索、靶点预测、通路和疾病聚焦,推测苦木可能参与子宫癌、肺癌和食道癌的靶点或信号通路,并利用人宫颈癌细胞株C33A、人食道癌细胞株ECA-109和人非小细胞肺癌A549进行体外实验验证,以期为苦木抑制肿瘤细胞增殖作用机制研究及新药研发提供理论依据与科学思路.
1 材料
1.1 药物与试剂
材料:苦木片购置于(四川平原)永康中药批发养生堂,经清洗晾干后粉碎备用.人宫颈癌细胞株C33A 购自上海钰博生物科技有限公司,人食道癌细胞株ECA-109 购自宏伟药业公司,人非小细胞肺癌A549 购自明舟生物科技有限公司.试剂:噻唑蓝(Methylthiazolyldiphenyl-tetrazolium bromide)购自北京索莱宝科技有限公司,二甲基亚砜(Dimethyl sulfoxide,DMSO),无水乙醇,磷酸二氢钾,氯化钠和氯化钾购自西陇化工股份有限公司,胎牛血清FBS 和PRMI1640 培养基购自上海素尔生物科技有限公司,胰蛋白酶购自上海蓝科技发展有限公司,青霉素和链霉素购自山东鲁抗医药股份有限公司,十二水合磷酸氢二钠购自LifeScience Products&Services,碳酸氢钠购自上海虹光化工厂.
1.2 仪器
真空冻干机(FDU-2110,EYELA),荧光显微镜(IX2-ILL30,Olympus),酶联免疫检测仪(CMax Plus,Molecular),恒温培养箱(Heraeus 311,广东丹利科技有限公司),超声提取器(AS 系列,天津奥特塞斯仪器有限公司),旋转蒸发仪(N-1100,Tokyo Rikakikai Co.Ltd).
2 方法
2.1 苦木化学成分库建立及活性成分筛选
通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://old.tcmsp-e.com/tcmsp.php),中药整合药理学研究平台(Integrative Pharmacology-based Research Platform of Traditional Chinese Medicine,TCMIP,http://www.tcmip.cn/TCMIP/index.php/Home/Login/login.html)以及大量文献检索建立苦木化学成分库.进一步以口服生物利用度(Oral bioavailability,OB)≥30%和药物相似性(Drug likeness,DL)≥0.18 为标准来进行活性成分的筛选.同时在Swiss ADME 数据库(http://www.swissadme.ch/)中以胃肠道吸收Giabsorption 为High,并符合类药性评估规则的六个指标五倍率法则Lipinski、Ghose、Veber、Egan、Muegge和生物利用度预测值Bioavailability Score≥0.55为指标进一步进行活性成分在线代谢预测.
2.2 苦木活性成分潜在作用靶点预测
在PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载苦木活性成分所对应的SMILE(Simplified Molecular Input Line Entryspecification)格式化学式,将相应化学式导入Swiss Target Prediction(http://www.swisstargetprediction.ch/)平台,设置属性为“Homo Sapiens”,进行活性成分的潜在作用靶点预测.
2.3 苦木活性成分潜在作用靶点PPI网络图构建
将苦木潜在作用靶点导入STRING 数据库(https://cn.string-db.org/),选择最低互作阈值Minimum required interaction score 为Highest confidence 0.900,去除游离节点,其余设置均为默认,得到蛋白互作PPI (protein-protein interaction) 网络图.将蛋白互作网络导入Cytoscape 3.8.0 软件(https://cytoscape.org/)进行拓扑分析,利用Cytohubba 插件中的Degree 算法筛选出得分前15 的蛋白作为中心Hub蛋白.
2.4 GO功能和KEGG通路富集分析
将苦木潜在作用靶点导入Metascape 数据库(http://metascape.org/),设置属性为“Homo Sapiens”,选择Enrichment Analysis 进行基因本体论(Gene Ontology,GO)中分子功能Molecular Functions(GO-MF)、生物过程Biological Processes(GO-BP)、细胞成分Cellular Components(GO-CC)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析.
2.5 构建“苦木-靶标-疾病”网络图
将苦木潜在作用靶点导入比较毒性基因组学数据库(Comparative Toxicogenomics Database,CTD,http://ctdbase.org/)进行疾病分析,将得到的靶标基因和对应的预测疾病导入Cytoscape 3.8.0 软件构建“苦木-靶标-疾病”网络图,利用NetworkAnalyzer插件对网络进行拓扑性质分析.再将获得的靶点导入KEGG数据库,在通路水平上全面揭示苦木的作用机制.
2.6 苦木靶标KEGG通路图及癌细胞中表征预测
将靶点导入KEGG 数据库(https://www.genome.jp/kegg/),利用KEGG Mapper 分析工具查询苦木靶标信号通路.同时在CBPortal 癌症基因组数据库(https://www.cbioportal.org/)和人类蛋白图谱(https://www.proteinatlas.org/)数据库中对苦木靶标表达情况进行预测表征.
2.7 苦木提取物的制备
用中药粉碎机将清洗干燥后的苦木片进行粉碎,过筛,得到苦木粉末,准确称取粉末25 g,量取65%的乙醇溶液200 mL,以料液比1∶8(g/mL)的比例配制提取体系.用超声提取器震荡提取1 h后进行真空抽滤.滤液使用旋转蒸发仪浓缩后经真空冻干8 h,得到待用药品.准确称取40 mg 药品溶于1 mL DMSO,即母液浓度为40 000 μg/mL,保存待用.
2.8 细胞培养
细胞复苏后观察其生长状态,每两天换液一次,待长至约八成满弃去培养液,取适量PBS缓冲液润洗,加少量酶液(覆盖细胞瓶表面即可)酶解,显微镜下观察至细胞收缩,细胞间间隙增大,弃去酶液.加适量培养基,对细胞进行轻轻吹打,混匀.将悬液分装至新的细胞瓶,补足培养液(血清培养基比例=1∶9).细胞培养瓶置于细胞恒温培养箱,37 ℃、5% CO2,静置培养.
2.9 MTT法检测细胞的增殖抑制率
癌细胞接种:癌细胞制成单细胞悬液,吸取适量悬液使用血球计数板计数并计算细胞浓度,使用PRMI1640 细胞培养基调整浓度至5×104个/mL,每孔100 μL 接种于96 孔板上,PRMI164 细胞培养基作为空白对照,37 ℃、5% CO2,静置培养24 h.待细胞贴壁后弃去孔内培养基,取苦木醇提药物母液进行梯度稀释,按照设计孔位加入浓度梯度的药物,每孔100 μL设6个复孔.使药物梯度终浓度为400 μg/mL,200 μg/mL,100 μg/mL,50 μg/mL,25 μg/mL,静置培养24 h 后避光向各孔中加入20 μL MTT,避光孵育4 h,弃去溶液并加入DMSO 将结晶完全溶解后,在酶联免疫检测仪OD492处测量各孔的吸光值,并以药物浓度为横坐标、抑制率值为纵坐标,绘制生长抑制曲线.存活率=(苦木片醇提物处理组OD492-空白组OD492)/(溶液对照组OD492-空白组OD492)×100%.抑制率=1-存活率.采用SPSS 26.0统计软件进行结果分析,所有统计数据均表示为三个独立实验的均数±标准差(xˉ±s).
3 结果
3.1 苦木靶点预测及网络构建
3.1.1 苦木化学成分库构建和有效药用活性成分筛选
通过大量文献查阅与各中药成分数据库平台检索构建苦木的化学成分库检索,结果显示苦木主要化学成分为生物碱类和苦味素类,共有7 种不同提取方法和53 种化学成分[5,8-12](表1),且成分类型和检测方法无明显关系,而与提取溶剂有关,苦木脂溶性生物碱类和苦味素类主要由醇回流方式提取,而水溶性生物碱类和苦味素类报道甚少,所以本研究后续验证实验采用醇提取液.同时结合OB,DL 以及生物利用度等条件筛选预测到苦木中有效药用成分为4-甲氧基-5-羟基铁屎米酮、4,5-二甲氧基-铁屎米酮、1-乙基-4,8-二甲氧基-β-咔巴啉、铁屎米-6-酮和苦木内酯G.
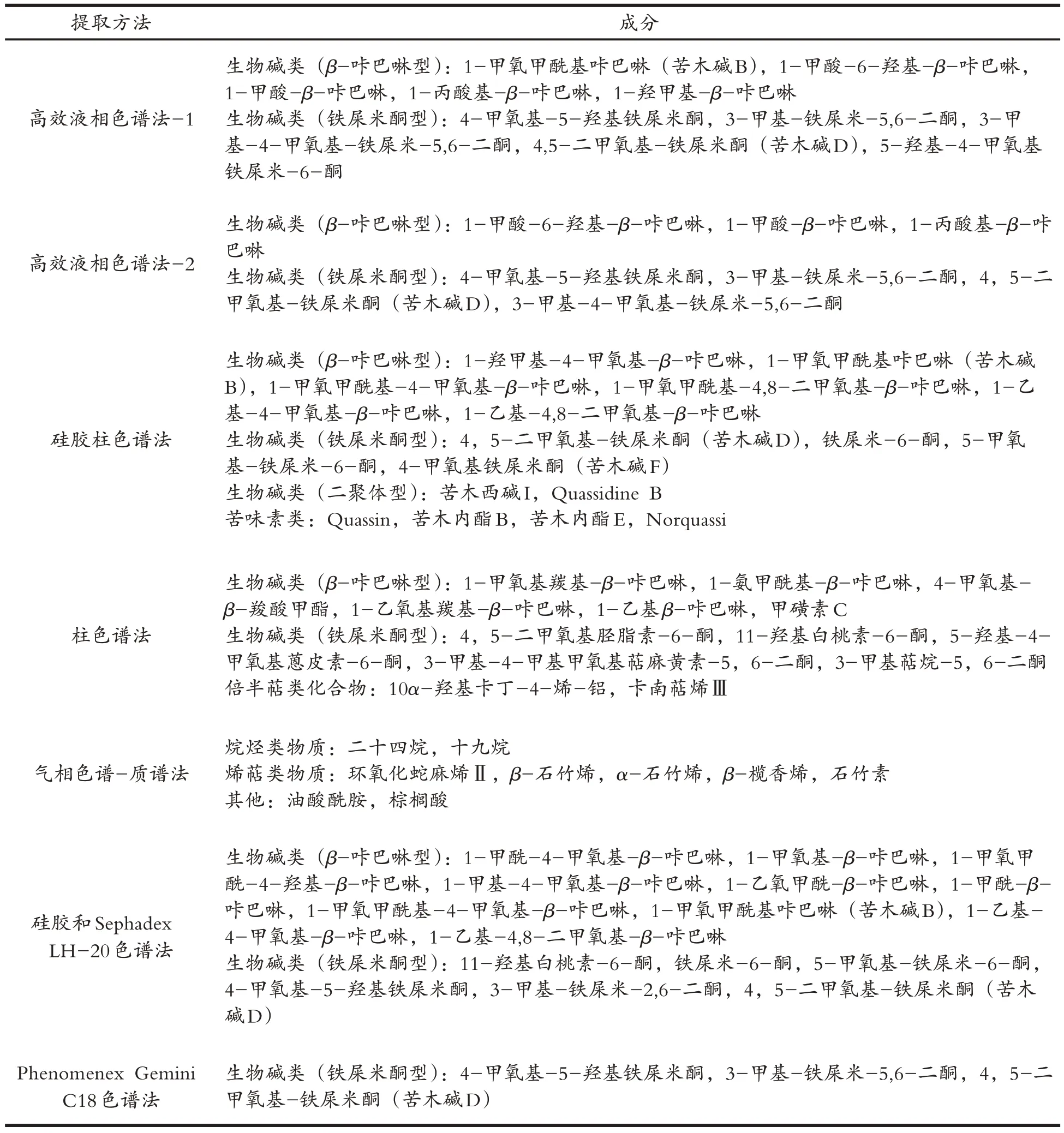
表1 苦木的主要化学成分
3.1.2 苦木靶标预测及GO基因功能注释和KEGG通路富集分析
将苦木的5个活性成分4-甲氧基-5-羟基铁屎米酮、4,5-二甲氧基-铁屎米酮、1-乙基-4,8-二甲氧基-β-咔巴啉、铁屎米-6-酮和苦木内酯G 对应的SMILES(Simplified Molecular Input Line Entry System,简化分子线性输入系统)号导入Swiss target Prediction 平台中进行靶点预测分析得到412个靶标蛋白,删除103 个重复靶标蛋白后,得到309 个无重复映射活性成分潜在的作用靶点.将靶点导入Metascape数据库中进行GO和KEGG通路富集分析,并以此来绘制GO和KEGG富集分析气泡图,图中的横坐标表示该基因占总基因的比值,纵坐标则表示该功能的名称,圆圈的大小表示作用靶点基因富集的数目,富集的基因越多,其圆圈的大小也就会越大,颜色的深浅则表示基因富集的程度,即该基因富集的程度越好,颜色就越深(图1).
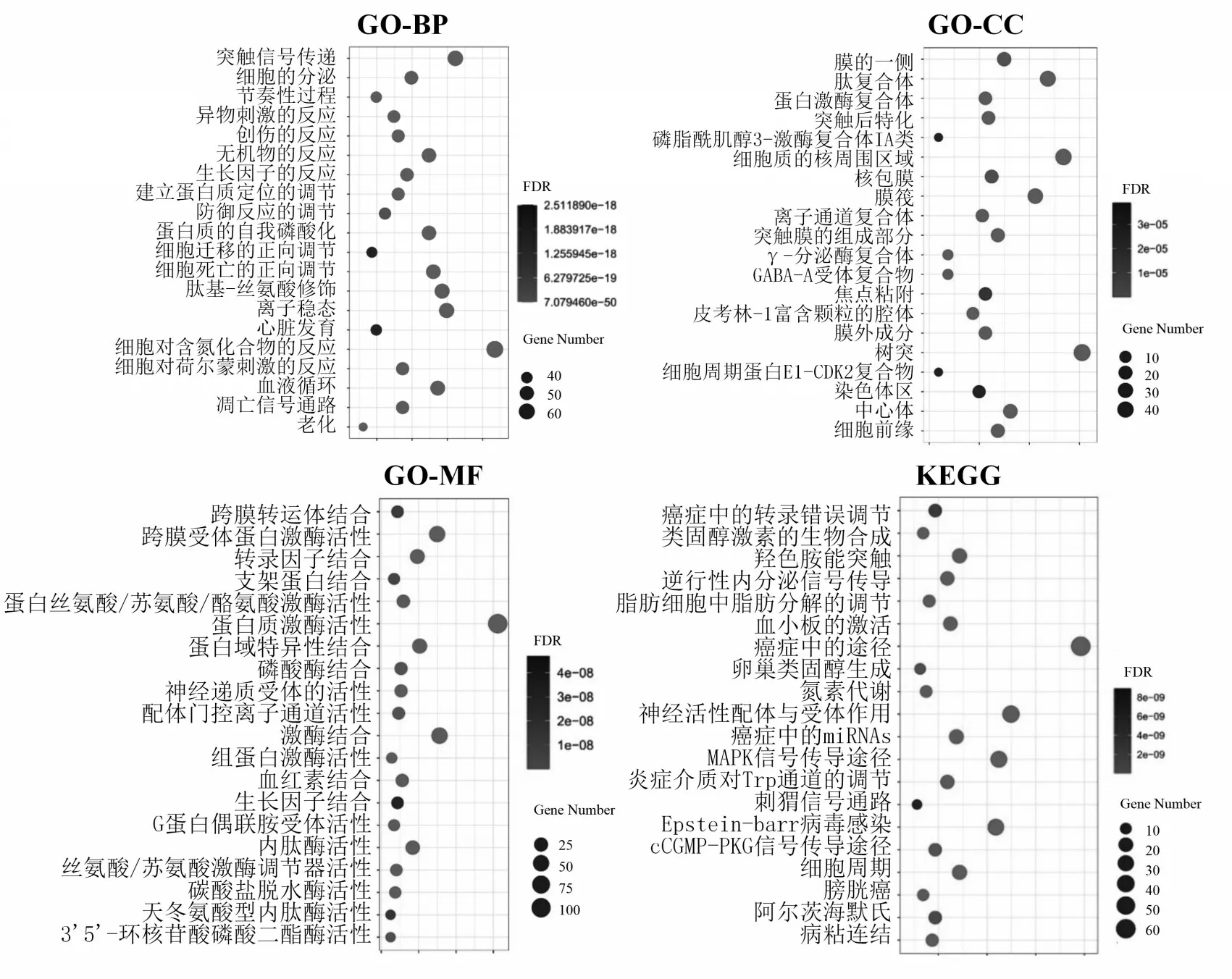
图1 苦木潜在靶点GO基因功能注释和KEGG通路富集气泡图
结果显示GO-BP 主要包括突触信号传递、蛋白质自我磷酸化、细胞迁移正向调节、细胞死亡正向调节、离子稳态、肽基-丝氨酸修饰和凋亡信号通路等.GO-CC 主要包括磷脂酰肌醇3-激酶复合体IA 类、γ-分泌酶复合体、细胞周期蛋白E1-CDK2 复合物、GABA-A 受体复合物、焦点粘着和肽复合体等.GO-MF主要包括跨膜受体蛋白激酶活性、蛋白质激酶活性、3′5′-环核苷酸磷酸二酯酶活性、G蛋白偶联胺受体活性、天冬氨酸型内肽酶活性和蛋白丝氨酸/苏氨酸/酪氨酸激酶活性等.上述苦木的活性成分相关靶标的GO 基因注释功能与抗癌、阿尔茨海默症存在联系,如磷脂酰肌醇3-激酶复合体IA 类,它可以通过多方面来降低细胞死亡的频率、增加肿瘤细胞的转移以及新生血管的生成[13],蛋白丝氨酸/苏氨酸的异常表达可能与舌鳞状细胞癌的发生有密切联系[14],γ-分泌酶复合物蛋白的斑块沉积与阿尔兹海默症的发病有着密切的联系[15].
KEGG富集通路主要包括癌症中的转录错误调节、癌症途径、癌症microRNAs、MAPK信号传导途径、炎症介质对Trp 通道的调节、羟色胺能突触、卵巢类固醇生成、膀胱癌和阿尔茨海默氏等,可以看出苦木预测的靶标KEGG 通路与抗癌相关,MAPK 信号通过可能与其他的通路一起被诱导激活从而诱导癌细胞的增殖转移,MAPKs 和NF-κB 信号通道的衰减,可以通过减少自由基的形成来阻碍破骨细胞的生长[16].癌症中的microRNAs 也正在成为人类癌症发生的新型信号因子[17],而卵巢类固醇也与卵巢癌有着深刻联系[18].
3.1.3 苦木潜在靶标PPI网络图构建及核心靶点筛选
苦木预测靶标导入STRING 数据库进行分析,得到蛋白互作PPI网络图,STRING 数据库导出蛋白互作信息,筛选出得分前15 的蛋白作为Hub 蛋白(图2).其中关键靶点包括:病毒癌基因编码酪氨酸蛋白激酶(Sarcoma gene,SRC,Degree=86)、可热休克蛋白90α(HSP90AA1,Degree=82)以及丝裂原活化蛋白激酶家族(Mitogen-activated protein kinase,MAPK)等.其中出现频率高的靶点SRC[19]、 HSP90AA1[20]、 MAPK1[21]、 PIK3CA[22]、 FYN[23]、 CDK1[24]、 LCK[25]、 JUN[26]、MAPK14[27]、JAK2[28]、EGFR[29]、PTK2[30]、ABL1[31]、MAP2K1[27]、NR3C1[32]和MAPK8[27]参与了多种癌症信号通路,包括MAPK 信号通路、细胞凋亡、细胞毒性、调节干细胞多能性、吞噬作用等信号通路,基本上涵盖了癌症/肿瘤的所有机制,表明这些靶点、信号通路可能在癌症的发生发展中发挥重要作用.
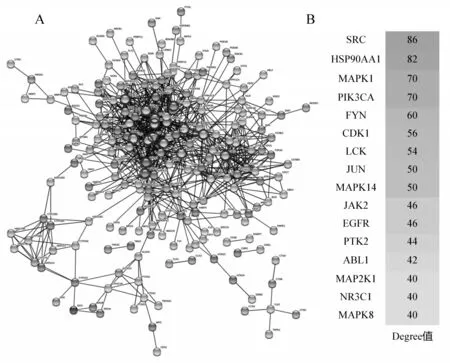
图2 苦木活性成分靶标的PPI网络图和中心Hub蛋白
3.1.4 苦木-靶点-疾病网络图构建
在CTD 数据库中对苦木靶点进行疾病分析,将得到的靶标基因和对应的预测疾病导入Cytoscape 3.8.0软件构建“苦木-靶点-疾病”网络图,利用Network Analyzer插件对网络进行拓扑性质分析,在该图示中,苦术位于中心位置并显著突出,而作为靶点的部分以圆圈形式表示,疾病则以方形式标识.同时进行Degree 值分析,Degree 值越高表明苦木-疾病相关性越强,结果显示苦木潜在靶标主要与消化道系统、呼吸系统以及生殖系统相关的癌症疾病有关(图3).
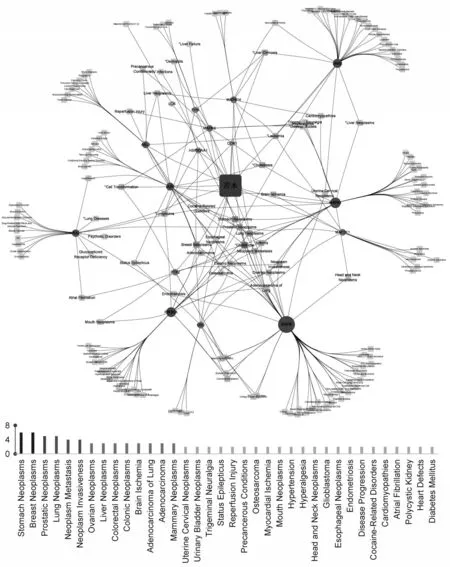
图3 苦木“药物-靶标-疾病”网络图和疾病Degree值
3.1.5 苦木靶点信号通路及对癌细胞作用预测
将获得的靶点导入KEGG 数据库进一步在通路水平上全面揭示苦木的抗肿瘤作用机制.通路上所含基因产物(靶点)越多,苦木越有可能通过这些通路发挥作用,结果显示苦木靶标相关的信号通路有肿瘤坏死因子(Tumor necrosis factor,TNF)信号通路、丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路、缺氧诱导因子-1(Hypoxia-inducible factor-1,HIF-1)信号通路、核转录因子-κB(Nuclear factor-κB,NF-κB)信号通路等,这165条关键通路的生物学功能可以分为4 个主要调节模块:促进肿瘤细胞凋亡和抑制肿瘤增生、免疫调节、内分泌调节、血液循环系统调节(图4).
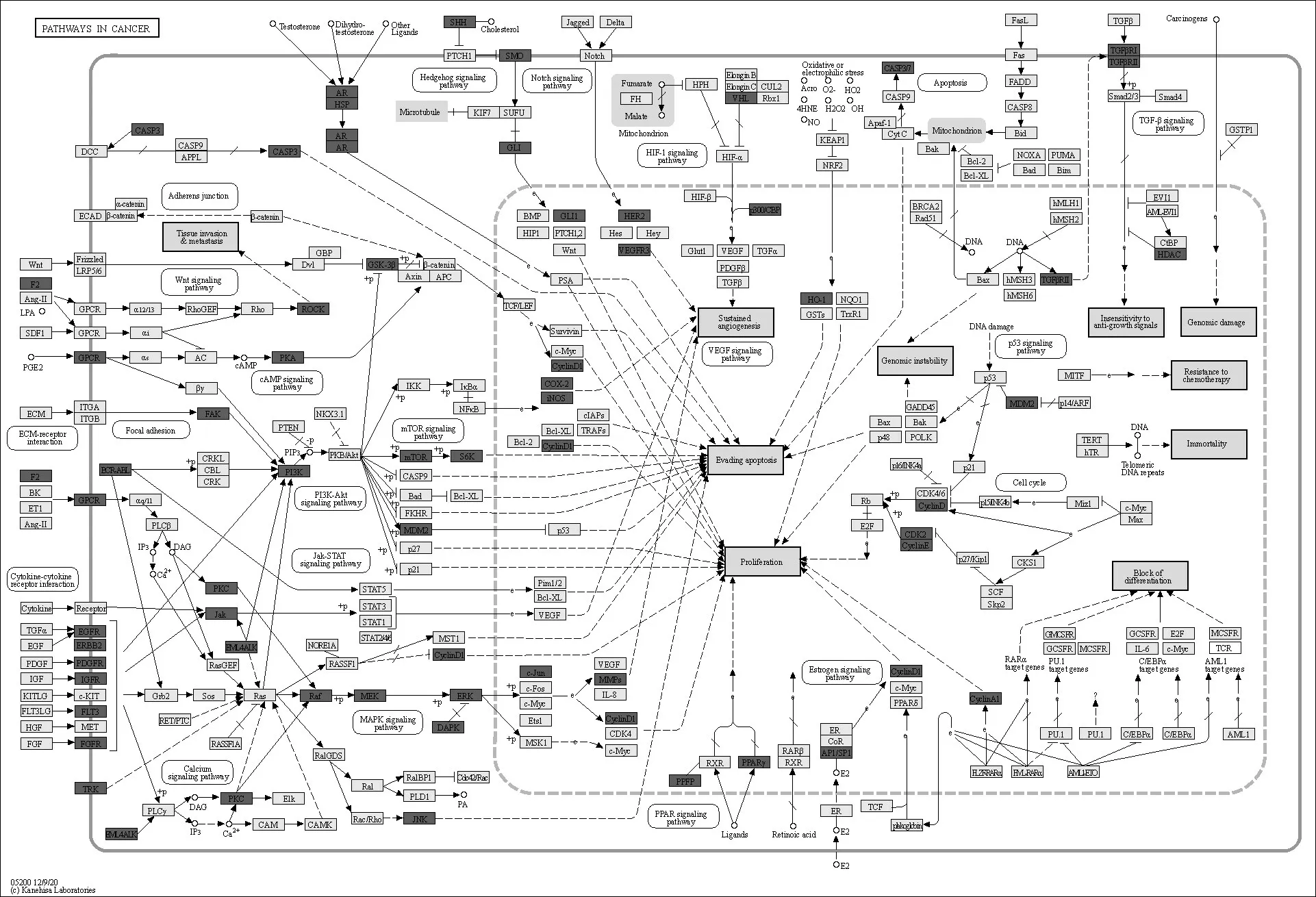
图4 苦木靶标KEGG通路预测图
通过cBioPortal(https://www.cbioportal.org/)数据库分析显示苦木靶标蛋白SRC、HSP90AA1、MAPK1、PIK3CA、FYN、CDK1、LCK、JUN、MAPK14、JAK2、EGFR、PTK2、ABL1、MAP2K1、NR3C1和MAPK8在子宫癌、非小细胞肺癌和食道癌等细胞系中表达较为显著(图5).
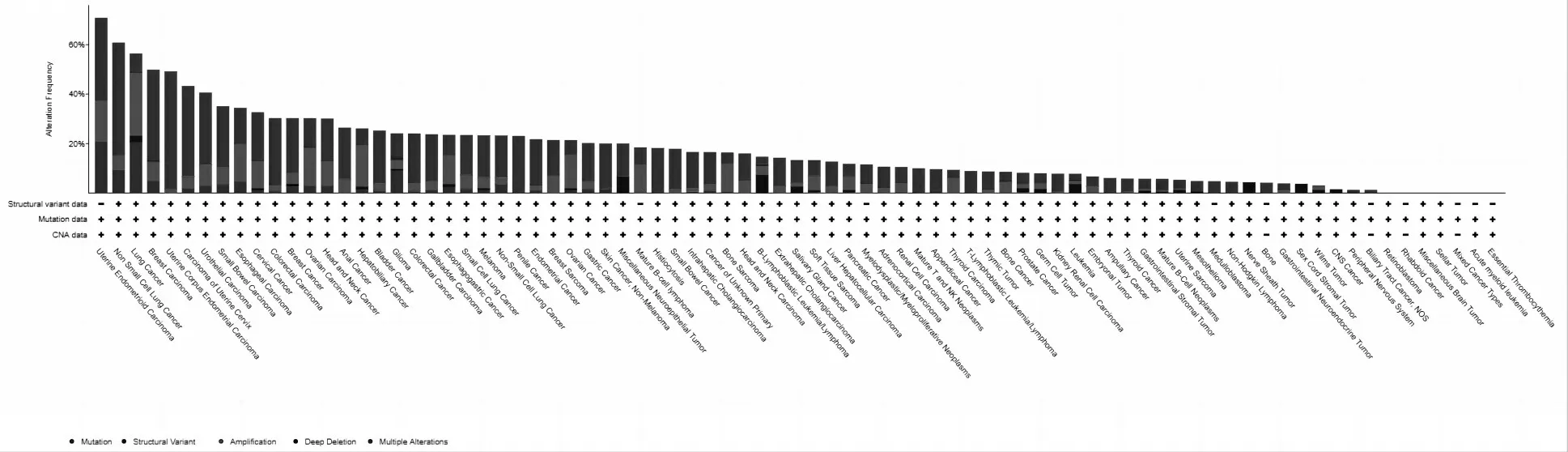
图5 苦木靶标基因在不同细胞系中的表达预测
3.2 药理活性体外验证
3.2.1 宫颈癌C33A细胞增殖检测
苦木药物浓度梯度作用于宫颈癌C33A 细胞24 h 后检测分析,结果显示宫颈癌C33A 细胞增殖抑制率与苦木浓度呈正相关,随着苦木药物浓度升高,宫颈癌C33A 细胞增殖的抑制率逐渐升高,尤其在苦木浓度升至100 μg/mL时,宫颈癌C33A细胞增殖抑制率尤为显著.同时宫颈癌C33A细胞形态也随着苦木浓度的增加由正常紧密分布的立体梭形逐渐皱缩变形,并伴随着明显的细胞间隙增大(图6).

图6 苦木对宫颈癌C33A细胞生长的影响
3.2.2 食道癌ECA-109细胞增殖检测
苦木药物浓度梯度作用于食道癌ECA-109 细胞24 h 后,观察细胞状态,并计算细胞增殖的抑制率.结果显示随着苦木药物浓度的升高,各浓度苦木处理的食道癌ECA-109细胞增殖的抑制率逐渐升高,且在低浓度(25 μg/mL)时表现出较强的癌细胞抑制显著性.随着苦木浓度的增加,食道癌ECA-109 细胞形态也从正常梭形逐步变圆脱落,且在苦木高浓度(400 μg/mL)作用下出现边界不清晰至细胞膜破裂的现象(图7).
3.2.3 人非小细胞肺癌A549细胞增殖检测
苦木药物浓度梯度作用于人非小细胞肺癌细胞A549,结果可看出人非小细胞肺癌A549 与上述两种癌细胞呈现出同样的抑制趋势,即随着苦木浓度的升高,细胞生长也受到了显著抑制,细胞生长抑制率与苦木浓度呈现显著正相关关系.人非小细胞肺癌细胞A549 的细胞形态在苦木作用下也由正常逐渐皱缩至出现明显胞质空泡化(图8).

图8 苦木对人非小细胞肺癌细胞A549生长的影响
4 讨论
本研究首先利用数据挖掘和文献检索确定了苦木的53 种化学成分,经过在TCMSP,TCMIP 以及Swiss ADME 数据库中对苦木化学成分进行口服利用度和药物相似性等原则筛选后,最终明确了苦木的有效药用成分为4-甲氧基-5-羟基铁屎米酮、4,5-二甲氧基-铁屎米酮、1-乙基-4,8-二甲氧基-β-咔巴啉、铁屎米-6-酮和苦木内酯G.经网络药理学及生物信息学对苦木活性成分的靶点进行收集分析,通过检索Swiss Target Prediction 数据库,获得无重复映射潜在作用靶点309 个.将这些靶点进行GO功能和KEGG通路富集分析和蛋白互作PPI,结果均显示苦木的靶标可能参与癌症相关信息通路.进一步在CTD数据库中挖掘结果表明苦木可能与消化道系统,呼吸系统以及生殖系统相关的癌症疾病有交联,前期研究也指出苦木是临床上用于治疗肠胃疾病、过敏性哮喘和泌尿生殖炎症的中药[33-35].在CBPortal 数据库中检索,结果将苦木相关的癌细胞系聚焦到了子宫癌、非小细胞肺癌和食道癌等细胞系中.
体外实验结果显示,苦木对宫颈癌C33A细胞、人食道癌细胞ECA-109和人非小细胞肺癌A549的生长抑制呈现显著的浓度依赖性.对上述三种细胞系添加不同浓度苦木药物,其中人食道癌细胞ECA-109 和人非小细胞肺癌A549 在苦木呈低浓度(25 μg/mL)时,就出现了显著抑制现象,随着浓度梯度增加至400 μg/mL,细胞逐渐皱缩脱落及空泡化.苦木对人宫颈癌C33A 细胞同样也有生长抑制作用,但是相比于其他两种细胞系,宫颈癌C33A 细胞的最低抑制阈值偏高,即在苦木浓度为50 μg/mL 时出现抑制现象,浓度高于100 μg/mL 后抑制尤为显著.金永哲等对苦木的醇提液也进行了肺癌细胞的抑制作用研究,结果显示苦木降低了肺癌细胞A549、A549/PTX 和QSG-770 的增殖及迁移能力,引起细胞发生凋亡[36].此外,也有报道发现苦木醇提物通过降低H-Ras 表达,诱导肝癌细胞HepG2 的凋亡[37],其抗肿瘤活性可能与4-甲氧基-5-羟基铁屎米酮有关[38].苦木正丁醇提取物诱导HT-29结肠和NCI-N87胃癌细胞凋亡.重要的是,这些提取物对293T正常人类细胞没有细胞毒性[39].
前期关于苦木的研究多聚焦于其成分、抗炎、抗菌和抗氧化等方向[6-7],抗肿瘤方向研究甚少,且多侧重于其具体成分具体功效分析.本研究通过多数据库多角度多维度首先推测苦木的可能功效为抗肿瘤,进一步确定其作用候选细胞系为子宫癌、非小细胞肺癌和食道癌等,通过体外试验也证实了上述推测.同时通过KEGG 通路图预测,本研究也提出苦木可能的抗肿瘤分子机制为TNF、MAPK、HIF-1 和NF-κB 信号通路.对SHR 大鼠灌胃苦木,发现其血清中TNF-α 显著降低[7].苦木中的苦木西碱显著抑制破骨细胞的转录因子c-Fos 和NFATc1,阻止MAPKs 和NF-κB 信号通路,进而抑制破骨细胞形成[40].苦木的其他抗肿瘤活性相关通路多聚焦于苦木中的有效成分,如张琳等发现苦木中苦木碱F 通过miR-331-3p/PSME3 轴抑制宫颈癌HeLa 细胞的增殖[41].苦木β-咔巴啉生物碱通过增强细胞外调节蛋白激酶ERK 和Janus 蛋白激酶JNK 磷酸化来诱导人鼻咽癌细胞系凋亡,该研究也首次提出人鼻咽癌中p-JNK和p-REK 的直流磷酸化诱导途径[42].同时苦木西碱I通过ERK和Akt信号通路调节HO-1,在鼻咽癌中发挥抗癌作用[43].苦木β-咔啉-3-羧酸乙酯(β-CCE)通过增加细胞内ROS 水平来激活p38/MAPK 信号通路随后诱导宫颈癌SiHa 细胞的凋亡[44].苦木β-咔啉生物碱(+/-)-Kumudine A-D 也可以影响肝癌细胞Hep3B 和HepG2 的生长[45].遗憾的是,迄今没有关于苦木与HIF-1 信号通路相关性的研究报告,所以苦木的抗癌HIF-1信号通路是后期的重点关注方向.
本研究将数据挖掘和网络药理学应用到中药研究思路中,突破了中药药理研究的传统固有思路,多成分多靶点多途径多维度整合聚焦具体疾病,实现经验到理性的科学化进程,以期对苦木研究提供用药可能性和更充分更有说服力的理论基础.
