凡纳滨对虾血蓝蛋白大亚基启动子的克隆及鉴定
2024-01-20郭丽钒黄贺楠赵琼君张涵杨昊杨培奎
郭丽钒,黄贺楠,赵琼君,张涵,杨昊,杨培奎⋆
(1.韩山师范学院 生命科学与食品工程学院,广东 潮州 521041;2.潮安归湖伟兴淡水养殖有限公司,广东 潮州515653)
1 引言
水产养殖业是人类重要的动物蛋白质来源,其中凡纳滨对虾(Penaeus vannamei)作为一种重要的对虾养殖品类在全球有着广泛的分布和养殖,据FAO 统计凡纳滨对虾全球年产量在2019年超过468万吨[1].我国是目前全球对虾养殖产量最高的国家,其中凡纳滨对虾是产量最高的对虾养殖品类之一.虽然近20年来对虾养殖业快速发展,但是以肝胰腺坏死综合征和白斑综合征为代表的细菌性病害和病毒性病害,以及种苗质量和养殖环境等一系列问题,制约着对虾养殖业的健康可持续发展.
由于缺乏适应性免疫系统,对虾主要依赖由细胞和体液组成的先天免疫系统抵御病原微生物的入侵[2-4].因此,对虾的先天免疫系统越来越多地为国内外的研究人员所关注.值得注意的是,血蓝蛋白是近年来在对虾等无脊椎动物中新发现的一种多功能免疫分子,其具有抗病毒、抑菌、凝集、溶血和抗肿瘤等多种免疫学活性[5-9],其功能多样性的分子机制可能与其在核酸水平的单核苷酸多态性、转录变体和选择性剪切等有关[10-14].这些研究提示,阐明血蓝蛋白的转录调控机制,对进一步揭示血蓝蛋白在对虾免疫防御中的作用具有重要意义.
为此,本研究以具有多种变体以及在对虾基因组中具有多个基因座的凡纳滨对虾血蓝蛋白大亚基基因为研究对象,在获取血蓝蛋白大亚基启动子候选序列的基础上,对其调控核心区及其参与调控的转录因子进行研究,为进一步完善血蓝蛋白大亚基基因参与免疫防御的分子机制奠定基础.
2 材料和方法
2.1 材料和试剂
凡纳滨对虾(体重5-10 g)由潮安归湖伟兴淡水养殖有限公司提供.DH5α感受态细胞和293T细胞均为本实验室保存,荧光素酶报告质粒pGL 3-Basic和内参质粒pRL-TK为本实验室保存.
海洋动物组织基因组DNA 提取试剂盒、无内毒素质粒提取试剂盒购自天根生化科技有限公司;DNA 胶快速回收试剂盒、DNA 片段纯化试剂盒、DNA Marker D5000购自北京康润诚业生物科技有限公司;PrimeSTAR Max Premix、DNA Ligation Kit Ver.2.1、限制性内切酶Quick CutTMKpn I、Quick CutTMXho I 购自Takara 公司;DMEM 培养基和胎牛血清购于Thermo fisher(美国)公司;TransDetect®Double-Luciferase Reporter Assay Kit 双荧光素酶报告基因检测试剂盒购自北京全式金生物技术有限公司;转染试剂Lipo6000™购自碧云天生物技术有限公司.
2.2 凡纳滨对虾血蓝蛋白大亚基基因(PvHMCL)候选启动子序列克隆
根据凡纳滨对虾基因组中血蓝蛋白大亚基基因(GenBank:ROT60816.1)的候选启动子序列设计引物HLP2-F/R(引物序列见表1)扩增获得血蓝蛋白大亚基基因起始密码子上下游序列HLP2 片段.生物信息学分析及双荧光素酶报告分析表明HLP2片段序列正确且包含启动子片段,以HLP2序列为模板设计4 条上游引物(HLP2-1F、HLP2-2F、HLP2-3F、HLP2-4F)以及HLP2-5F/R 递减扩增启动子去片段(引物序列见表1).所有上游引物引入Kpn I限制性酶切位点及保护碱基,下游引物引入Xho I酶切位点及保护碱基,引物由北京六合华大基因科技有限公司合成.PCR 扩增体系为20 μL:Prime-STAR Max Premix:10 μL,上下游引物各1 μL,基因组DNA:1 μL;H2O:7 μL(补足至20 μL).PCR 反应条件:96 ℃预变性3 min;96 ℃变性15 s,60 ℃退火20 s,72 ℃延伸1 min,共35 个循环;72 ℃最终延伸10 min;4 ℃保存.将PCR产物用1%琼脂糖凝胶电泳检测,产物回收纯化后进行Kpn I 和Xho I 双酶切,经酶切产物回收,利用T4 DNA 连接酶连接后,定向克隆同样双酶切的pGL3 basic 载体中构建pGL3-HLP2 双荧光素酶报告基因质粒.连接产物转化DH5α 感受态细胞,挑选阳性单克隆菌落,并由北京六合华大基因科技有限公司鉴定.

表1 扩增凡纳滨对虾血蓝蛋白大亚基启动子序列的引物
2.3 凡纳滨对虾血蓝蛋白大亚基基因启动子(HLP2)序列生物信息分析
利用在线软件Promoter-2.0(https://services.healthtech.dtu.dk/services/Promoter-2.0/)对HLP2序列进行转录起始位点预测.利用在线软件FPROM (http://www.softberry.com/berry.phtml?topic=fprom&group=programs&subgroup=promoter)预测TATA-box.使用JASPAR 数据库(https://jaspar.genereg.net/)、TFBIND (https://tfbind.hgc.jp/)、Match (http://gene-regulation.com/pub/programs.html#match)、PROMO(https://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3)等在线软件对核心启动子区内潜在转录因子结合位点进行预测;利用MethPrimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)在线软件对HLP2启动子区域进行CpG岛预测.
2.4 凡纳滨对虾血蓝蛋白大亚基基因启动子(HLP2)报告基因载体构建及鉴定
将PCR 扩增得到的对虾血蓝蛋白大亚基启动子递减长度的片段同样经过Kpn I 和Xho I 双酶切回收后,利用T4 DNA 连接酶连接后,定向克隆同样双酶切的pGL3 basic 载体中,分别构建HLP2 的截短双荧光素酶报告基因质粒pGL3-HLP2-1(-762/+735 bp)、pGL3-HLP2-2(-356/+735 bp)、pGL3-HLP2-3(+87/+735 bp)、pGL3-HLP2-4(+300/+735 bp)和pGL3-HLP2-5(+87/+321 bp).
2.5 细胞转染和双荧光素酶报告基因检测
接种293T 细胞于24 孔板中,添加含有10%胎牛血清及1%双抗的DMEM 培养基,每个孔的细胞接种量为5×105个细胞,置于37 ℃,CO2浓度为5%的培养箱中培养至细胞汇合度为70%-80%时,将构建的重组双荧光素酶报告质粒按照Lipo6000™脂质体的操作要求转染至293T 细胞,作为试验组.同时将pGL3 basic转染至293T细胞作为阴性对照组,以pRL-TK 作为内参质粒同时转染至上述细胞,试验重复3 次,每组3 个平行试验.在质粒瞬时转染48 h 后,收集细胞裂解液,根据双荧光素酶检测试剂盒TransDetect®Double-Luciferase Reporter Assay Kit(北京全式金生生物技术有限公司)的操作要求分别测定并计算萤火虫荧光素酶活性(F值)和海肾荧光素酶活性(R值)的比值(F/R)确定启动子片段相对活性.
3 结果
3.1 对虾血蓝蛋白大亚基启动子(HLP2)片段的扩增
以虾肌肉基因组DNA 为模板,通过PCR 扩增获取血蓝蛋白大亚基基因的候选启动子片段HLP2,PCR扩增产物经凝胶电泳检测结果显示(图1),该扩增片段与目的片段的大小一致,且条带单一、无明显杂带.经测序鉴定,扩增片段长度为1 964 bp,其中包括起始密码子ATG 上游1 229 bp,下游735 bp,与凡纳滨对虾基因组序列中血蓝蛋白大亚基的序列比对完全一致,可用于后续试验.

图1 HLP2启动子候选序列PCR扩增产物电泳图
3.2 对虾血蓝蛋白大亚基启动子(HLP2)核心区鉴定
以HLP2片段为模板,利用缺失引物进行PCR扩增分别获取HLP2的逐段缺失启动子区片段HLP2-1、HLP2-2、HLP2-3、HLP2-4、HLP2-5和HLP2-6,并将上述片段分别定向克隆只pGL3-basic载体.经测序和双酶切(图2)鉴定,成功构建HLP2及其缺失片段的双荧光素酶报告基因重组质粒,将其分别命名为pGL3 HLP2、pGL3 HLP2-1、pGL3 HLP2-2、pGL3 HLP2-3、pGL3 HLP2-4 和pGL3 HLP2-5(图3-A).
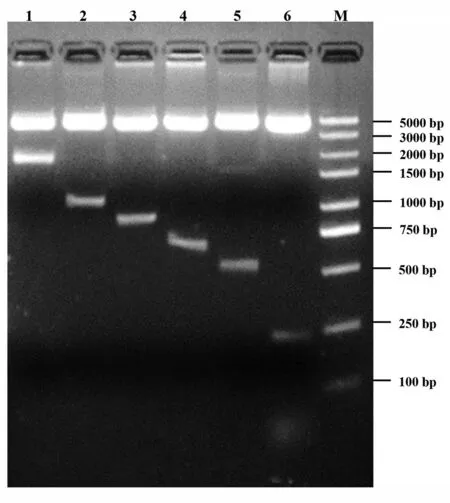
图2 HLP2基因启动子截短型报告基因质粒酶切鉴定

图3 HLP2候选启动子核心区分析
将上述质粒利用脂质体瞬时转染至293T 细胞,通过双荧光素酶报告基因分析逐段缺失片段的启动子活性发现(图3-B),HLP2(-1 235/+735 bp)启动子片段的活性较低,进一步对缺失区域进行比较发现,缺失-1 235/-357 bp 片段后,缺失启动子片段HLP2-2(-365/+735 bp)的活性相比较HLP2 和HLP2-1(-762/+735 bp)分别显著上调330%和300%(P<0.01).进一步缺失-365/+86 bp 片段后的HLP2-3(+87/+735 bp)的启动子活性进一步增强.然而,缺失+87/+299 bp片段后的HLP2-4(+300/+735 bp)的启动子活性相比较HLP2-3 显著下降88.9%(P<0.01).进一步分析发现HLP2-5(+87/+300 bp)片段的启动子活性显著高于HLP2和HLP2-3片段的启动子活性,由此确定+87/+300 bp区域为对虾血蓝蛋白大亚基启动子(HLP2)的核心区.
3.3 对虾血蓝蛋白大亚基启动子(HLP2)生物信息学分析
利用Promoter-2.0在线程序预测HLP2的转录起始位点(TSS),结果表明HLP2在+66 bp的位置存在一个转录起始位点(图4).通过FPROM 在线软件分析可知,HLP2启动子区具有典型的真核生物启动子结构原件,含有1个TATA-box(图4).利用Match™-1.0、PROMO、JASPAR 和TFBIND 等多个在线软件对HLP2启动子核心区域(HLP2-5,+87/+300 bp片段)的关键转录因子进行预测.结果显示,HLP2-5 启动子区域包含KLF1、KLF4、KLF5、YY1、c-Jun、AP1、AP4、USF、CP2、DP-1 和DELTAEF1等转录因子的结合位点(图4).因此初步推测,上述转录因子可能参与对虾血蓝蛋白大亚基基因的转录调控.

图4 HLP2启动子基因核心区转录因子结合位点预测
利用在线软件MethPrimer 对凡纳滨对虾血蓝蛋白大亚基基因启动子HLP2(-1 234~+735 bp)进行CpG 岛预测,结果表明,启动子序列HLP2 在-312/+725 bp 处存在一个CpG 岛(图5).通过EMBOSS Cpgplot预测,结果同样发现HLP2启动子片段在-312/+725 bp处存在一个CpG岛(图6).两种在线程序对凡纳滨对虾血蓝蛋白大亚基基因启动子区CpG岛的预测结果一致.

图5 HLP2的CpG岛预测(MethPrimer)
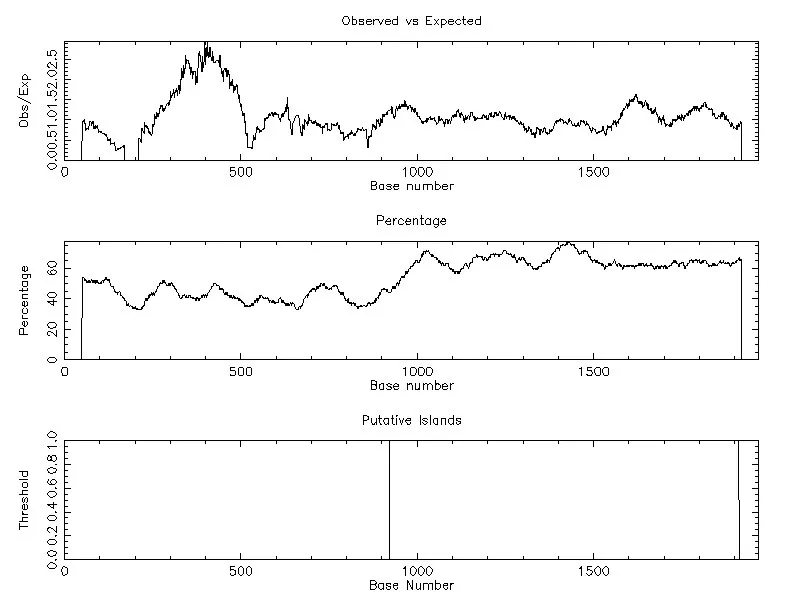
图6 CpG岛预测结果(EMBOSS:Cpgplot)
4 讨论
由于缺乏适应性免疫系统,因此对虾主要依赖先天免疫系统抵御病原微生物的感染.研究表明,对虾的免疫系统由细胞免疫和体液免疫组成,其中体液免疫包括多种免疫相关基因(如抗菌肽、蛋白酶及其抑制剂、酚氧化酶原系统、模式识别受体和细胞凋亡相关基因等)和信号通路(Toll、IMD和JAK/STAT等)[15-17].有趣的是,血蓝蛋白作为一种存在于节肢动物和软体动物体液中的含铜呼吸蛋白,近年来的研究表明除了携氧功能植物,血蓝蛋白还具有酚氧化酶、抗病毒和抗菌等多种免疫活性[7,14,18-20],同时也参与对虾免疫信号的通路调控[21-23].此前的研究表明,凡纳滨对虾血蓝蛋白是由3 个大亚基和3 个小亚基组成的6 聚体[7,14].Yang[24-25]等在克隆凡纳滨对虾血蓝蛋白小亚基基因启动子的基础上进一步发现c-Jun、Kruppel 等转录因子参与小亚基启动子的转录调控.与此同时,Zhang[26]等也证实转录因子E75参与对虾血蓝蛋白小亚基启动子的负调控.虽然,此前的研究表明血蓝蛋白大亚基具有更多的变体[11]及SNP位点[27]且与病原感染后的免疫应答密切相关,同时凡纳滨对虾基因组的数据表明基因组中存在多个大亚基基因的基因座.因此,本研究对凡纳滨对虾血蓝蛋白大亚基基因启动子区序列进行了克隆与分析,筛选出核心启动子区并对该区域的转录因子结合位点进行预测,为进一步分析其转录调控机制奠定基础.
本研究以凡纳滨对虾基因组中血蓝蛋白大亚基的序列为基础设计引物,通过PCR 技术扩增得到HLP2基因包括起始密码子ATG,及其上游序列735 bp,下游序列1 234 bp在内的全长1 969 bp的基因组DNA 片段.生物信息学分析发现,该区域包括TATA-box 转录调控元件,转录起始位点,因此将其作为启动子候选序列片段.在此基础之上,通过亚克隆将一系列启动子载体构建,进行启动子活性及其核心区的分析.结果表明,pGL3 HLP2-3的启动子活性明显高于全长片段的启动子活性,然而在删除+87/300 bp 之后启动子活性显著下降,而HLP2-5(+87/300 bp)片段的启动子活性明显高于HLP2 和HLP2-3 等片段的启动子活性.由此提示,这是HLP2 启动子一个位于外显子的核心区域.目前,已有许多关于启动子位于外显子的研究报道,如,hDAO在外显子2中存在一个选择性启动子[28],MAPT(microtubule-associated protein tau gene)基因在外显子1 中存在选择性启动子[29],WNT5A(Wnt family member 5A gene)的选择性启动子B 位于外显子2[30].由此,位于外显子1的HLP2核心启动区可能为一个选择性启动子,与目前人们在人类基因组中发现30%-50%的人类基因存在选择性启动子的结论相似[31].而此前血蓝蛋白小亚基基因启动子中同样发现一个位于内含子和外显子的核心调控区域[24].另外,有研究指出p53基因位于内含子4 的一个内部启动子可转录编码多个不同的p53转录本[31-32].值得一提的是,血蓝蛋白大亚基具有多种转录本,血蓝蛋白大亚基的选择性启动子可能与不同转录本的产生有关.
综上所述,本研究成功克隆了凡纳滨对虾血蓝蛋白大亚基基因启动子HLP2 序列,并进行生物信息学分析发现其存在TATA-box转录元件、转录起始位点和CpG岛.同时,构建HLP2启动子荧光素酶报告基因载体,利用双荧光素酶鉴定得到一个位于外显子1的(+87/+300 bp)核心区域,并对核心区域的转录因子结合位点进行预测,至于相关转录因子对HLP2的转录调控尚需进一步验证和深入研究.
