不同水曲柳褐斑病病级叶片的微生物多样性
2024-01-19刘思远,申东晨,刘峥,鲁丽颖,徐恒,董爱荣
刘思远,申东晨,刘峥,鲁丽颖,徐恒,董爱荣





摘要:为探究染褐斑病不同程度的水曲柳叶片微生物多样性和主要致病微生物,分析防治方法以维护水曲柳人工林生态安全、提升其经济效益,在帽儿山实验林场采集染褐斑病不同程度的叶片,采用高通量测序技术,测定并分析水曲柳叶片微生物群落结构和物种组成。3组样品感病前后共得到1 026个真菌分类操作单元(Operational Taxonomic Unit ,OUT)及322个细菌OUT。在细菌中,变形菌门和放线菌门为优势菌门;鞘氨醇单胞菌属、醋酸杆菌属、短根瘤菌属等为主要优势属。在真菌中,担子菌门和子囊菌门为优势菌门;维希尼克氏酵母属、壳针孢属、汉纳酵母属为优势菌属。3组样品细菌多样性及群落结构无明显差异,真菌多样性及群落结构差异性显著,初步推测尾孢菌属为病原菌,但其致病性有待进一步研究。
关键词:水曲柳;褐斑病;高通量测序;尾孢菌属;菌群结构
中图分类号:S763.1文献标识码:A文章编号:1006-8023(2024)01-0001-08
Microbial Diversity in Leaves of Different Fraxinus mandshurica Brown Spot Disease Stages
LIU Siyuan, SHEN Dongchen, LIU Zheng, LU Liying, XU Heng, DONG Airong*
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
Abstract:To investigate the microbial diversity and the main pathogenic microorganisms of Fraxinus mandshurica leaves with different degrees of brown spot disease, and to analyze the control methods to maintain the ecological safety and enhance the economic benefits of Fraxinus mandshurica plantation forests, leaves infected with brown spot disease to varying degrees at Maoershan Experimental Forest Farm were collected,and the microbial community structure and species composition of Fraxinus mandshurica leaves were determined and analyzed using high-throughput sequencing technology. A total of 1 026 fungal operational taxonomic units (OUT) and 322 bacterial OUTs were obtained before and after the disease in the three groups of samples. Among the bacteria, the phyla Proteobacteria and Actinobacteriota were the dominant phyla; the genera Sphingomonas, Acidibacter and Bradyrhizobium were the main dominant genera. Among the fungi, the phyla Ascomycota and Basidiomycota were the dominant phyla; the genera Vishniacozyma, Septoria, and Hannaella were the dominant genera. There were no significant differences in bacterial diversity and community structure among the three groups of samples, and significant differences in fungal diversity and community structure. It was preliminarily speculated that the Cercospora was a pathogenic bacterium, but its pathogenicity needed further study.
Keywords:Fraxinus mandshurica; brown spot; high-throughput sequencing; cercospora; microbial community structure
0引言
水曲柳(Fraxinus mandshurica)是木犀科(Oleaceae)梣屬(Fraxinus)植物,东北三大硬阔木之一,为东北地区的主要造林树种,同时也是工业和民用高级用材[1-2],广泛分布于中国东北三省及西北部分地区,在俄罗斯、日本及朝鲜也有分布[3]。目前对水曲柳的研究较为全面,如生理学研究[4-6]、生态学研究[7-8]、遗传育种研究[9-10]及繁育技术研究[11]等。由于破坏严重,加之对水曲柳的市场需求大,水曲柳资源已十分匮乏,伴随着水曲柳人工种植数量增加,其病害也愈发严重,如水曲柳翅果斑点病、水曲柳梢头白腐、花曲柳叶斑病、水曲柳白粉病、苗木根结线虫病、煤污病和水曲柳幼苗褐斑病等都造成很大的经济损失,因此对水曲柳病害的深入了解至关重要。水曲柳褐斑病多危害幼苗,发病后,嫩叶出现病斑,病斑颜色加深扩大至大量叶片死亡,极大降低幼苗生长率,造成严重经济损失[12-14]。调查发现实验林场的水曲柳幼树叶片均感染不同程度的褐斑病,导致叶片发黄甚至植株死亡,是现存水曲柳数量稀少的主要原因之一。此外国内外对于其他褐斑病的相关研究十分丰富,目前常见的褐斑病有核桃褐斑病[15]、苹果褐斑病[16]、松针褐斑病[17]、梨树褐斑病[18]和柑橘褐斑病[19]等,但对水曲柳褐斑病的记载较少,仅有少数文献提及,目前褐斑病的防治以化学防治为主,长此以往会造成环境污染或产生耐药性等现象,利用拮抗微生物防治林木病害是近年来的研究热点[20],故运用生物防治拮抗水曲柳褐斑病病原是一种有效可行的办法。
高通量测序技术相比较传统的生物测定方法更加快速、准确、高效且能全面分析物种组成以及群落结构[21- 22],如邓世林等[23]在分析感染杨树灰斑病前后叶围微生物变化时发现染病后病原菌棒盘孢属(Coryneum)为优势真菌,Satoshi等[24]通过高通量测序研究法,分析桐与柞木的真菌群落组成随着时间与腐朽程度的变化情况,结果表明腐朽木的分解速率受腐朽真菌的种群数量的影响。
目前为止,水曲柳褐斑病未引起足够重视,关于水曲柳褐斑病的研究也鲜有报道,故探究其微生物群落结构并进一步分析防治方法在维护水曲柳人工林生态安全、提升其经济效益等方面具有重要意义。本研究运用高通量测序法分析不同染病程度的叶片微生物多样性和群落结构的相关变化,通过分析相关优势微生物的丰度,探究引起褐斑病的相关病原菌,为后续的褐斑病研究提供理论依据和试验基础。
1材料与方法
1.1样本采集
水曲柳健康叶片、发病叶片均于2022年6月采集于黑龙江省哈尔滨市帽儿山实验林场。采用“S”形十点采样法,分别剪取3棵5年生健康叶片、感染褐斑病较轻(病斑面积占整个叶片面积的10%以下)及染病较重(病斑面积占整个叶片面积的10%以上)的水曲柳叶片,放入密封袋中以进行后续DNA提取处理,编号为J1、B1、B2。
1.2水曲柳叶片总DNA提取及PCR扩增
叶片先用体积分数为75%乙醇浸泡15 s,无菌水冲洗3次去除残留乙醇,再用0.5%的次氯酸钠浸泡1 min后,再用无菌水冲洗3次。总DNA的提取采用十六烷基三甲基溴化铵法(Cetyltrimethylammonium Bromide,CTAB)稍作修改,并用体积分数为1%琼脂糖凝胶电泳检测所提取DNA的质量。使用带条形码的特异引物对总DNA的16S rRNA和ITS进行聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增。PCR扩增采用50 μL PCR扩增体系,扩增反应条件为98 ℃预变性5 min, 98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,25个循环,最后72 ℃延伸5 min。PCR产物放于体积分数为2%琼脂凝胶电泳检测,剩余样品4 ℃保存备用。每组样品设置3个样本重复,J1的3个重复编号为L1、L2、L3;B1的3个重复编号為L4、L5、L6;B2的3个重复编号为L7、L8、L9。引物中的相对应扩增区域为16S V5、V7 区引物,其作用是可以帮助鉴定细菌多样性;ITS1 和ITS4区引物,其作用是可以帮助鉴定真菌多样性。扩增产物采用Illumina平台对群落DNA片段进行双端(Paired-end)测序,测序过程由上海派森诺生物科技有限公司完成。
细菌上游引物序列:5′-AACMGGATTAGATACCCKG-3′ 下游引物序列5′-ACGTCATCCCCACCTTCC-3′。
真菌上游引物序列:5′-CTTGGTCATTTAGAGGAAGTAA-3′ 下游引物序列5′-GCTGCGTTCTTCATCGATGC-3′。
1.3数据分析
调用QIIME 2切除序列的引物片段,弃除未匹配引物的序列;调用DADA2进行质控、去噪、拼接、去嵌合体、去噪,合并OTUs特征序列和OTU表格,统计各样本在门、纲、目、科、属、种6个分类水平下的组成分布的数据可视化,并以相对丰度呈现分析结果。物种比对注释使用 RDP classifier 软件,保留置信区间大于0.8的注释结果。利用scikit-bio进行丰富度(Chao1)指数、辛普森(Simpson)指数、覆盖率(Coverage)指数计算,并在各分类水平上进行群落结构的统计分析,得到微生物群落结构组成。利用R语言ropls包进行PCA分析样本间的物种丰度组成差异。利用VennDiagram包制作韦恩图。利用pheatmap包绘制物种组成热图。
2结果与分析
2.1感病前后样品的细菌和真菌Alpha多样性
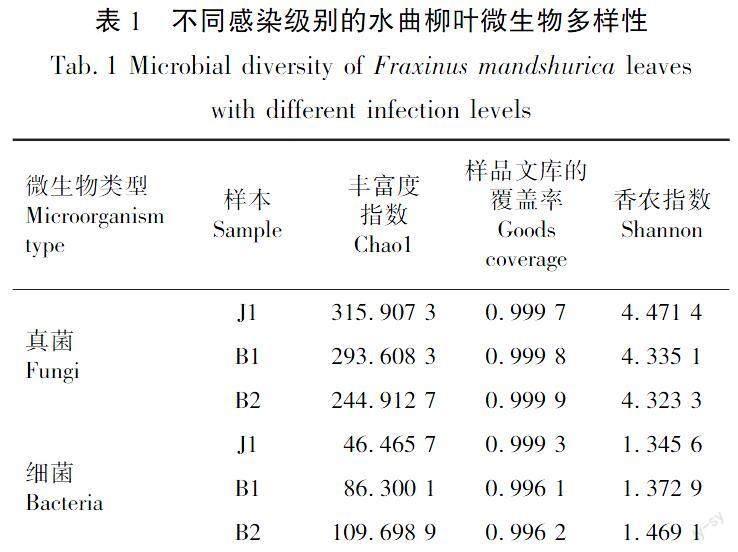
α指数可以代表物种在生境内的多样性,例如coverage代表样品文库的覆盖率,其数值越高,则样品中序列被测出的概率越高。由表1可知,本次测序的coverage均达到0.99以上,说明本次测序结果代表样品中微生物的一个真实的情况。Chao1可以用来估计群落中含OUT数目的物种总数,一般来讲Chao1的数值越大代表物种总数越多,Shannon指数同样可用来估算样品中微生物多样性,但其与微生物群落多样性正相关。由表1可知,真菌的Chao1指数与Shannon指数随着染病程度增加明显下降;细菌的Chao1指数与Shannon指数随着染病程度增加明显上升。结果表明,随着病菌侵染的加重,内生真菌丰富度及多样性呈现出下降的趋势,内生细菌的丰富度及多样性逐渐上升。
2.2真菌Beat多样性
基于主坐标分析样品间多样性差异,评估不同病级的水曲柳叶片内生真菌的差异性,如图1所示。结果表明,第一主坐标(PC1)与第二主坐标(PC2)的贡献率分别为90.2%和8.5%。健康叶J1的3个样品相聚较近,而发病较轻的B1和较重的B2相聚较近,表明在褐斑病侵染的情况下,内生真菌群落结构发生改变,无病斑叶与染病叶内生真菌群落构成差异明显。
2.3不同侵染级别的水曲柳叶OUT分类
根据97%相似度对抽平后的序列进行OTU聚类,由图2可知,感病前后共得到1 208个真菌OUT及358个细菌OUT。不同染病程度的3组样品中共有160个真菌OUT,占OUT总数的13.2%,3类样品中特有的真菌OUT数目分别为367、287和212个,其中J1中特有的OUT数目最多。在不同染病程度的叶片中共有33个细菌OUT,占OUT总数的9.9%,3类样品中特有的细菌OUT数目分别为45、92和152个,其中B2中特有的OUT数目最多。证明染病前后真菌的OUT数目显著下降,细菌的OUT数目显著上升,与表1结果一致。
2.4不同感染级别的水曲柳叶物种分类学注释
通过图3可直观地展示各分组的注释精度及不同分组的注释情况。由图3(a)可知,随叶片染病程度增加,真菌门、纲、目、科、属、种的OUT数量均明显下降,真菌种水平下的OUT数目随染病由282下降为273、240。由图3(b)可知,随叶片染病程度增加,细菌门、纲、目、科、属、种的OUT数量均明显上升,细菌种水平下的OUT数目随染病由46上升为71、74。
2.5感病前后叶片细菌群落结构差异性
对不同感染级别的叶片在不同的分类水平进行群落组成分析,结果见表2,在细菌门水平下,3组样品中主要包含变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidota)及厚壁菌门(Firmicutes),其中变形菌门的相对丰度最高,分别达到97.56%、97.53%、97.26%,因此变形菌门为叶片内生细菌中的优势菌门。
在属水平下,健康叶J1相对丰度较高的属有鞘氨醇单胞菌属(Sphingomonas)(86.34%)、醋酸杆菌属 (Acidibacter)(4.62%)、短根瘤菌属(Bradyrhizobium)(2.84%)、酸球菌属(Acidisoma)(2.23%)和副球菌属(Paracoccus)(0.24%)等;染病较轻叶片B1相对丰度较高的属有鞘氨醇单胞菌属(87.63%)、醋酸杆菌属(4.37%)、短根瘤菌属(1.71%)、酸球菌属(1.71%)和未被鉴定的拟杆菌科(muribaculaceae)(0.46%)等;染病较重叶片B2相对丰度较高的属有鞘氨醇单胞菌属(87.50%)、醋酸杆菌属 (4.64%)、短根瘤菌属(1.46%)、酸球菌属(1.81%)和痤疮棒状杆菌属(Cutibacterium)(0.52%)等。3组样品的细菌群落组成不尽相同,主要优势属大致相同,但相对丰度存在一定的差异性。短根瘤菌属、酸球菌属、假单胞菌属和副球菌属等在叶片染病后相对丰度呈一定下降趋势;痤疮棒状杆菌属、甲基杆菌属随着叶片发病,相对丰度有一定上升。
2.6感病前后叶片真菌群落结构差异性
真菌的群落组成结果见表3,在门水平下,子囊菌门(Ascomycota)与担子菌门(Basidiomycota)为主要的优势菌门,且在染病前后出现丰度差异,子囊菌门在健康叶B1中的相对丰度为56.89%,但在B1与B2样品中相对丰度下降为32.63%和43.92%。担子菌在J1中相对丰度为14.17%,染病后分别上升到51.46%和51.01%。
在属水平下,健康叶J1相对丰度较高的属有维希尼克氏酵母属(Vishniacozyma)(2.53%)、壳针孢属(Septoria)(39.71%)、宙斯沸耳属(Dioszegia)(4.21%)、木耳属(Auricularia)(1.47%)和链格孢属(Alternaria)(1.29%)等;染病较轻叶片B1相对丰度较高的属有维希尼克氏酵母属(38.00%)、壳针孢属(15.31%)、汉纳酵母属(Hannaella)(6.30%)、木耳属(Auricularia)(1.52%)和尾孢菌属(Cercospora)(1.34%)等;染病较重叶片B2相对丰度较高的属有维希尼克氏酵母属(35.63%)、壳针孢属(18.27%)、汉纳酵母属(5.12%)、尾孢菌属(4.14%)和宙斯沸耳属(3.91%)等。其中希尼克氏酵母属、汉纳酵母属和尾孢菌属在叶片染病后相对丰度开始明显上升,壳针孢属相对丰度在染病后明显下降。
2.7物种组成热图分析
根据真菌属水平下相对丰度前15的数据绘制热图,结果如图4所示。热图分析不同样品的差异较为显著,不同样品之间优势种群存在显著差异。热图分析显示随着病害的发生,样品中的真菌微生物群落逐渐改变,优势菌群发生改变,样品中的群落结构不稳定。从样本聚类来看B1组和B2组的真菌微生物群落组成更为相似,表明染病后的菌群结构相似度提高。壳针孢属与宙斯沸耳属等在J1样本中丰度较高,而维希尼克氏酵母属与尾孢菌属等在染病叶片中丰度较高。
3讨论
通过高通量测序技术,对不同染病程度的水曲柳叶片内生细菌与真菌多样性进行分析,并研究其群落结构。研究表明健康植物组织的内生真菌群落结构更加稳定[25],从而抑制病原菌的侵入与致病,张丽娜等[26]通过平板稀释法培养健康与染病的山茶叶片,结果发现健康叶片的内生真菌数量及多样性远高于染病叶片。本研究中,健康叶片内生真菌多样性显著高于染病叶片,这与先前的研究结论一致。
3组样品的细菌优势门为变形菌门和放线菌门,
Sturz[27]研究发现在果树等经济树种及经济农作物的组织中也存在大量的变形菌门和放线菌门,与此同时甄泉[28]和方建波[29]的研究中提到,不同的林型空气细菌群落中变形菌门、放线菌门以及厚壁菌门均是细菌的主导菌门,这说明水曲柳叶片样品中的优势细菌很可能是在染病之前就大量存在,不是导致水曲柳褐斑病的主要病原。真菌群落中担子菌门和子囊菌门是绝对的优势真菌,两者均为常见的植物内生真菌[30],且染病前后相对丰度出现显著变化。
鞘氨醇单胞菌属作为内生细菌的优势属,可对紫外线辐射进行预防,在白玉兰、水稻等植物叶片内生细菌群落研究中也有报道[31-32]。维希尼克氏酵母属是常见植物内生真菌,如赵卫松等[33]研究表明患黄萎蔫病的马铃薯病株根际土壤中维希尼克氏酵母属的相对丰度呈上升趋势,但对其系统性研究却鲜有报道[34- 35]。壳针孢属是球壳孢目的无性属,为许多植物病原菌,分布于全球多种植物,常引起叶斑等症状[36],但在本研究中壳针孢属相对丰度在染病后下降,同时其也为常见的内生真菌[37-38],不考虑为病原菌。水曲柳褐斑病其致病菌有研究认为是半知菌球壳孢目[13],有研究认为是白蜡尾孢菌(Cercospora fraxinites)[14],后者與本研究结果相似,本研究在健康叶中仅检测到0.05%的尾孢菌属,但尾孢菌属在病叶中的相对丰度显著上升,很可能为病原菌,但其致病性需要柯赫氏法则进一步验证,后续可从病原菌分离及内生细菌真菌的拮抗方向进一步探究。
本研究結果可为水曲柳的微生物群落结构提供一些理论的依据。随着水曲柳需求量的日益增加,以及人工水曲柳林的逐渐增多,水曲柳褐斑病等重要病害的监测和防治任务更加艰巨,因此东北地区如何实施有效的防治策略,还有待今后进一步调查和研究。
4结论
健康及感染水曲柳褐斑病叶片的微生物多样性如下。
1)不同染病程度叶片细菌多样性及丰度无显著差异,其中变形菌门和放线菌门为优势菌门;鞘氨醇单胞菌属、醋酸杆菌属和短根瘤菌属等为主要优势属。
2)3组样品真菌多样性及丰度有差异显著,其中担子菌门和子囊菌门为优势菌门,但染病前后相对丰度差异显著;维希尼克氏酵母属、壳针孢属和汉纳酵母属等染病前后相对丰度差异显著。
3)初步推测尾孢菌属为病原菌。
【参考文献】
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1993.
Editorial Committee of Flora of China. Flora of China[M]. Beijing: Science Press, 1993.
[2]林士杰,张忠辉,谢朋,等.中国水曲柳基因资源的保护与利用[J].中国农学通报,2009,25(24):158-162.
LIN S J, ZHANG Z H, XIE P, et al. Conservation and application of the genetic resource of Fraxinus mandshurica in China[J]. Chinese Agricultural Science Bulletin, 2009, 25(24): 158-162.
[3]HU L J, KENTARO U, SHEN H L, et al. Nuclear DNA microsatellites reveal genetic variation but a lack of phylogeographical structure in an endangered species, Fraxinus mandshurica, across North-east China[J]. Annals of Botany, 2008, 102(2): 195-205.
[4]张新洁,陆天宇,孙海龙,等.氮磷添加对水曲柳化学计量特征和养分再吸收的影响[J].森林工程,2019,35(5):16-21.
ZHANG X J, LU T Y, SUN H L, et al. Effects of nitrogen and phosphorus addition on nutrient stoichiometry and resorption of Fraxinus mandshurica[J]. Forest Engineering, 2019, 35(5):16-21.
[5]李婷婷,杨柳,李晓霞,等.水曲柳和蒙古栎光合特性和生长对不同氮素形态的响应[J].植物研究,2023,43(2):207-217.
LI T T, YANG L, LI X X, et al. Different nitrogen forms on the photosynthetic characteristics and growth of Fraxinus mandshurica and Quercus mongolica[J]. Bulletin of Botanical Research, 2023, 43(2): 207-217.
[6]ZHAN Y. Comparing the effects of N and P deficiency on physiology and growth for fast-and slow-growing provenances of Fraxinus mandshurica[J]. Forests, 2021,12(12): 1760.
[7]朱美如,矫春晶,安康明,等.贮藏温度和种子含水率对水曲柳种子活力指标的影响[J].东北林业大学学报,2022,50(3):9-12,18.
ZHU M R, JIAO C J, AN K M, et al. Effects of storage temperature and water content on germination of dormancy-released Fraxinus mandshurica seeds[J]. Journal of Northeast Forestry University, 2022, 50(3):9-12, 18.
[8]ZHANG X, ZHANG C, ZHAO X. Effect of sex ratio, habitat factors and neighborhood competition on stem growth in the dioecious tree Fraxinus mandshurica[J]. Ecological Research, 2014, 29(2): 309-317.
[9]崔靖弘,于磊,梁楠松,等.水曲柳CUC1基因克隆及瞬时表达分析[J].林业科学研究,2022,35(1):82-91.
CUI J H, YU L, LIANG N S, et al. Cloning and transient expression analysis of CUC1 gene from Fraxinus mandshurica Rupr.[J]. Forest Research, 2022, 35(1): 82-91.
[10]YU L, LI X, TIAN H, et al. Effects of hormones and epigenetic regulation on the callus and adventitious bud induction of Fraxinus mandshurica Rupr.[J]. Forests, 2020, 11(5): 590.
[11]LIU Y, WEI C, WANG H, et al. Indirect somatic embryogenesis and regeneration of Fraxinus mandshurica plants via callus tissue[J]. Journal of Forestry Research, 2021, 32(4): 1613-1625.
[12]耿冰.水曲柳培育技术[J].科技创新与应用,2017,186(2):290-291.
GENG B. Cultivation technology of Fraxinus mandshurica[J]. Technology Innovation and Application, 2017, 186(2): 290-291.
[13]高宇.水曲柳主要病虫害及其防治方法[J].长春大学学报,2014,24(10):1384-1388.
GAO Y. Diseases and insect pests of Fraxinus mandshuica and their control methods[J]. Journal of Changchun University, 2014, 24(10): 1384-1388.
[14]葛起新.浙江植物病虫志病害篇(第一集)[M].上海:上海科学技术出版社,1991.
GE Q X. Zhejiang plant pests and diseases pests and diseases (Episode 1) [M]. Shanghai: Shanghai Science & Technology Publishers, 1991.
[15]赵玉强,卓可儿,郭云,等.江苏句容地区薄壳山核桃褐斑病病原的分离与鉴定[J].植物病理学报,2022:1-5.
ZHAO Y Q, ZHUO K E,GUO Y, et al. Isolation and identification of the pathogen causing pecan brown spot in Jurong, Jiangsu[J]. Acta Phytopathologica Sinica, 2022: 1-5.
[16]谭延肖,郑现和,石莹,等.MpCYS4基因对苹果褐斑病病原菌侵染的响应表达及其转化株系抗性鉴定[J].核农学报,2020,34(10):2161-2167.
TAN Y X, ZHENG X H, SHI Y, et al. Response of MpCYS4 gene to Diplocarpon mali infection and pathogen resistance assay in transgenic apple plants[J]. Acta Agriculturae Nucleatae Sinica, 2020, 34(10): 2161-2167.
[17]楊帆,夏馨蕊,沈李元,等.抗松针褐斑病湿地松胚性愈伤组织的超低温保存[J].分子植物育种,2020,18(15):5097-5105.
YANG F, XIA X R, SHEN L Y, et al. Cryopreservation of embryogenic callus of Pinus elliottii with resistance to brown spot needle blight[J]. Molecular Plant Breeding, 2020,18(15): 5097-5105.
[18]LLORENTE I, MORAGREGA C, RUZ L, et al. An update on control of brown spot of pear[J]. Trees, 2012, 26(1): 239-245.
[19]HUANG F, FU Y, NIE D, et al. Identification of a novel phylogenetic lineage of Alternaria alternata causing citrus brown spot in China[J]. Fungal Biology, 2015, 119(5): 320-330.
[20]JANISIEWICZ W J, KORSTEN L. Biological control of postharvest diseases of fruits-annual review of phytopathology[J]. Fruit Decay Biocontrol Microbial Interaction Microbial Antagonists, 2002, 40(1): 411.
[21]LUO C, TSEMENTZI D, KYRPIDES N, et al. Direct comparisons of Illumina vs. Roche 454 sequencing technologies on the same microbial community DNA sample[J]. PLoS ONE, 2012, 7(2): e30087.
[22]KIRCHER M, KELSO J. High-throughput DNA sequencing concepts and limitations[J]. Bioessays, 2010, 32(6): 524-536.
[23]邓世林,申东晨,潘理,等.高通量测序法分析感杨树灰斑病前后叶围微生物多样性[J].东北林业大学学报,2020,48(5):104-106.
DENG S L, SHEN D C ,PAN L, et al. Leaf microbial diversity before and after Phyllosticta populea Sacc by high-throughput sequencing[J]. Journal of Northeast Forestry University, 2020,48(5):104-106.
[24]SATOSHI Y, HAYATO M, SHIN A, et al. Relationship between the decomposition process of coarse woody debris and fungal community structure as detected by high-throughput sequencing in a deciduous broad-leaved forest in Japan[J]. Plos One, 2015,10(6): e131510.
[25]謝宪,梁军,张铭,等.赤松枯梢病叶内生真菌多样性研究[J].生物技术通报,2020,36(2):119-125.
XIE X, LIANG J, ZHANG M, et al. Endophytic fungi diversity in the needles of Pinus densiflora with Sphaeropsis sapinea[J]. Biotechnology Bulletin, 2020, 36(2):119-125.
[26]张丽娜,朱天辉,杨佐忠,等.灰斑病对山茶叶部真菌群落的影响[J].四川农业大学学报,2011,29(3):378-385.
ZHANG L N, ZHU T H, YANG Z Z, et al. Influence of camellia gray spot disease on foliar fungal communities[J]. Journal of Sichuan Agricultural University, 2011, 29(3):378-385.
[27]STURZ A V. Bacterial endophytes: Potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences, 2000, 19(1):1-30.
[28]甄泉.北京市空气细菌群落特征及其影响因素研究[D].北京:中国科学院大学,2018.
ZHEN Q. Characterization of airborne bacterial communities and their influencing factors in Beijing[D]. Beijing: University of Chinese Academy of Sciences, 2018.
[29]方建波.不同林型空气细菌群落特征研究[D].广州:华南农业大学,2018.
FANG J B. Bacterial community characteristics of different forest types[D]. Guangzhou: South China Agricultural University, 2018.
[30]黄彩微,廖映辉,张琪,等.凉山州龙肘山锈红杜鹃与薄叶马银花根部真菌分子检测[J].微生物学通报,2017,44(5):1108-1120.
HUANG C W, LIAO Y H, ZHANG Q, et al. Molecular diagnosis of root-associated fungi of Rhododendron bureavii and R.leptothrium in Longzhou mountain of Liangshan Autonomous Prefecture[J]. Microbiology China, 2017, 44(5):1108-1120.
[31]DELMOTTE N, KNIEF C, CHAFFRON S, et al. Community proteogenomics reveals insights into the physiology of phyllosphere bacteria[J]. Proceedings of the National Academy of Sciences - PNAS, 2009, 106(38): 16428-16433.
[32]STONE B, JACKSON C R. Biogeographic patterns between bacterial phyllosphere communities of the Southern Magnolia (Magnolia grandiflora) in a small forest[J]. Microbial Ecology, 2016, 71(4): 954-961.
[33]赵卫松,郭庆港,苏振贺,等.马铃薯健株与黄萎病株根际土壤真菌群落结构及其对碳源利用特征[J].中国农业科学,2021,54(2):296-309.
ZHAO W S, GUO Q G, SU Z H, et al. Characterization of fungal community structure in the rhizosphere soil of healthy and diseased-verticillium wilt potato plants and carbon source utilization[J]. Scientia Agricultura Sinica, 2021, 54(2): 296-309.
[34]PETER G, ROSA C. Biodiversity and ecophysiology of yeasts[M]. Berlin: Springer VERLAG, 2006.
[35]FELIX C R, ANDRADE D A, ALMEIDA J H, et al. Vishniacozyma alagoana sp. nov. a tremellomycetes yeast associated with plants from dry and rainfall tropical forests[J]. International Journal of Systematic and Evolutionary Microbiology, 2020, 70(5): 3449-3454.
[36]王艷.甘肃省药用植物球壳孢目真菌病害及其病原研究[D].兰州:甘肃农业大学,2013.
WANG Y. Study on the diseases and pathogens of sphaeropsidales on medicinal plants in Gansu Province[D]. Lanzhou: Gansu Agricultural University, 2013.
[37]宁祎,李艳玲,李媛,等.桃儿七茎叶组织内生真菌多样性[J].生态学报,2017,37(15):5157-5166.
NING Y, LI Y L, LI Y, et al. Diversity of endophytic fungi from the stem and leaf of Sinopodophyllum hexandrum (Royle) Ying[J]. Acta Ecologica Sinica, 2017, 37(15):5157-5166.
[38]程欢,张东华,张俊忠,等.苹果砧木T337不同组织内生菌群落及其功能预测[J].江苏农业科学,2022,50(14):144-154.
CHENG H, ZHANG D H, ZHANG J Z, et al. Prediction of endophytic communities and their functions in different tissues of apple rootstock T337[J]. Jiangsu Agricultural Sciences, 2022, 50(14): 144-154.
