老年2型糖尿病患者营养风险指数与骨密度的关系
2024-01-18蒋瑞妹谢树永
张 雪 蒋瑞妹 谢树永 李 娟 牛 敏
2 型糖尿病(T2DM)是世界上最常见和增长最快的疾病之一[1],随着老龄化人口的增长和生活方式的改变,骨质疏松症(OP)的患病率也正在增加,37.8%的中国糖尿病患者患有骨质疏松症[2]。与正常群体相比,T2DM患者拥有相同甚至更高的骨矿密度(BMD)的情况下,骨微结构和材料强度属性的改变可能导致对载荷和应力的抵抗力的降低,导致骨折风险增加[3],骨折后结果更差,包括死亡率增加。因此,及早识别老年T2DM患者易发生骨质疏松的高危人群至关重要。既往临床研究发现,年龄、性别、维生素D、肌肉力量和营养状况是骨质疏松症的危险因素。老年人由于其特定的代谢特点容易出现营养不良。老年人营养风险指数(GNRI)是根据血清白蛋白水平和当前实际体质量与理想体质量的比率计算得出的。既往研究表明,GNRI不仅与心力衰竭[4]、慢性肾脏疾病有关,而且可以预测老年住院患者的肌肉功能障碍及营养相关并发症。各种研究[5]发现GNRI与骨密度和骨质疏松症有显著的相关性。T2DM患者患骨质疏松症的风险比正常人群偏高,虽然既往研究证明了普通人群中骨质疏松的危险因素,但由于代谢性疾病的特殊性,T2DM患者骨质疏松危险因素可能存在不同。因此,评估骨质疏松症的预测因素如营养状况对老龄T2DM患者具有重要意义。本研究探讨GNRI与骨质疏松的关系,目的是评估GNRI是否可以可靠地反映老年T2DM患者的骨量丢失。
1 资料与方法
1.1 一般资料 对本医院内分泌科2022年1月-2023年1月收治的208 例老年T2DM患者进行横断面观察研究。纳入患者根据DXA测量的结果被分为骨质疏松组(129 例患者)和非骨质疏松组(79 例患者),骨质疏松组患者平均年龄(68.57±9.64)岁,其中女性105 例,男性24 例;非骨质疏松组患者平均年龄(68.57±9.64)岁,其中女性61 例,男性18 例。两组患者性别、年龄等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准 ①纳入标准:老年2 型糖尿病患者,2 型糖尿病的诊断标准以1999年世界卫生组织为依据。②排除标准:患有影响骨代谢或营养状况的疾病,如恶性肿瘤、严重肝肾疾病、垂体相关疾病、甲状腺和甲状旁腺疾病、肾上腺疾病、类风湿性关节炎和急性炎症性疾病;长期卧床不起的个人;正在使用维生素D、钙、双磷酸盐、鲑降钙素、糖皮质激素等影响骨代谢药物的个人。
1.3 检查指标 ①生化信息:禁食至少8 h后采集血清标本,测定白蛋白、空腹血糖、空腹C肽、糖化血红蛋白、血钙水平。②双能X线骨密度仪(DXA)测量:采用DXA进行腰椎(L1-4)、股骨颈的骨密度测量,T值=(测量值-骨峰值)/正常成人骨密度标准差。根据1994年世界卫生组织定义骨质疏松症的标准即T值≤-2.5 的标准差,分类标准适用于绝经后妇女和50 岁及以上男子。③定量CT(QCT)测量:采用东软128 排螺旋CT机和使用美国Mindways公司的3D测量模式进行椎体松质骨的骨密度测量,计算各相邻2 个椎体BMD值,即BMD L1/L2。以BMD L1/L2<80 mg/cm3为骨质疏松。④老年人营养风险指数GNRI计算:GNRI=[1.489×白蛋白(g/L)]+[41.7×(体质量/WLO)]。WLO代表理想体质量(kg),计算公式如下:男性:身高(cm)-100-[(身高(cm)-150)/4]。女性:身高(cm)-100-[(身高(cm)-150)/2.5]。
1.4 统计学分析 数据用SPSS 25.0 统计软件进行分析,数据分布采用K-S法检验。数据服从正态分布的采用均值±标准差表示,用两独立样本t检验(含校正t检验)进行组间比较。数据不符合正态分布的采用M(P25,P75)表示,用Mann-Whitney U检验进行组间比较。此外,应用Pearson相关分析来确定GNRI与BMD之间的相关性。采用Logistic回归分析评估GNRI与骨质疏松症的关系。P<0.05 表示差异具有统计学意义。
2 结 果
2.1 基本数据比较 本研究糖尿病患者的基本资料和实验室数据列于表1,经比较:较之非骨质疏松组,骨质疏松组患者的多项指标(BMI、HbA1c、空腹C肽、白蛋白、血钙、BMI、GNRI)均较非骨质疏松组偏低(P<0.05)。此外,骨质疏松组患者的DXA测量的腰椎、股骨颈面积骨密度以及QCT测量的腰椎体积骨密度绝对值,亦明显小于非骨质疏松组,差异有统计学意义(P<0.05)。见表1。
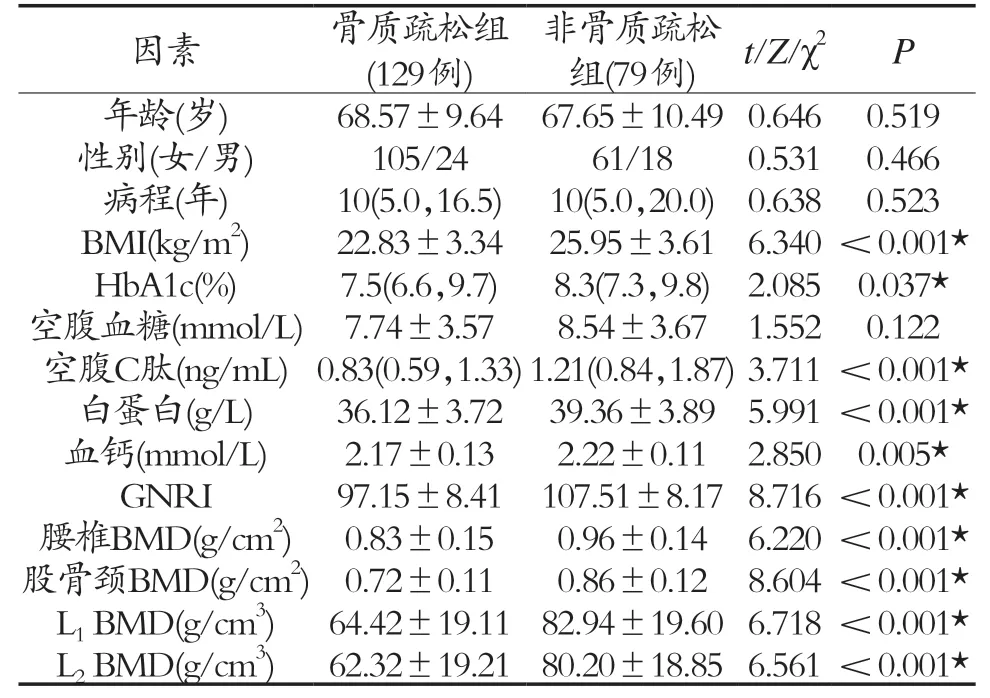
表1 糖尿病合并骨疏组以及非合并骨疏组的基本数据比较
2.2 糖尿病患者的DXA面积、QCT体积骨密度值骨密度值与营养指标的相关分析 经Pearson相关分析,老年糖尿病患者人群的白蛋白、血钙、BMI、GNRI等4 项指标与DXA检测结果之面积骨密度(腰椎BMD、股骨颈BMD)、QCT检测结果之腰椎体积骨密度(L1BMD、L2BMD)均成正相关(P<0.05),见表2。提示:GNRI与糖尿病患者的骨密度呈正相关变化关系。
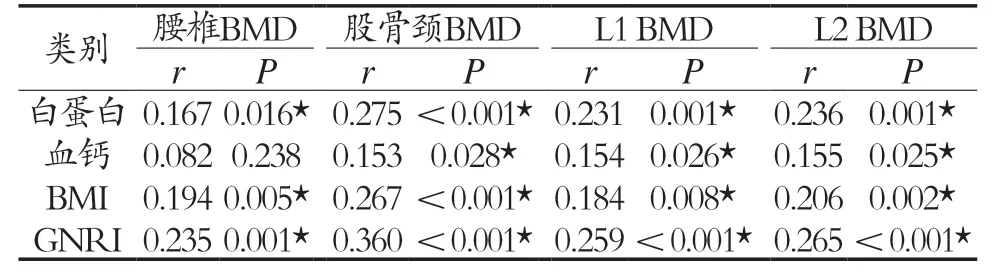
表2 糖尿病患者骨密度值与营养指标的相关性研究
2.3 糖尿病合并骨质疏松的多因素Logistic回归分析 以是否合并骨质疏松作为因变量(赋值是=1,否=0),以HbA1c、空腹C肽、血钙、GNRI等指标/因素(均在前述单因素分析中P<0.05)作为自变量,通过Logistic回归分析相关因素与骨质疏松症的关系,结果表明老年人营养风险指数GNRI与骨质疏松密切关联(P<0.05),见表3。

表3 糖尿病合并骨质疏松的多因素Logistic回归分析结果
3 讨 论
老年T2DM合并骨质疏松的人群中BMI、血清白蛋白、GNRI显著低于未合并骨质疏松组,GNRI值较高的患者骨密度水平较高,GNRI与骨密度呈正相关。低GNRI值是老年T2DM患者骨质疏松的独立危险因素,此外,与单独的白蛋白和BMI相比,GNRI对骨质疏松的预测性更强。
T2DM人群中,特别是患有代谢紊乱和胰岛素抵抗的老年患者,无法正常利用葡萄糖,导致脂肪和蛋白质分解增加,因此通常会有营养不良。Corcoran C等[6]研究强调了在普通老年人群中,营养支持在预防和治疗骨质疏松性骨折中的重要性,这种营养方法可以改善髋部骨折后的临床结果,并减缓骨折后一年股骨近端骨密度的下降,显著减少康复住院时间。因此,重要的是确定有效的筛查骨质疏松的工具,可以保护老年人避免骨量丢失以及骨质疏松症相关并发症的影响,目前常用的筛查工具包括NRS2002 量表、微型营养评估(MNA)、老年营养危险指数(GNRI)、营养不良筛查工具(MST)等。GNRI综合了白蛋白、身高和体质量等多种指标,可以更全面、更有效、更客观地评估营养风险。糖尿病患者骨质疏松症的发病机制比较复杂,不仅涉及衰老及代谢紊乱,而且还涉及营养不良,从而增加骨吸收的比例,导致骨丢失以及脆性骨折的发生。DXA评估骨几何形状的能力有限,不能区分皮质骨和骨小梁。QCT能精确测量松质骨和皮质骨的体积密度,更能反映机体骨质疏松程度[7]。故本研究中,纳入的糖尿病人群同时进行DXA和QCT的检测,结果显示无论何种检测方法,GNRI与骨密度成正相关。
本研究同时发现糖尿病患者的空腹C肽、HbA1c与BMD相关,一般情况下胰岛功能较差的患者血糖控制差,骨密度下降幅度较大,原因是当胶原中的葡萄糖水平较高时会产生大量的糖基化终产物,影响骨骼强度,诱导骨细胞凋亡,导致骨异常生长[8]。另一方面,T2DM患者胰岛素合成代谢不足导致糖尿病骨量丢失[9]。本研究发现营养不良在T2DM患者低水平的骨密度中起一定作用,低GNRI是T2DM患者骨密度降低和骨质疏松的重要危险因素。目前对GNRI与骨质疏松症之间联系的机制可能如下:首先,维持成年人的骨骼健康需要充足的供应膳食蛋白质的含量,适当的蛋白质摄入可以帮助老年人抵抗肌肉损失和提高身体协调性。其次,既往研究表明肌肉可以通过分泌骨骼因子如胰岛素样生长因子1、6、15(IGF-1、IL-6、IL-15)、碱性成纤维细胞生长因子、肌肉生长抑素等,以及通过施加体力来影响骨骼[10]。最后,Tomlinson DJ等[11]认为,骨骼可以从高BMI与中等到剧烈的运动和最佳饮食相结合中受益,原因是施加在骨骼上的机械负荷增加的结果。因此,高肌力、高IGF-1、高负荷可能为GNRI与骨质疏松的相关性机制提供证据。
总之,GNRI较高的老年人在骨密度上拥有更高的数值,表明它可能是识别需要进一步行骨健康营养支持的老年人的一个指标,应重视上述参数的干预,积极开展预防骨质疏松的健康教育,有利于改善老年T2DM患者的预后。
