关中奶山羊发情期不同时段宫颈阴道粘液非靶向代谢组学比较分析研究
2024-01-18冉本康郭松茂王立强孟智利李延华王军宁李芳娥杜烨青胡建宏
冉本康,李 宇,贤 明,郭松茂,王立强,孟智利,李延华,王军宁,李芳娥,杜烨青,胡建宏*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2.富平县华拓畜牧科技有限公司,陕西 富平 711700;3.陕西关中奶山羊专业合作社,陕西 富平 711700;4.陕西澳尼克奶山羊育种有限公司,陕西 富平 711700)
在规模化、现代化畜牧业中,人工授精是常见的辅助生殖技术。奶山羊发情鉴定普遍采用公羊试情和外部观察的传统方法,极大程度上增加了养殖企业的劳动成本且鉴定准确率低,较难达到适时输精的目的,加之奶山羊子宫颈口复杂结构的先天限制,导致奶山羊人工授精受胎率偏低[1-2]。在其它哺乳动物的研究上发现,一些物质可作为潜在的发情标志物。Pluta等[3]借助固相微萃取结合气相色谱-质谱联用技术检测奶牛发情周期不同阶段宫颈阴道粘液中的差异物质,筛选出奶牛发情的可能标志物是2-戊酮和4-甲基-2-戊酮。乔征磊[4]对圈养东北虎发情期尿液中的挥发物与非繁殖期做了对比,结果获得了雌雄虎之间用于传递发情信息的信息素各1种,分别是苯酚和2-苯乙胺,以及可能用于性别识别的雄性信息素3种和雌性信息素7种。Mozūraitis等[5]检测了奶牛发情不同时间段粪便的挥发性有机化合物,结果表明乙酸和丙酸的丰度显示出了可重复的时间模式。Sankar等[6]采用气相色谱-质谱检测奶牛发情各阶段粪便中的挥发性物质,发现乙酸、丙酸等物质特异性地存在于奶牛发情期,说明这些物质可作为奶牛发情及排卵的指示物质。因此,筛选关中奶山羊发情期不同时间段差异代谢产物能够从分子层面帮助研究关中奶山羊的发情规律,进而开发基于靶向目标代谢物的发情鉴定新技术。非靶向代谢组学手段由于其高通量、高灵敏度的优势可对生物体组织、体液、细胞培养物等的代谢状态进行分析,进而筛选出不同生理状态下的差异代谢物[7-9]。
基于此,本研究利用GC-MS探索关中奶山羊发情期特有的宫颈阴道分泌物中的代谢物随发情期不同时间段的变化,为关中奶山羊发情鉴定技术提供新的思路和理论资料。
1 材料与方法
1.1 试验动物及饲养管理
本试验用羊由富平县某关中奶山羊育种有限公司提供,3只体重在40~50 kg,2~3岁经产、体质健康的母羊。试验场地为半开放附带活动场式羊舍。试验时间为2021年8月中旬,试验期定期投喂常规日粮,自由饮水。
1.2 发情鉴定及样品采集
试验期间每天密切监视母羊发情迹象(摇尾、鸣叫、外阴分泌物),早晚两次牵引公羊,挂试情布进行试情。公羊开始爬跨即确定发情,于每只母羊发情0~12 h(A组),12~24 h(B组),24~36 h(C组)使用开膣器,注射器连接一次性细管抽取发情母羊宫颈阴道粘液,-20 ℃保存待测,粘液采集顺序为母羊发情顺序。
1.3 宫颈阴道粘液代谢物提取
精确移取样本50 μL于2 mL EP管中,准确加入1 mL乙腈:异丙醇:纯水(3∶3∶2)混合溶液(-20 ℃),涡旋震荡 30 s,室温超声5 min,12 000 rpm离心2 min,取上清液500 μL加入到一新的2 mL EP管中,真空浓缩仪浓缩至尽干(8~10 h),剩余上清液放置-80 ℃冰箱备份,在浓缩尽干的样品中,加入80 μL的20 mg/mL 的甲氧胺吡啶溶液复溶,涡旋震荡30 s,60 ℃孵育60 min,再最后加入100 μL BSTFA-TMCS (99∶1)衍生化试剂,涡旋震荡30 s,70 ℃孵育90 min,14 000 rpm离心3 min,取上清液90~100 μL加入到检测瓶中,样品放置于密封盅内暂存待测,并于24 h内完成GC-TOF上机检测。
1.4 上机检测
气相色谱采用DB-5MS毛细管柱(30 m × 250 μm i.d.,0.25 μm film thickness,Agilent J &W Scientific,Folsom,CA,USA)以1 mL/min的恒流氦气来分离衍生化物质,1 μL样品以分流比1∶10的方式通过自动进样器注入。进样口温度为280 ℃,传输线和离子源温度分别为320 ℃和230 ℃。升温程序以50 ℃为初始温度,持续0.5 min,以15 ℃/min的速率上升到320 ℃,并在320 ℃停留9 min。质谱采用的是全扫描方法,扫描速率是 10 spec/s,Electron Energy是-70 V,溶剂延时3 min。
1.5 质量控制
由图1可知,红色QC样本聚集,重复性良好,说明系统稳定。

图1 QC样本PCA得分图
1.6 数据统计分析
使用ABF Converter软件将仪器检测得到的“mzML”格式数据转化成“abf”格式,再使用MS DIAL软件对质谱数据进行了峰提取、基线过滤、校正、解卷积、峰对齐,采用Fiehn气质数据库对代谢物进行鉴定,并进行相对定量分析。
2 结果与分析
2.1 发情期不同时段宫颈阴道粘液组间代谢物多元分析
2.1.1 主成分分析(PCA) 如图2所示,样本全部处于95%置信区间。此外R2X为判别PCA模型质量可解释度的主要参数,如表1所示,组间R2X均大于0.5,表明PCA模型可靠。
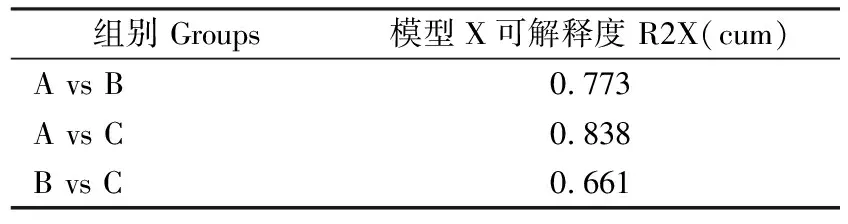
表1 PCA模型验证参数

图2 PCA得分图
2.1.2 正交偏最小二乘法判别分析(OPLS-DA) 由图3可见,3个时间组完全分离,进一步表明发情期关中奶山羊不同时段宫颈阴道粘液代谢物存在显著差异。由表2可见,0~12 h vs 24~36 h的OPLS-DA模型参数R2Y(cum)=0.996、Q2(cum)=0.902均大于0.5,表明模型建立较好,所获得的数据可用于差异代谢物的筛选。

表2 OPLS-DA模型验证参数
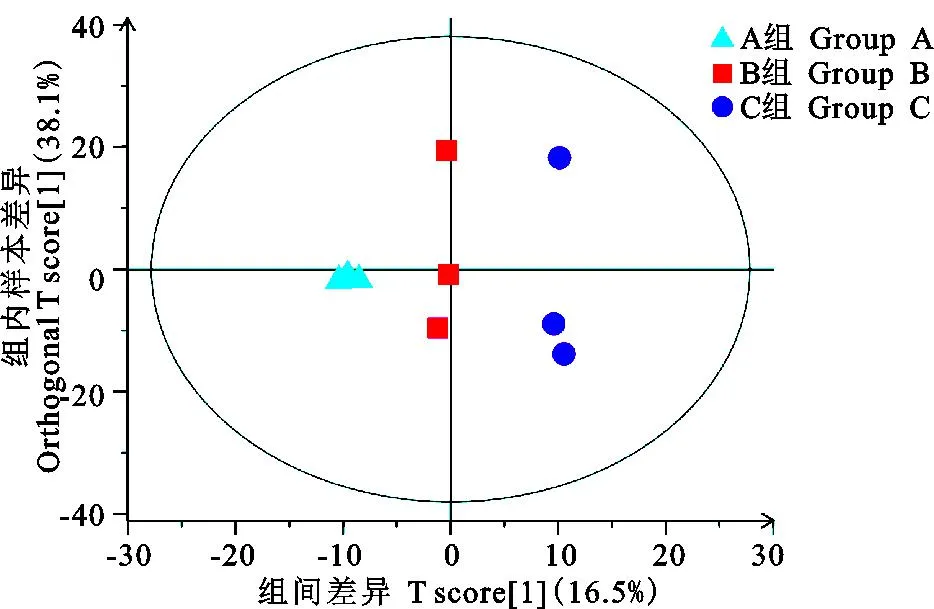
图3 正交偏最小二乘法判别分析
2.2 发情期宫颈阴道粘液差异代谢物筛选
2.2.1 差异代谢物筛选结果 差异代谢物如表3所示,将0~12 h和12~24 h的宫颈阴道粘液相互比较,筛选出6种差异代谢物;将0~12 h和24~36 h的宫颈阴道粘液相互比较,筛选出14种差异代谢物;将12~24 h和24~36 h的宫颈阴道粘液相互比较,筛选出3种差异代谢物;由倍性变化的log2值可知,0~12 h vs 12~24 h有5种上调的差异代谢物,1种下调的差异代谢物;0~12 h vs 24~36 h有6种差异代谢物上调,8种下调;12~24 h vs 24~36 h无差异代谢物上调,有3种下调。

表3 发情期不同时段关中奶山羊宫颈阴道粘液差异代谢物
2.2.2 典型差异代谢物统计分析 由图4可见,三个时间段相比较,共有的差异代谢物有2,3-二氨基丙酸、半乳糖基甘油、2-羟基丁酸、亚牛磺酸、D-无水葡萄糖、D-半乳糖、邻苯二甲酸二乙酯。在发情期0~36 h内,2-羟基丁酸、D-无水葡萄糖、D-半乳糖、邻苯二甲酸二乙酯的含量总体呈现上升趋势,2,3-二氨基丙酸、半乳糖基甘油、亚牛磺酸的含量显著下降。

图4 典型差异代谢物柱状图
2.3 差异代谢物层次聚类分析
聚类分析可以清楚地了解差异代谢物间的相似或互补关系[10],图5中横轴表示不同时间组,纵轴表示相应的差异代谢物,红色和蓝色分别表示高和低的表达量。在发情期0~12 h与12~24 h奶山羊宫颈阴道粘液对比中(图5a),半乳糖基甘油、2,3-二氨基丙酸、N-乙酰己糖胺、亚牛磺酸、甘油在0~12 h高表达,在12~24 h低表达。2-羟基丁酸在0~12 h低表达,在12~24 h高表达;在发情期0~12 h与24~36 h奶山羊宫颈阴道粘液对比中(图5b),1,5-酐-D-山梨糖醇、D-果糖、2,3-二氨基丙酸、半乳糖基甘油、尿素、亚牛磺酸在0~12 h高表达,在24~36 h低表达;D-无水葡萄糖、D-半乳糖、2-羟基丁酸、苯甲醇、尿嘧啶、氨基丙二酸、己醛糖、邻苯二甲酸二乙酯在0~12 h低表达,在24~36 h高表达;在发情期12~24 h与24~36 h奶山羊宫颈阴道粘液对比中(图5c),DL-2-羟基丁酸、N-乙酰己糖胺、D-无水葡萄糖在12~24 h低表达,在24~36 h高表达。
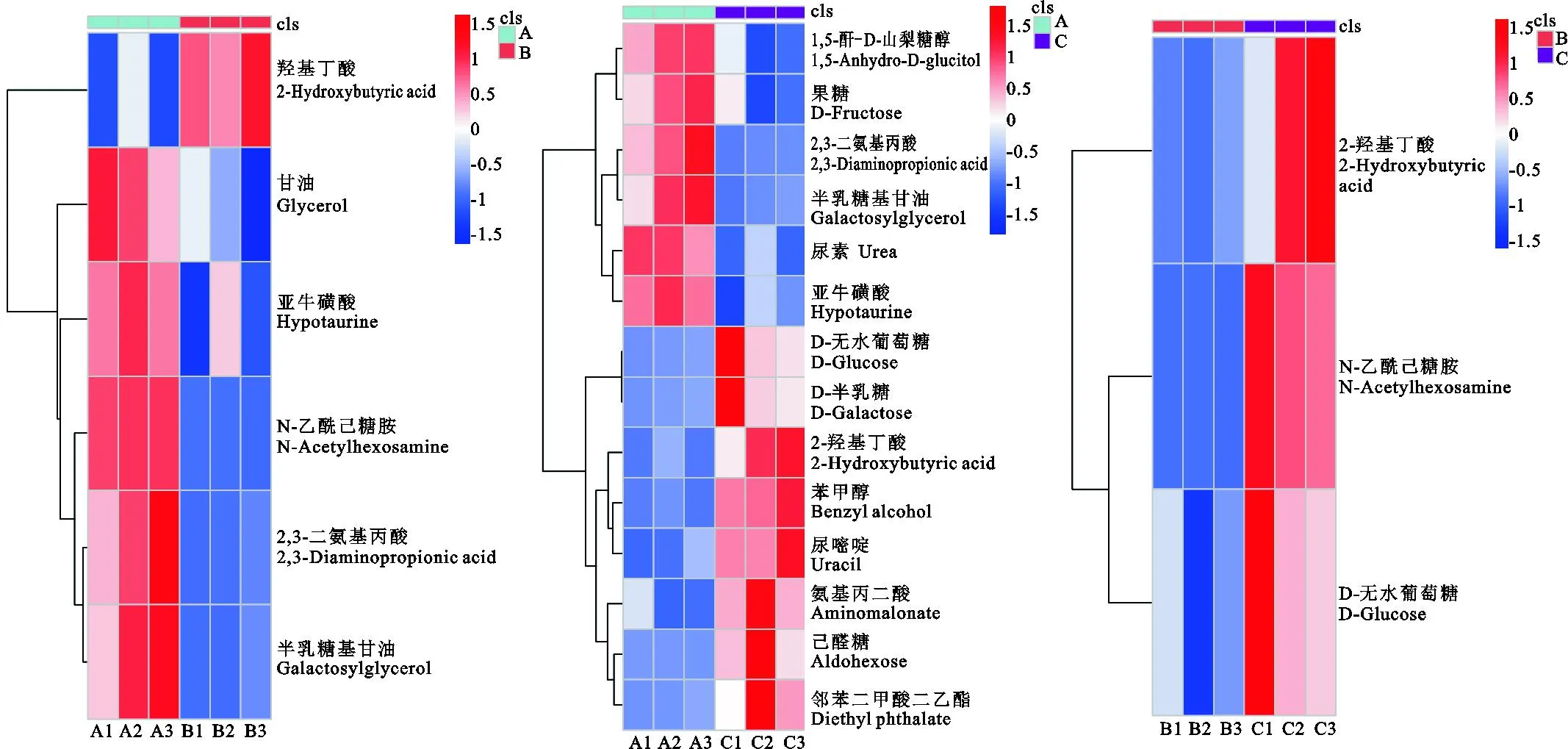
图5 差异代谢物层次聚类分析
2.4 差异代谢物代谢通路分析
对差异代谢物进行KEGG通路富集分析,0~12 h vs 12~24 h的差异代谢物分布于9条代谢通路中(表4),其中6条通路存在显著差异(P<0.05),分别是半乳糖代谢、甘油酯代谢、脂解的调控、逆行类内信号、牛磺酸和亚牛磺酸代谢、热成因。其中甘油酯代谢通路最为显著,P值为0.0018648,-log(p)为6.2846,有2个差异代谢物富集于此代谢通路上,分别为甘油和半乳糖基甘油;0~12 h vs 24~36 h的差异代谢物分布于33条代谢通路中(见表5),其中11条通路存在显著差异(P<0.05),最显著的通路为半乳糖代谢,有3个差异代谢物富集于此通路,分别为D-无水葡萄糖、D-半乳糖、半乳糖基甘油;12~24 h vs 24~36 h的差异代谢物分布于24条代谢通路中(见表6),其中20条通路存在显著差异(P<0.05),最显著的通路为非酒精性脂肪肝病通路,富集于此通路的差异代谢物为D-无水葡萄糖。
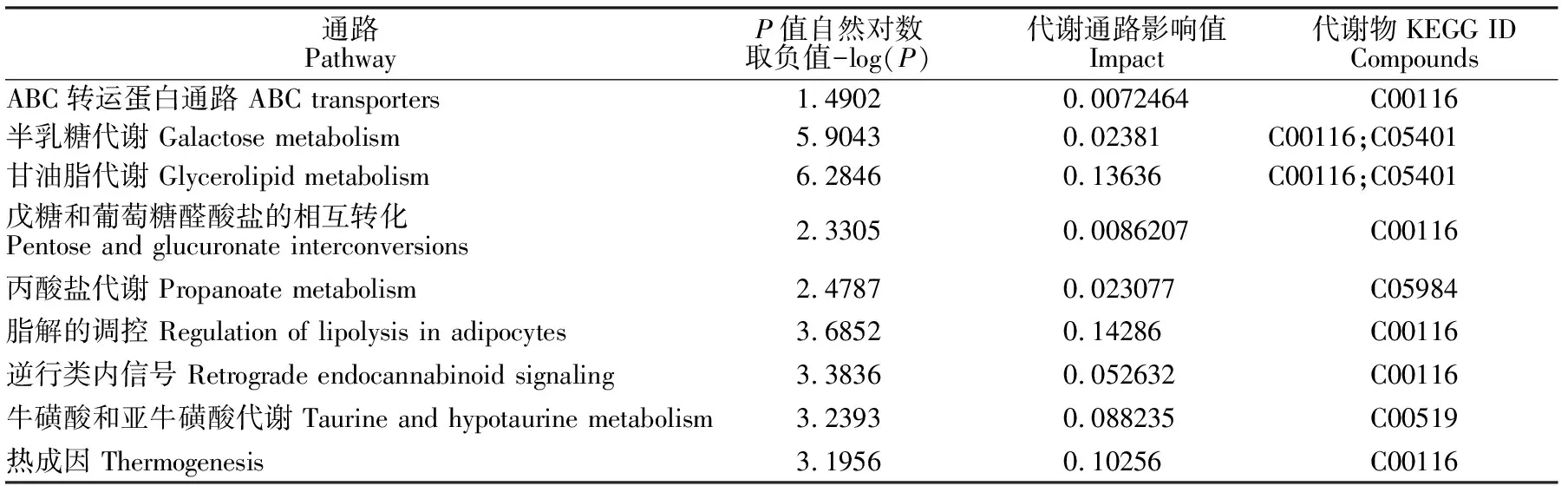
表4 0~12 h vs 12~24 h差异代谢物代谢通路分析

表5 0~12h vs 24~36h差异代谢物代谢通路分析

表6 12~24 h vs 24~36 h差异代谢物代谢通路分析
3 讨 论
哺乳动物的发情行为是一项复杂的生物学过程,涉及到不同生殖激素内分泌,机体不同代谢途径的共同调节[11]。本研究首次通过非靶向代谢组学手段检测发情期关中奶山羊宫颈阴道粘液中的代谢产物,来揭示关中奶山羊发情状况随时间变化的代谢特征以及相关的代谢途径。在发情期关中奶山羊宫颈阴道粘液中共鉴定出221种不同的代谢产物,通过不同时段对比筛选出差异代谢物共16种,这些差异代谢物与关中奶山羊发情期性信息素的形成有关。通过对差异代谢物的分析,可寻找母羊发情期所释放的特异性化学信号,提示代谢组学手段对生物代谢网络及生理活动的认识具有重要意义。
宫颈阴道粘液的分泌是一个连续的过程,其成分、数量、物理和生化特性受雌性动物的发情周期和健康状况的影响,因此采集宫颈阴道粘液的数量和质量会因采样时间的不同而有显著差异[12]。宫颈阴道粘液的生化结构复杂,是由流入阴道腔的宫颈粘液以及阴道壁渗出液、外阴分泌物、脱落的阴道上皮细胞和菌群分泌物组成[13]。其成分受多种变量的影响,如动物机体的内分泌状态以及pH等。在类固醇激素的控制下,排卵期的宫颈阴道粘液比发情周期的其他时间更具流体性、粘性更小并且具有高的pH[14],与本研究中2,3-二氨基丙酸、2-羟基丁酸、亚牛磺酸、氨基丙二酸的含量变化特征一致,具有酸性的代谢产物共同构建了关中奶山羊发情周期生殖道的pH环境。与Causey[15]对母马的宫颈粘液研究结果一致,关中奶山羊宫颈阴道粘液含水(90%~98%)和无机离子、氨基酸、胆固醇、脂质、葡萄糖、抗坏血酸、多糖、粘蛋白、血浆蛋白、酶和杀菌蛋白。粘液的凝胶特性取决于黏蛋白,黏蛋白是粘液中的主要结构蛋白,是通过二硫键连接在一起的大型糖基化聚合物分子[16]。在0~12 h对比24~36 h中,氨基酸代谢物2-羟基丁酸、氨基丙二酸含量显著升高,与粘液中黏蛋白含量上升,发情后期宫颈阴道粘液粘稠结构的形成有关,由黏蛋白构成的结构特性对后续精子的运动产生重要影响。
本研究中,0~12 h对比24~36 h,2-羟基丁酸、邻苯二甲酸二乙酯发生上调,与Yeoman等[17]关于人类女性生殖道代谢组学的分析结果有类似之处,2-羟基丁酸是人类细菌性阴道炎症诊断生物标志物2-甲基-2-羟基丁酸的前体物质,关中奶山羊发情期2-羟基丁酸的显著上调成因可能是由于阴道菌群结构改变进而产生的次生代谢物产物。邻苯二甲酸二乙酯是一类芳香族化合物[18],可能为母羊发情期释放气味信号的性信息素组成物质。结合2-羟基丁酸、邻苯二甲酸二乙酯在关中奶山羊发情初期至排卵时间段显著上升的现象,可推定2-羟基丁酸、邻苯二甲酸二乙酯为关中奶山羊发情行为可能的特异性化学信号。
关于代谢物注释,GC-MS分析技术在区分某些异构体的能力方面受到限制,例如D-半乳糖和D-无水葡萄糖,它们具有非常相似的保留时间 (RT) 和质谱碎片模式。另一个困难在于区分一些归类为碳水化合物及其衍生物的代谢物。在这种情况下,最丰富的特征片段和衍生产物几乎相同,因此注释仅限于这些糖的半缩醛构象[19]。本研究中碳水化合物、有机酸类别的相关差异代谢物发现在比较组之间具有区分性,0~12 h对比24~36 h中数据显示,己醛糖、D-半乳糖、D-无水葡萄糖水平呈现升高趋势,这支持了碳水化合物消化吸收对于发情及排卵行为启动的能量支撑作用。
宫颈阴道粘液中差异代谢物富集的代谢途径众多,牛磺酸和亚牛磺酸代谢、精氨酸生物合成、生物素代谢、甘油酯代谢、嘌呤代谢等通路中相关代谢物发生上调,矿物质吸收、胰岛素信号通路、催乳素信号通路、胰岛素信号通路、HIF-1信号通路、胰岛素阻抗、AMPK信号通路、胰高血糖素信号通路、范素和辅酶a的生物合成、β-丙氨酸代谢、味觉传导、磷酸戊糖途径、丙酸盐代谢、氨基糖与核苷酸糖等代谢通路中相关代谢物发生下调。糖类和脂质相关代谢通路的代谢物差异变化是动物机体为创造排卵期生殖道适宜的精子存活及之后的获能,受精环境的结果[20]。氨基酸、肽类、能量相关代谢通路的代谢物差异变化与宫颈阴道粘液物理结构的形成以及创造利于精子运动的物理环境和防止病菌感染的屏障作用相关。
4 结 论
本研究通过非靶向代谢组学技术筛选了关中奶山羊发情期不同时段宫颈阴道粘液的差异代谢物,这些差异代谢物参与了能量代谢、物质合成等多个代谢途径,研究内容反映了关中奶山羊发情期不同阶段的代谢差异,为后续新型发情鉴定技术的开发提供理论资料。
