重组酶聚合酶扩增结合侧向流动试纸条技术快速可视化检测嗜麦芽窄食单胞菌方法的建立与应用
2024-01-18高玉芝高绪柱
季 拓,高玉芝,王 彦,高绪柱*
1江苏大学附属连云港市第二人民医院中心实验室,江苏 连云港 222000;2南京医科大学康达学院附属连云港市第二人民医院中心实验室,江苏 连云港 222000
嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia,S.maltophilia,SMA)是一种革兰阴性条件致病菌,广泛存在于自然和医院环境中,是医院获得性感染的重要病原菌之一,位于临床分离的非发酵菌第三位[1],环境或临床分离株表现出多种抗生素和抗逆性表型[2]。SMA危及免疫功能低下人群的生命安全[3],最常见的临床表现是肺炎、菌血症、伤口感染和尿路感染[4]。目前,临床采用常规的生化培养法鉴定SMA耗时较久,易耽误治疗[1]。选择性培养基可以根据SMA 的分泌物产生颜色反应,以达到从混合菌株中鉴定SMA的目的[5],但该方法需要建立严格无菌的环境且周期较长。聚合酶链式反应(polymerase chain reaction,PCR)技术已被用于检测急性白血病或骨髓增生异常综合征化疗患者血液样本中的SMA[6],该方法虽然检测时间短、精度高,但受限于精密仪器和专业技术人员,难以打破实验室的壁垒,无法实现现场即时检测(point of care testing,POCT)。因此,建立一种便捷、灵敏的检测方法,对于快速诊断SMA至关重要。
重组聚合酶等温扩增技术(recombinase polymerase amplification,RPA)是一种不依赖于精密仪器、可在37 ℃恒温、短时间内扩增目的基因的核酸扩增技术[7-8]。侧向流动试纸条(lateral flow strips,LFS)是以纳米胶体金颗粒(Au nanopartical,AuNP)作为信号标签的纸基即时检测装置[9]。将LFS 与RPA 技术联合使用,可突破仪器和专业技术人员的限制,在较短时间内对扩增产物进行目视检测[10-11]。RPA-LFS反应原理如图1所示。

图1 RPA-LFS反应原理Figure 1 The principle of RPA-LFS
目前,RPA-LFS已经被成功用于肺炎链球菌[12]、肺炎克雷伯菌[13]、白色念珠菌[14]等病原菌的分子诊断[15]。而对于SMA,RPA-LFS 的检测方法还没有建立。本研究旨在建立一种改良的RPA-LFS技术,实现对SMA的快速检测。
1 材料和方法
1.1 材料
1.1.1 菌株来源本研究所用的标准菌株列于表1,均由连云港市第二人民医院提供。所有标准菌株保存于-80 ℃超低温冰箱,使用前于35 ℃微生物培养箱活化。为验证RPA-LFS技术对临床标本的适用性,于2022年1—12 月收集108 例临床检验样本,其中57 例来自痰液,30例来自尿液,21例来自血液。

表1 本研究所用标准菌株Table 1 Standard strains used in this study
1.1.2 主要仪器和试剂
微生物培养箱(上海BluePard 公司),震荡培养箱(上海旻泉公司),超微量分光光度计(Quawell 公司,美国),电热恒温水浴锅(上海精宏公司),电泳仪(Bio-Rad 公司,美国),全自动凝胶成像分析系统(上海培清公司),细菌基因组提取试剂盒(北京天根公司),基础型RPA试剂盒、nfo型RPA试剂盒、侧向流动试纸条(常州安普未来公司)。
1.2 方法
1.2.1 微生物基因组提取
将冻存的SMA接种于哥伦比亚血琼脂平板,置于35 ℃微生物培养箱培养24 h。挑取培养皿上的单菌落,置于5 mL Luria-Bertani 培养基中,在35 ℃振荡培养箱中震荡培养12 h。根据细菌基因组提取试剂盒说明书提取SMA 基因组DNA,保存于-20 ℃备用。基因组DNA 浓度使用超微量分光光度计定量。其他标准菌株和临床分离的SMA 使用加热煮沸法提取DNA。菌株培养后,挑取菌苔置于100 μL Tris-EDTA 中,100 ℃加热煮沸10 min,释放基因组DNA。基因组提取液冷却后,12 000 r/min 离心5 min,取上清转移至无菌EP 管,保存于-20 ℃备用。用于RPA-LFS检测的临床样本,使用加热煮沸法粗提基因组。12 000 r/min 离心5 min,沉淀溶于100 μL Tris-EDTA 中,100 ℃加热煮沸10 min,释放基因组DNA。
1.2.2 引物设计及RPA反应
在美国国家生物技术信息中心网站(https://www.ncbi.nlm.nih.gov)检索SMA 特异性序列NC_010943.1。使用Primer premier 5 软件设计引物对,由通用生物有限公司(中国)合成。引物设计原则如下:引物长度30~35 bp;GC 含量30%~70%;扩增子长度100~500 bp;最大单核苷酸重复长度为5。使用基础型RPA 试剂盒筛选最佳引物对。RPA 反应体系共50 μL,向含有酶组分的反应管中加入29.4 μL 反应缓冲液、2.4 μL 10 μmol/L 上游引物(F)、2.4 μL 10 μmol/L下游引物(R)、13.3 μL基因组模板和2.5 μL 280 nmol/L醋酸镁溶液。上下颠倒充分混匀反应管内溶液,瞬时离心。将反应管置于37 ℃水浴锅孵育30 min。RPA 反应完成后,使用等体积的苯酚-氯仿-异戊醇(25∶24∶1)混合液抽提RPA扩增产物。12 000 r/min离心5 min,取上清,加入适量DNA 上样缓冲液,通过2%琼脂糖凝胶电泳分离(90 V,30 min),在紫外灯下观察RPA反应产物。
1.2.3 探针设计及RPA-LFS反应
根据RPA 反应筛选出最佳引物对后,将上游引物向3′端方向延长16 bp即为探针序列。探针的5′端使用FITC 标记,3′端使用C3-间臂基团(3′-Block)修饰,探针中部的一个碱基使用四氢呋喃(tetrahydrofuran,THF)取代,其中至少30 bp 位于THF位点的5′端,至少15 bp位于其3′端。下游引物的5′端使用生物素(Biotin)标记。RPA-LFS 反应体系共50 μL,向含有酶组分的反应管中加入29.4 μL反应液、2.1 μL 10 μmol/L上游引物、2.1 μL 10 μmol/L下游引物、0.6 μL 10 μmol/L探针、13.3 μL基因组模板溶液和2.5 μL 280 μmol/L醋酸镁溶液。上下颠倒充分混匀反应管内溶液,瞬时离心。将反应管置于37 ℃水浴锅孵育12 min。使用双蒸水将反应产物稀释20倍,取50 μL稀释液滴加入试纸条的加样孔中,等待显色。
1.2.4 特异度检验
为检测RPA-LFS体系的特异度,使用该方法检测了其他12种临床常见标准菌株和12株临床来源的SMA,检测方法如前文所述。
1.2.5 灵敏度检验
使用双蒸水梯度稀释SMA基因组DNA(1×107、1×106、1×105、1×104、1×103、1×102、10 CFU/mL)用于检测RPA-LFS 体系的灵敏度。取1 μL基因组DNA稀释液加入RPA-LFS 反应管中,补双蒸水至13.3 μL,使得每个反应分别含有1×104、1×103、1×102、10、1、1×10-1、1×10-2CFU SMA的基因组,其余步骤如前文所述。每组浓度进行10 次独立实验,通过对10 个独立实验的概率回归分析,确定该方法的最低检测限(limit of detection,LOD),即95%的概率检测出阳性产物的最低浓度。
1.2.6 临床标本检测
通过与生化培养法和qPCR检测法进行比较来评估RPA-LFS 法在临床标本检测中的实际应用价值。用于生化培养法和qPCR检测法检测的临床样本使用选择培养基进行培养,置于35 ℃微生物培养箱培养18~48 h。VITEK 2 全自动微生物分析系统进行菌种鉴定。根据基因序列NC_010943.1 设计qPCR 引物[16],按照操作流程对临床样本使用qPCR法进行检测。qPCR 法步骤如下:95 ℃预变性2 min后进入循环阶段,95 ℃变性10 s,56 ℃退火50 s,72 ℃延伸15 s,共40个循环。根据公式:(共同阳性样本个数+共同阴性样本个数)÷样品总数×100%,计算RPA-LFS 法与另外两种方法的符合率,通过kappa指数来评估该方法与其他方法的一致性。
1.3 统计学方法
实验结果用SPSS 13.0 软件分析。对临床检测数据进行kappa 一致性检验,kappa 值>0.8 表示一致性较强,P<0.05表明kappa值可靠。
2 结果
2.1 引物和探针设计
根据SMA 特异性基因序列NC_010943.1 设计出4组引物对(表2),对4组候选引物对进行基础型RPA反应(图2A)。4组引物对均产生了与预期大小一致的靶向条带,分别为470、163、369、189 bp,但在无模板对照(no template control,NTC)中出现了少量小于100 bp的引物二聚体条带。相比之下,引物对1 具有较亮的目标条带,并且无肉眼可见的引物二聚体。因此,选择引物对1用于探针的设计。

表2 RPA引物对序列Table 2 RPA primer sequences

图2 最佳引物对筛选及探针设计Figure 2 Optimal primers for screening and probe design
根据引物对1 的上游引物设计探针,修饰后的探针和引物见表3,通过RPA-LFS 检测引物探针组合F1/R1/P1 的扩增性能及时确定是否存在假阳性的情况。结果如图2B 所示,F1/R1/P1 引物-探针组合提供了正确的阳性信号(检测线和质控线上都有可见的红色条带),这表明F1/R1/P1 引物-探针组合具有良好的扩增性能。然而,在无模板对照组中,检测线上也显示出一条可见的弱化红带,表明F1/R1/P1 引物探针组合存在假阳性扩增。考虑到RPA反应环境下可能发生不利的引物相互作用,产生较低分子量的DNA副产物(<100 bp),即“引物噪音”。为减少“引物噪音”的产生,本研究在引物中适当引入了碱基错配。错配原则如下:对具有4 个以上连续配对碱基的区域进行碱基错配;靠近3′端的3 个碱基不能替换;每条引物上替换的碱基不超过5 个;不能有连续的2 个碱基替换;优先使用A-G互换、T-C 互换。F1/R1/P1 引物-探针组合可产生的引物二聚体和碱基错配如图2C 所示。当引入适当碱基错配后,无模板对照组的假阳性信号消失(图2B),后续实验使用F/R/P引物-探针组合。

表3 RPA-LFS探针序列Table 3 RPA-LFS probe sequences
2.2 RPA-LFS反应条件的优化
为实现RPA反应条件的最优化,对其反应时间和温度进行了改良。控制反应温度为37 ℃,将反应时间分别设置为0、2、4、6、8、10、12 min(图3A)。结果显示,反应4 min时检测线出现颜色较弱的条带,在8 min 时检测线条带清晰明亮。8 min 后,随着反应时间的延长,检测线无明显变化。控制反应时间,分别在22、27、32、37、42、47、52 ℃进行RPA扩增(图3B)。在反应温度为22 ℃时,检测线无条带,27 ℃时检测线出现较浅的条带。反应温度在37 ℃~42 ℃,具有较为清晰的阳性条带。考虑到RPA-LFS反应体系所需的酶不耐高温,推测反应温度为52 ℃时,无目的产物的扩增。与假设相符,当反应温度达到52 ℃时,检测线无条带。综合时间、经济成本,RPA-LFS 法的最佳反应条件为37 ℃,反应8 min。后续实验将采用该条件进行。
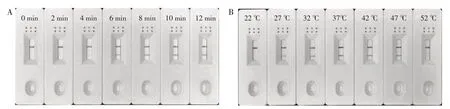
图3 RPA-LFS反应时间和温度的优化Figure 3 Optimization of RPA-LFS reaction conditions
2.3 RPA-LFS检测的特异度分析
为评价RPA-LFS 检测法是否能特异性检测SMA,使用12 种临床常见致病菌和12 株SMA 临床分离株进行RPA-LFS 检测。如图4A 所示,使用其他致病菌基因组作为RPA-LFS反应模板时,检测线未出现阳性信号,当使用临床分离的SMA 基因组DNA 作为模板时,检测线上出现了明显的阳性信号(图4B)。结果表明,建立的RPA-LFS 检测体系对SMA 具有良好的特异度,与其他病原菌无交叉反应。

图4 RPA-LFS特异度检测Figure 4 Specificity of the RPA-LFS assay
2.4 RPA-LFS检测的灵敏度分析
为评估RPA-LFS 方法的最低检测限,以梯度稀释的SMA 基因组DNA 为反应模板。反应体系中含有1×104CFU 基因组时,检测线上出现强的阳性信号,随着模板浓度的降低,阳性条带的颜色减弱。当浓度低至1×10-1CFU时,阳性信号完全消失(图5A)。此外,为了进一步确定RPA-LFS检测的准确LOD,对所有浓度进行10次独立的检测。结果显示,当反应体系中基因组含量为1 CFU时,有9次为阳性结果,基因组含量为1×10-1CFU时,有1次结果呈阳性。通过SPSS 软件对10 次检测的结果进行probit 回归分析(图5B)。在95%的阳性概率下,RPA-LFS 反应的最低检测限为1.107 CFU。为了测试该系统是否能抵抗其他物种基因组的干扰,除了在反应体系中加入SMA 基因组外,额外加入10 ng的人类基因组DNA。结果显示,该方法检测灵敏度不受人类DNA的影响(图5C)。

图5 RPA-LFS检测的灵敏度分析Figure 5 The sensitivity of the RPA-LFS assay
2.5 RPA-LFS在临床标本检测中的应用
通过与qPCR 法[16]和传统生化培养法比较,评估RPA-LFS 方法在临床中的实际应用价值(表4)。对收集的108 例临床标本进行检测,结果显示,RPA-LFS 法和qPCR 法检测108例标本中有23例样本呈现SMA阳性,而采用生化培养法只检测出22例样本为阳性。建立的RPA-LFS方法与qPCR法的符合率为100%。RPA-LFS与传统生化培养方法的阳性符合率为99.07%,kappa 指数值为0.972,P<0.001,说明RPA-LFS与传统生化培养方法一致性较好。

表4 RPA-LFS与qPCR法和传统生化培养法比较Table 4 Comparison of RPA-LFS,qPCR,and traditional bacterial culture methed
3 讨论
病原微生物的即时、精确诊断是临床检验不可忽视的难点之一。本研究开发了一种改良型的RPA-LFS 方法,用于检测SMA,既实现了SMA 的快速检测,也拓宽了RPA-LFS的应用范围。
SMA 常与金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌等混合生长[1],传统的微生物分离培养技术对于鉴定SMA 具有一定挑战性。PCR 技术快速准确、灵敏度高,但该方法需要复杂的反应仪器且用时较长,不适用于病原微生物的快速检测[17]。相比其他分子扩增技术,RPA可在较低的温度中进行,不依赖于仪器的精准温控,有利于POCT 的发展[8]。将RPA 技术与LFS 检测方法联合使用,可在短时间内实现对靶基因的快速可视化检测。在RPA-LFS 反应过程中,DNA 聚合酶从上游引物的3′端开始移位以产生较小的扩增子,从断裂探针的3′端开始移位产生双标记扩增子(主要扩增子),用于下游试纸条的“三明治”检测[18]。
本研究根据SMA 特异性序列(NC_010943.1)设计引物和探针。该基因序列由Fraser 等[16]于2019 年首次鉴定为SMA 的保守序列,可用于SMA的鉴定。在设计探针过程中,发现下游引物和探针产生的引物二聚体会导致假阳性信号的发生,因此本研究引入碱基错配以避免假阳性信号。文献报道,RPA 反应可允许少许错配碱基的引入[19],但要避免在3′端引入错配。在引入错配碱基后,本研究建立了适用于特异性检验SMA的引物-探针序列F/R/P。值得注意的是,扩增效率及扩增产物检测效能在理论上逊色于错配前的引物探针组合,但考虑到检测的特异性,这种错配不可避免。通过优化反应时间和温度,确定了RPA-LFS体系的最佳反应条件为37 ℃,扩增时间为8 min。根据probit回归分析,确定该体系检测SMA 的最低检出限为1.107 CFU,且灵敏度不受其他物种基因组干预。通过对108例临床来源的微生物样本进行检测以验证临床适用性,我们建立的RPA-LFS 方法与qPCR 检测结果相符,具有一致性。但由于反应时间的缩短、检测设备的简易,以及碱基错配位点的引入,RPA-LFS 体系的灵敏度略低于qPCR 检测法[16]。与传统的“金标准”生化培养法相比,RPA-LFS 较为灵敏且不需要经过纯化步骤,大大缩短检测时间,两种检测方法的阳性符合率为99.07%,kappa指数值为0.971 8,对比差异无统计学意义,说明两种方法具有良好的一致性。22例均被定义为SMA阳性的样本,其患者临床诊断为SMA感染,经抗菌药物治疗后康复。其中不一致的1例样本被全自动微生物鉴定仪定义为鲍曼不动杆菌,来源于痰液,其误差原因可能为技术人员在分离纯化时操作失误。由于非无菌部位标本常常有多种细菌生长,即使看似较纯的菌落,下面也有可能掩盖不易觉察的小菌落。该患者在治疗过程中,重新采取痰液并分离纯化,经全自动微生物鉴定仪检测,确诊感染SMA。因此,实验人员不能过分依赖仪器,动手操作时也要刻画入微,避免误差。
本研究开发了一种敏感且特异、适用于SMA的RPA-LFS 检测方法,该方法打破了昂贵仪器的桎梏,可以在条件有限的环境使用。尽管已经完成了改进和临床适用性评估,但这种方法还具有一些局限性:①开发和测试只在本地实验室中进行,缺乏大规模样本量分析检测,无法实现真正意义上的POCT;②与传统“金标准”检测方法的比较仍需要大量样本的验证;③RPA-LFS 技术尚未能实现高通量检测,只能通过多次RPA反应来鉴定菌株和耐药基因。未来需要致力于高通量RPA-LFS技术的建立,以及一体化核酸提取-RPA 反应-检测仪器的开发,以便医疗资源的合理利用和POCT的发展。现有的RPA技术可作为PCR检测技术的重要补充,缩短检测时间,便于治疗的及时性[20]。目前,RPA-LFS 正处于向临床应用过渡的阶段[8]。尽管如此,我们建立的RPA-LFS 方法对于检测SMA 感染仍具有广阔的应用前景。
