A2M 在慢性阻塞性肺疾病中的表达及其与免疫细胞浸润的相关性
2024-01-18肖心儒施宇佳
肖心儒,范 亮,施宇佳,张 倩,2*
1南京医科大学附属常州市第二人民医院呼吸与危重症医学科,江苏 常州 213003;2南京医科大学常州医学中心,江苏 常州 213003
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以不完全可逆的气流阻塞为特征的肺部状态。有呼吸困难、慢性咳嗽或咳痰,存在反复发作的下呼吸道感染史或有危险因素史的患者均应考虑COPD。目前COPD 的诊断和气流受限的严重程度分级主要由肺功能检查确定,吸入支气管舒张剂后1秒钟用力呼气量(forced expiratory volume in one second,FEV1)/用力肺活量(forced vital capacity,FVC)<0.7 提示存在不完全可逆的气流受限即确诊COPD[1]。COPD 发病机制复杂且存在多种表型[2],当前的诊断方法无法解释COPD 的病因,难以确定COPD特异性治疗靶点。大量研究发现生物学标志物与疾病的发生、发展密切相关[3-4],因此在高危人群和COPD 患者中寻找分子生物学标志物,有助于COPD的诊断与治疗。
COPD 的特征在于下呼吸道的异常免疫反应,其进展与形成淋巴滤泡的先天和适应性炎症免疫细胞对肺的浸润有关。近年来,越来越多的证据强调了免疫细胞浸润在COPD发生发展中的重要性[5-7]。因此,在免疫细胞成分中寻找有效的COPD 诊断生物标志物是一种很有意义的研究途径。我们前期研究表明α2 巨球蛋白(alpha 2 macroglobulin,A2M)是COPD的生物标志物且与炎症反应密切相关[8-9],本研究进一步探讨了A2M 与COPD 中免疫细胞的相关性,并探究其潜在的功能及通路。
A2M 是一种急性期蛋白,当与蛋白酶反应时,A2M被转化并获得与细胞因子、生长因子和细胞受体结合的能力[10]。因此,A2M在维持蛋白酶介导的细胞因子和生长因子的稳态方面发挥重要作用。此外,A2M还参与控制肺蛋白酶活性[11]。肺泡巨噬细胞在肺内局部合成A2M 的能力以及A2M 蛋白酶复合物的吞噬作用在减少肺蛋白酶负荷中可能发挥了重要作用。我们推测,A2M可能与免疫细胞的肺部浸润有关。
本研究从GEO数据库中筛选出一个COPD微阵列数据集。在健康样本和COPD样本之间进行差异表达基因(differential expressed gene,DEG)分析。鉴定A2M 在DEG 里的表达,使用CIBERSORT 分析免疫细胞基因表达,CIBERSORT成功地鉴定和定量了在COPD和对照样本中渗入肺实质的各种免疫细胞,此外,本研究还描述了免疫细胞和A2M 之间的关系。
1 对象和方法
1.1 对象
本研究选取2022 年1 月—2023 年1 月于南京医科大学附属常州第二人民医院呼吸与重症医学科就诊的25 例稳定期COPD 患者作为研究对象。入选标准:①符合2022 年COPD 全球倡议中的诊断标准[12];②临床稳定至少3 个月,无急性发作;③年龄≥40 岁。这些患者的影像学检查结果符合COPD,吸入β2 激动剂后,支气管扩张试验呈阴性,FEV1/FVC<70%。本研究中所有COPD 患者根据肺功能分为4组(Ⅰ:FEV1%pred≥80%;Ⅱ:50%≤FEV1%pred<80%;Ⅲ:30%≤FEV1%pred<50%;Ⅳ:FEV1%pred<30%)。所有受试者均需排除感染、支气管扩张、结核病、哮喘、恶性肿瘤和其他混杂的炎症性疾病,如关节炎、结缔组织疾病或炎症性肠病。另选取本院同期进行体检的健康志愿者26 例作为健康对照组。入选标准:①年龄≥40岁;②肺功能正常。排除标准为:①临床资料不完整;②有高血压、糖尿病、呼吸系统疾病、自身免疫性疾病等。本研究获得常州市第二人民医院伦理委员会批准(2022KY113-01),所有参与者均签署知情同意书。
1.2 方法
1.2.1 采集血液样本
用EDTA抗凝管收集患者和健康对照的静脉外周血10 mL,其中5 mL 低速离心机3 000 r/min 离心10 min,分离血清,通过ELISA 检测A2M 蛋白水平;另留存5 mL 全血用于RT-qPCR 测定A2M 的mRNA表达水平。所有受试者的血液样本均储存于-80 ℃。
1.2.2 细胞培养及处理
巨噬细胞系Raw264.7(武汉普诺赛公司)使用DMEM 培养基培养于37 ℃、5%CO2的恒温培养箱内,DMEM 含有10%胎牛血清和1%双抗。使用终浓度为50 ng/mL 的白细胞介素(interleukin,IL)-4和IL-13 诱导Raw264.7 细胞24 h 成为M2 型巨噬细胞(细胞形态为类圆形或纺锤形贴壁);随后用脂质体3 000(赛默飞公司,美国)将A2M siRNA(福州尚亚公司)转染至M2型巨噬细胞;最后分别于转染48 h和72 h后提取RNA和蛋白用于进一步研究。
1.2.3 ELISA测定
根据制造商的说明,使用ELISA试剂盒(江苏酶标公司)检测血浆样品中A2M的总浓度。在450 nm处获得标准品和样品的吸光度值,并比较为每种测定构建的标准曲线,并用于最小化测定间差异。
1.2.4 RT-qPCR检测
使用RNAliquid 超速全血总RNA 提取试剂盒(北京汇天东方科技有限公司)提取总RNA,实验步骤按照说明书进行。使用紫外线分光光度计对提取的RNA浓度及纯度进行检测。使用第一链cDNA合成试剂盒(南京诺唯赞公司)合成第一链互补DNA。使用AceQ qPCR SYBR Green Master Mix(南京诺唯赞公司)进行RT-qPCR,以评估mRNA 表达的程度。用ABI 7300型荧光定量PCR仪,采用2-ΔΔCT法进行数据的相对定量分析。引物由苏州吉玛公司提供,序列如下:homo-A2M(F:5ʹ-AGGAAATCGCATCGCACAATG -3ʹ;R:5ʹ-ACGGTGAAAGGGTGCTCTG-3ʹ);homo-β-actin(F:5ʹ-CGTGGACATCCGCAAAGA-3ʹ;R:5ʹ-GAAGGTGGACAGCGAGGC-3ʹ);mus-A2M(F:5ʹ-AGGAATCTGCCCGAGCTTCT-3ʹ;R:5ʹ-ATGGCCTTGGTCTTGATCTCC-3ʹ);mus-β-actin(F:5ʹ-TGTCCACCTTCCAGCAGATGT -3ʹ;R:5ʹ-AGCTCAGTAACAGTCCGCCTAG-3ʹ)。
1.2.5 Western blot实验
收集经处理的各组细胞,4 ℃下12 000g离心10 min 后,在含有蛋白酶和磷酸酶抑制剂的裂解液(上海碧云天公司)中裂解30 min。使用BCA 蛋白测定试剂盒(上海碧云天公司)测定蛋白含量。蛋白质样品经10%凝胶(上海雅酶公司)电泳后转移到PVDF 膜上,利用快速封闭液(上海碧云天公司)对PVDF膜封闭20 min,加入抗精氨酸酶(arginase-1,Arg-1)和抗内参GAPDH 的一抗(Abcam 公司,英国),4 ℃摇床孵育过夜。次日TBST 洗涤3 次,山羊抗兔IgG二抗(上海碧云天公司)在室温下孵育1.5 h后,再用TBST 洗涤3 次。使用ECL 显影液(上海碧云天公司)在化学发光成像程序系统进行曝光拍照。Image J软件用于结果分析。
1.2.6 肺功能的测定
本研究使用肺功能仪(耶格公司,德国),根据2019 年肺活量测定标准[13]对受试者进行坐位肺功能检查,在整个测试过程中操作者持续观察容积和流量曲线,并测量FVC、FEV1和FEV1/FVC 以及其他肺功能测试参数并计算预期值,记录3次测量数值,将最高值认定为基值,同时FVC和FEV1的最佳值和次佳值之间的差异应小于0.10 L。
1.2.7 生物信息学分析
从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)中筛选芯片数据集,选择标准如下:①数据集必须包含全基因组表达mRNA 微阵列数据;②数据集应包括COPD 患者和正常吸烟者的肺组织标本;③数据集样本数量必须>20。基于以上标准,获得了GSE38974 基因表达谱数据集,GSE38974 包含来自COPD患者的23个肺组织样品和来自正常吸烟者的9个肺组织样品。
1.2.7.1 差异表达基因和富集分析
使用R 软件“Limma”识别COPD 样本和健康对照组样本之间的差异表达基因。以调整后的P<0.05和|log2fold change| ≥1 作为截断值。使用R 软件clusterProfiler包进行GO和KEGG分析。
1.2.7.2 GSVA分析
GSVA 能评估每个样本中通路活性的潜在变化。使用R软件中的“GSVA”包进行分析,计算所有样本中通路的富集评分。
1.2.7.3 免疫细胞浸润的评估
本研究使用“CIBERSORTx”网站(https://cibersortx.stanford.edu)估算了GSE38974 样本中22 种免疫细胞的比例。
1.3 统计学方法
使用SPSS26.0 和GraphPad Prism7 对实验数据进行统计分析。采用Kolmogorov-Smirnov 检验测量数据的正态性。符合正态分布的测量数据表示为均数±标准差(),分类变量数据表示为例数(百分率)[n(%)]。组间比较采用χ2检验或Fisher 确切概率法检验。若符合正态分布,对连续变量使用t检验。采用Pearson相关分析对正态分布的资料进行相关性分析。采用受试者工作特征(receiver operating characteristic,ROC)曲线确定诊断的灵敏度和特异度,曲线下面积(area under the curve,AUC)确定诊断效果。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象临床特征
本研究纳入25 例稳定期COPD 患者及26 例健康对照,两组年龄、性别、体重指数、吸烟史无统计学差异。与健康对照组比较,COPD 组患者外周血中性粒细胞(neutrophil,NEU)、单核细胞(monocyte,MONO)、嗜酸性粒细胞(eosinophil,EOS)绝对值显著升高,而淋巴细胞(lymphocyte,LYM)、嗜碱性粒细胞(basophil,BASO)无明显差异(表1)。由于EOS关系到稳定期COPD患者治疗方案的拟定,因此我们以EOS在300个/μL为界值进一步进行亚组分析,结果表明,EOS<300个/μL组和EOS≥300个/μL组在年龄、性别、体重指数、吸烟史、FEV1/FVC 和FEV1%pred 均无明显差异,但EOS≥300 个/μL 组患者的呼出气一氧化氮(fraction of exhaled nitric oxide,FeNO)水平显著高于EOS<300个/μL组(表2)。
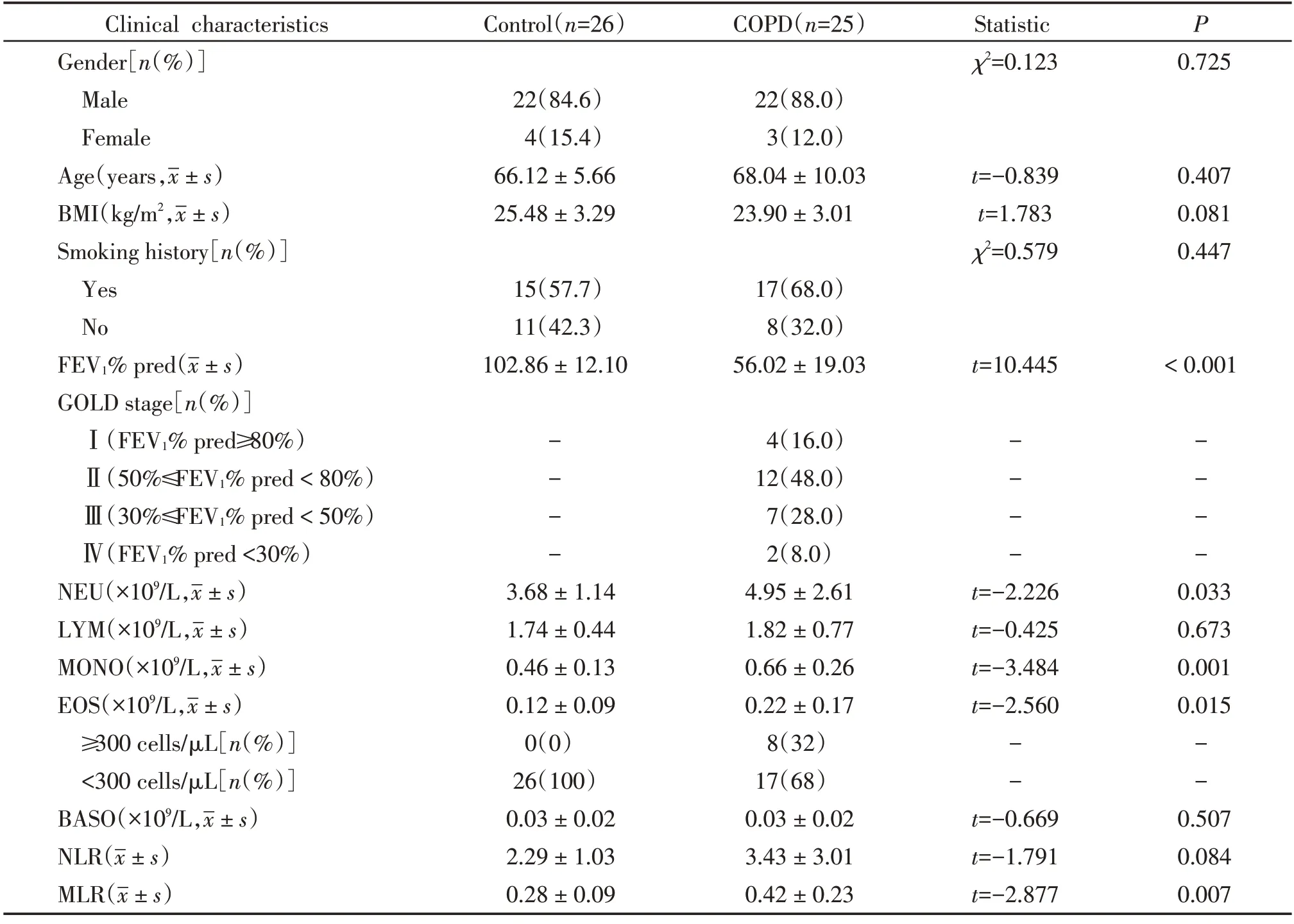
表1 研究对象临床特征Table 1 Clinical characteristics of subjects

表2 不同EOS水平COPD患者的临床特征Table 2 Clinical characteristics of COPD patients with different EOS levels
2.2 COPD患者DEG的鉴定和富集分析
分析COPD 患者中的差异表达基因(图1A),其中,A2M在COPD组患者中的表达水平下降(图1B)。GO 富集分析显示,这些差异表达基因主要涉及白细胞迁移、细胞趋化、受体配体活性、信号受体激活活性、细胞因子活性等(图1C、D)。KEGG 结果提示,在COPD 发生过程中,细胞因子-细胞因子受体相互作用、癌症的转录失调、肿瘤坏死因子信号通路、凋亡、脂质与动脉粥样硬化等信号通路显著富集(图1E、F)。
2.3 A2M与COPD免疫浸润
采用CIBERSORT 方法进行免疫浸润分析,计算两组肺组织中22种免疫细胞的相对比例(图2A)。CD8+T 细胞、激活的自然杀伤(natural killer,NK)细胞、M2 巨噬细胞在COPD 患者肺组织中异常下调,而M0巨噬细胞上调(图2B)。此外,通过Pearson相关分析发现A2M与M0巨噬细胞呈负相关,与M2巨噬细胞和静息肥大细胞呈正相关(图2C)。

图2 肺组织浸润免疫细胞的分布Figure 2 The landscape of lung tissue-infiltrating immune cells
2.4 A2M与COPD免疫相关通路
利用GSVA 和ssGSEA 评估正常样本和COPD样本之间KEGG富集通路以及免疫相关通路的差异(图3A、B),共获得184个KEGG 通路评分矩阵。各通路在不同亚组中的不同评分提示COPD患者与健康人之间各通路活性存在差异,这可能是决定COPD 发生发展的重要因素。此外,Pearson 相关分析揭示了A2M 基因和富集分子途径之间的相关性(图3C),结果显示,A2M 与凋亡、B 细胞受体通路、趋化因子通路、细胞因子-细胞因子受体相互作用及NK细胞介导的细胞毒性呈负相关。

图3 COPD相关的免疫信号通路分析Figure 3 Analysis of immune signaling pathways associated with COPD
2.5 COPD患者与健康对照组外周血中A2M的表达
RT-qPCR结果显示,与对照组相比,A2M mRNA在COPD 患者外周血有核细胞中表达明显降低(图4A),ELISA 实验结果显示,COPD 患者外周血血浆A2M 的蛋白表达较对照组下降(图4B)。ROC 曲线评估A2M作为COPD生物标志物的价值(图4C),当界值(cut-off value)为5.495 时,A2M mRNA 作为COPD 生物标志物的灵敏度为92.0%,特异度为61.5%,AUC为0.815(95%CI:0.698~0.932,P<0.001),此指标作为COPD生物标志物的诊断价值最佳。
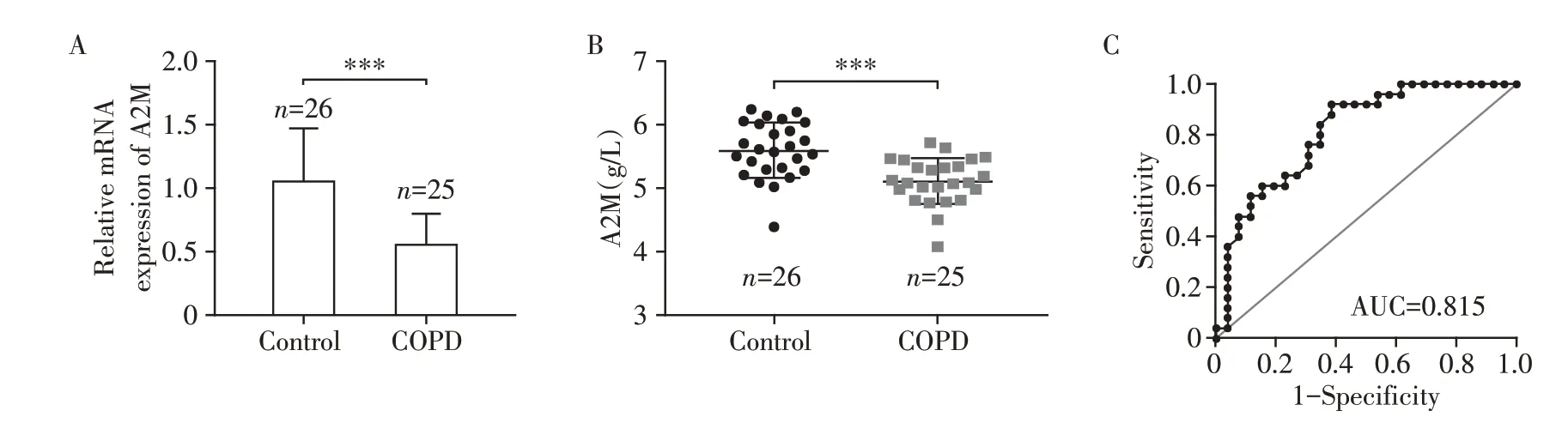
图4 COPD患者与健康对照组外周血中A2M的表达水平Figure 4 Expression levels of A2M in peripheral blood of COPD patients and healthy controls
2.6 A2M与免疫细胞的相关性
进一步验证25 例COPD 患者外周血中A2M 蛋白水平与免疫细胞的相关性(表3)。结果显示,A2M 与LYM(图5A)和MONO(图5B)呈正相关(P<0.05),与NEU、EOS、BASO、中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)、单核细胞/淋巴细胞比值(monocyte-lymphocyte ratio,MLR)无明显相关。我们前期研究表明A2M 与肺功能相关[9],因此,本研究进一步分析了GOLD Ⅰ~Ⅱ级和GOLDⅢ~Ⅳ级中A2M 与COPD 患者免疫细胞的相关性(表4),结果显示,在GOLD Ⅰ~Ⅱ级中A2M与MONO呈正相关。同时,EOS关系到COPD稳定期的治疗,我们分析了EOS ≥300 个/μL 组和EOS<300 个/μL组中A2M 与COPD 患者免疫细胞的相关性(表4),结果显示,EOS<300个/μL组中A2M与MONO呈正相关,与EOS呈负相关,EOS≥300个/μL组中A2M与LYM呈正相关,与MLR呈负相关。

图5 A2M蛋白与免疫细胞的相关性Figure 5 Correlation between peripheral blood A2M protein and immune cells

表3 A2M和COPD患者免疫细胞的相关性Table 3 Correlation between A2M and immune cells in COPD patients

表4 不同分组中A2M和COPD患者免疫细胞的相关性Table 4 Correlation between A2M and immune cells in COPD patients in different groups
2.7 A2M 与巨噬细胞Raw264.7 细胞向M2 型极化的相关性
与正常巨噬细胞相比,IL-4和IL-13共刺激组的M2型巨噬细胞表面标志物Arg-1表达升高(图6A),提示M2 型巨噬细胞诱导成功。在M2 型巨噬细胞中敲低A2M后,A2M mRNA表达降低(图6B),且M2型巨噬细胞表面标志物Arg-1表达降低(图6C)。

图6 A2M与Raw264.7细胞向M2型极化的相关性Figure 6 Correlation between A2M and M2-type polarization of Raw264.7
3 讨论
免疫细胞浸润错综复杂地参与了COPD的发生和发展[14-16]。我们前期研究表明A2M是COPD的生物标志物,且A2M与炎症反应密切相关[8-9],本研究在前期研究基础上利用生物信息学分析与临床相关资料进一步探讨了A2M与COPD中免疫细胞的相关性,并探究其潜在的功能及通路。
基于近年来COPD 免疫机制的理论,多种新型免疫调节药物可以促进受损气道的修复或免疫重建,从而降低COPD发作的频率和严重程度,改善健康状况和运动耐受性。因此,本研究使用CIBERSORT 评估来确定COPD 患者和健康对照者中免疫细胞浸润的概况,表征了与COPD 相关的免疫细胞亚型,为COPD的治疗提供新思路。
在本研究中,4种类型的免疫细胞均与COPD显著相关,包括CD8+T 细胞、激活的NK 细胞、M0 巨噬细胞和M2巨噬细胞。这些不同的免疫细胞在肺组织微环境中可能并不单独发挥作用,而是更倾向于与其他细胞相互作用,协同影响COPD 的进程[17]。COPD患者IL-8、IL-17水平明显升高[18],这可能是巨噬细胞在烟雾、病原体或其他因素刺激下分泌的,并进一步引起中性粒细胞的募集。这些促炎细胞通过释放活性氧(reactive oxygen species,ROS)、蛋白酶、一些炎症因子和趋化因子参与细胞外基质降解、黏液分泌和细胞损伤,从而促进COPD 的发展[19]。本研究发现M0 巨噬细胞的比例显著增加,可以作为极化刺激的储备。M1 巨噬细胞主要参与促炎反应,然而,在本研究的免疫浸润分析中未观察到M1 巨噬细胞在对照组和COPD 组之间存在差异。M2巨噬细胞主要参与抗炎反应,在COPD组中显著减少,表明其功能可能在COPD 中受损。研究还发现COPD 患者肺组织中CD8+T 细胞的表达减少。CD8+T细胞主要分泌IL-4和IL-5,这两种细胞因子都与加重肺气肿发展的肺实质组织损伤有关[20]。然而,本研究观察到的CD8+T 减少与以前的研究不一致。COPD 患者肺部产生γ干扰素的CD8+和CD4+淋巴细胞数量增加[21]。与正常对照组和非吸烟者相比,COPD 患者的CD8+T 细胞亚群频率显著增加[22]。这可能由于生物信息学方法和流式细胞术测定之间的差异。此外,COPD 患者肺组织中活化的NK 细胞减少。NK 细胞可以分泌细胞毒性介质,如颗粒酶B和穿孔素,它们可能在诱导肺细胞凋亡中起重要作用,从而促进肺气肿[23]。有研究表明,NK细胞对COPD患者肺上皮细胞具有细胞毒性作用,并通过IL-1受体亚单位的树突状细胞转运IL-1而得到增强[24]。以上研究均证明了免疫细胞在COPD 发病中的直接或间接作用,这与本研究结果一致。因此,寻找COPD 免疫疗法的潜在靶点具有重要意义。
A2M是控制蛋白酶活性的核心调节剂,在充当蛋白酶抑制剂、激素、免疫调节剂和细胞因子中发挥着重要作用[25]。研究发现,A2M作为血液中的一种大分子血浆蛋白,可以通过抑制纤溶酶和激肽释放酶来灭活多种蛋白酶[26],还可以充当结合生长因子、激素和细胞因子的载体蛋白,如血小板衍生生长因子、碱性成纤维细胞生长因子、胰岛素样生长因子和白细胞介素[27]。Poller 等[28]鉴定了1 例A2M基因突变和部分血清A2M缺乏症的患者,该患者慢性气道阻塞发生早,并迅速进展为极其严重的COPD。
本课题组前期研究发现A2M mRNA在COPD患者外周血中下调[29],此结果在本研究中得到进一步验证。本研究发现,A2M与M0巨噬细胞呈负相关,与M2 巨噬细胞和静息肥大细胞呈正相关,且A2M与凋亡、B细胞受体通路、趋化因子通路、细胞因子-细胞因子受体相互作用及NK细胞介导的细胞毒性呈负相关。此外,本研究进一步证实了A2M与淋巴细胞、单核细胞具有显著相关性。单核细胞作为先天免疫系统的重要组成部分,可以直接发挥吞噬作用或分化为巨噬细胞进而影响疾病进程[30]。上述发现提示A2M 可能与巨噬细胞相关,因此,本研究探究了M2型巨噬细胞中A2M的表达水平,并在M2型巨噬细胞中敲低A2M 后进一步验证A2M 与巨噬细胞极化存在相关性。此外,本研究还探究了NLR和MLR 与A2M 的相关性,NLR 和MLR 都是机体免疫对不同应激刺激反应的指标[31-32],可以放大中性粒细胞、单核细胞和淋巴细胞对炎症反应的评价作用。本研究中COPD 组患者的NLR 高于健康对照组,但差异无统计学意义,而COPD 组患者的MLR高于健康对照组(P<0.05)。然而,A2M 与NLR 和MLR 均无明显相关性,但在EOS≥300 个/μL 组中A2M 和MLR 呈负相关。以上结果提示A2M 在COPD 炎症和免疫中可能发挥重要功能,通过对EOS进行亚组分析,本研究发现EOS ≥300个/μL组较EOS<300 个/μL 组有更高的FeNO 水平,验证了高EOS 与气道炎症相关,且EOS ≥300 个/μL 组中A2M 与淋巴细胞呈正相关,提示A2M 在高EOS 的COPD 中可能是通过淋巴细胞介导炎症反应的,而在低EOS的COPD中可能是通过单核细胞介导炎症和免疫反应的。
本研究有一定局限性。首先,样本量较小;其次,只检测了外周血中A2M 的表达,其在痰液和肺泡灌洗液中的表达水平尚不清楚,这两种样本与气道炎症关系更密切;最后,本研究表明A2M 与巨噬细胞向M2型极化的相关性,然而,A2M是否直接影响巨噬细胞向M2型极化仍需进一步研究。
综上所述,本研究通过生物信息学分析发现A2M 在COPD 患者肺组织与外周血中表达降低,且与淋巴细胞、单核细胞、巨噬细胞、肥大细胞具有相关性,A2M 可能在巨噬细胞向M2 型极化的过程中发挥重要作用。这为未来研究COPD的发病机制以及探索相关的免疫治疗奠定了理论基础。
