近红外光协同免疫疗法增强抗肿瘤效果研究进展
2024-01-16祝红达杨朝波刘阅张子林马凯关业能
祝红达,杨朝波,刘阅,张子林,马凯,关业能
(湖北工业大学 a.生物工程与食品学院;b.发酵工程教育部重点实验室;c.工业微生物湖北省重点实验室,武汉 430068)
传统的肿瘤治疗方法(手术、化疗和放疗)在本质上都是局部直接根除肿瘤细胞和组织,虽有一定的疗效但通常难以治愈,特别是化疗由于靶向性差造成的副作用严重,还会导致免疫系统功能的降低.近年来肿瘤免疫疗法得到极大的发展,如免疫检查点抑制剂、细胞因子、癌症疫苗等,其通过活化免疫细胞激活免疫系统达到杀死肿瘤细胞的目的[1].2015 年美国食品药品监督管理局(FDA)批准将免疫检查点抑制剂用于非小细胞肺癌的治疗,使其成为最耀眼的抗癌明星[2],但患者的实际响应率偏低,部分患者出现较严重的免疫相关不良事件(irAEs)[3].为了降低免疫疗法的副作用,许多研究试图用多种方法联合免疫疗法用于肿瘤的治疗,其中光疗特别是近红外光(650~1700 nm)由于其优异的光物理学参数在医学领域的诊断与治疗方面被广泛关注.首先,近红外光以非电离方式进行辐射,不会对组织造成明显的伤害及遗传毒性[4];其次,用于近红外的设备与辐射设备相比要便宜得多[5];最后,近红外激光在医学领域已有数十年的发展,其安全性和方法理论有一定的保障[6],这些优势给予近红外光以巨大的临床应用潜能.近红外光联合免疫疗法策略不仅增强了原发肿瘤细胞的凋亡,远端肿瘤和肿瘤转移也被明显抑制[7].本文对近年来近红外光协同免疫疗法增强抗肿瘤的设计策略、应用、现存问题及未来展望进行综述.
1 近红外光协同免疫疗法的设计策略
1.1 光热疗法协同免疫治疗
光热治疗(PTT)是基于能够将光能转换为热能的光热转化剂的一种治疗方法,其靶向肿瘤细胞后,在近红外光的照射下光热转化剂吸收光子能量使其从基态单重态转化为激发单重态,激发的光热试剂通过与周围分子之间的碰撞返回基态,动能的增加会导致肿瘤部位周围微环境温度升高而消融肿瘤细胞[8],造成肿瘤细胞的DNA 及蛋白质等的不可逆损坏而抑制肿瘤细胞的生长[9];同时肿瘤细胞凋亡产生免疫原性细胞死亡(ICD),释放损伤相关的分子模式(DAMPs)[10],刺激树突状细胞(DC)的成熟并激活杀伤性的免疫细胞、提高相关细胞因子表达水平[11](图1).目前研究较多的光热转化剂有CuS[12]、金纳米粒子[13]、有机聚合物[14]及小分子染料[15]等.
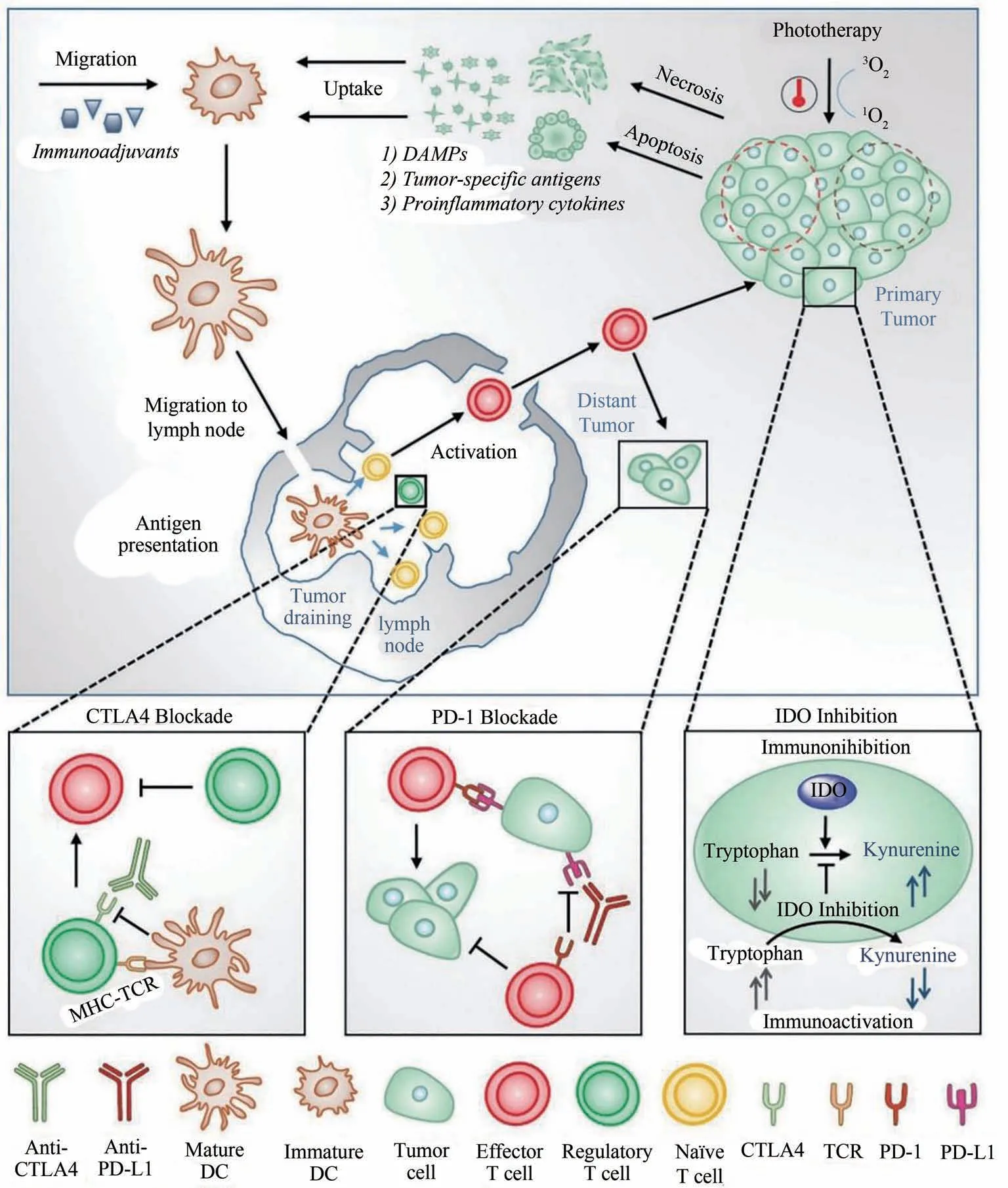
图1 光热治疗协同免疫治疗的原则概述[11]Fig.1 Overview of the principles of photothermal therapy combined with immunotherapy[11]
佐剂的加入可以改善免疫细胞的功能[16],因此PTT与免疫佐剂的联合使用成了近年来治疗远端肿瘤的研究热点.Guo 等[11]设计了基于壳聚糖包裹的可生物降解中空CuS纳米颗粒包载免疫佐剂寡聚脱氧核苷酸(CpG),该纳米粒子治疗平台结合了PTT和免疫治疗,光热消融诱导的肿瘤细胞死亡抑制肿瘤的生长,而免疫佐剂则增强宿主的抗肿瘤免疫.结果表明联合光热免疫治疗比免疫治疗或单独光热治疗对初次治疗和远端未治疗的肿瘤更有效.
PAN 等[17]选用抗原卵清蛋白(OVA)包裹小分子染料吲哚菁绿(ICG)构建OVA-ICG 纳米疫苗并评价在动物实验中肿瘤光热免疫治疗效果[18].结果显示该纳米疫苗具有抗原载药率高(80.8%)、产率高(>90%)、近红外吸收和荧光强、重复性好、稳定性好、生物相容性好等优点;在标记/跟踪DC方面较灵敏,能够协同光热免疫治疗肿瘤并有效地预防肿瘤.该策略为大规模、重复制备高抗原负载率的多功能纳米疫苗用于肿瘤治疗提供了一种较为简便可靠的方法.
除免疫佐剂外,针对免疫检查点抑制剂如PD-L1和抗CTLA4 抗体也可以极大地增强PTT 介导免疫反应[19-20].原位自体癌症疫苗(inCVAX)[21]由于抗原来自癌细胞本身,丧失了增值活性,保留了免疫原性,这使得其在联合PTT 时对不同的癌症均有疗效[22].将免疫佐剂和免疫检查点抑制剂合用于PTT治疗可综合各自的优势而产生协同作用[18].
1.2 光动力疗法协同免疫治疗
光动力治疗(PDT)被认为是癌症的一种替代疗法.光敏剂在光照条件下吸收光子变为激发电子态,能量发射为荧光、热和/或其他形式的光物理能量,如产生自由基及其离子并将能量传递给肿瘤细胞部位的氧气而产生具有细胞毒性的活性氧(ROS),特别是高活性的单线态氧(1O2)达到抗肿瘤目的[8],这样的特征使得其在癌症的治疗中发挥着重要的作用.在肿瘤部位PDT 介导肿瘤细胞对免疫的响应如图2 所示[23]:首先在近红外光的照射下产生大量的ROS 导致细胞凋亡,而凋亡的肿瘤细胞会募集单核细胞等具有清除功能的细胞同时诱导部分细胞因子的释放,将单核细胞转化为肿瘤相关巨噬细胞(TAM),而TAM 对小分子药物、尺寸较大的颗粒等有一定的吞噬作用,这使得光敏剂在TAM 中富集成为可能[24],在PDT 作用下,光敏剂将肿瘤部位的氧气转化为可以杀灭癌细胞的单线态氧(1O2),死亡的癌细胞作为抗原刺激免疫细胞的活化激活免疫反应.

图2 光动力疗法介导的免疫反应[23]Fig.2 photodynamic therapy mediated immune response[23]
将疫苗[25]、免疫检查点抑制剂[26]、IDO 酶抑制剂[27]、酸性神经酰胺酶抑制剂[28]等用于抗肿瘤研究时发现,在PDT 作用下可以明显激活免疫系统增强抗肿瘤活性.XU 等[29]设计一种基于上转换纳米颗粒(UCNPs)的多功能纳米粒子UCNP-Ce6-R837,不仅可以用于近红外诱导的PDT 直接杀伤肿瘤细胞,还可以通过触发树突状细胞的成熟和细胞因子的分泌刺激免疫应答.这种基于UCNP-Ce6-R837 的PDT 结合临床批准的CTLA4 免疫检查点阻断疗法抑制调节性T 细胞(Treg)的活性,能够有效地消除原发肿瘤,在免疫反应的作用下有效抑制远端肿瘤;此外该光动纳米粒子能诱导记忆T 细胞的成熟产生长期免疫记忆效应进而有效防止肿瘤的复发.该研究证明了以UCNP 为基础的PDT 与肿瘤免疫治疗相结合在消除原发肿瘤、抑制远处肿瘤、防止肿瘤复发方面具有显著的协同治疗效果.
在临床应用方面,PDT 从1970 年开始用于临床治疗,因其良好的重现性、选择性、低毒性以及微创等特点而被FDA 批准用于晚期的癌症患者[30],推荐用于不能手术的癌症患者[31].
1.3 光化学疗法协同免疫治疗
在低能量的近红外光作用下硅酞菁衍生物IRDye700DX(IR700)发生光致反应,能引起细胞膜的应激反应,使跨膜靶蛋白损伤而降低细胞膜的完整性导致细胞死亡[32].NAGAYA 等[33]构建基于近红外光免疫治疗(NIR-PIT)的复合体(APC)IR700,其在690 nm 近红外光的激活下可增强抗肿瘤的治疗.采用近红外光直接照射肿瘤细胞使其膨胀致细胞膜破裂,触发ICD 进而激活热休克蛋白70 和90(HSP70/90)等应激物及死亡信号钙网蛋白(CRT)、腺嘌呤核苷三磷酸(ATP)和高迁移率族蛋白B1(HMGB1)[34],这些物质协同促进DC 的成熟,随后在DC 的提呈作用下激发免疫反应[35],诱导CD8+T细胞的增值杀死肿瘤细胞(图3).复合体中光活性的染料IR700 可与多种抗体结合,其本身无毒性且易通过尿液排出体外[34].复合物中抗体的靶向性使得NIR-PIT 具有很强的选择性,这也是该方法与传统肿瘤治疗方法的最大不同点,不会对正常的非靶向细胞造成明显的副作用[36].
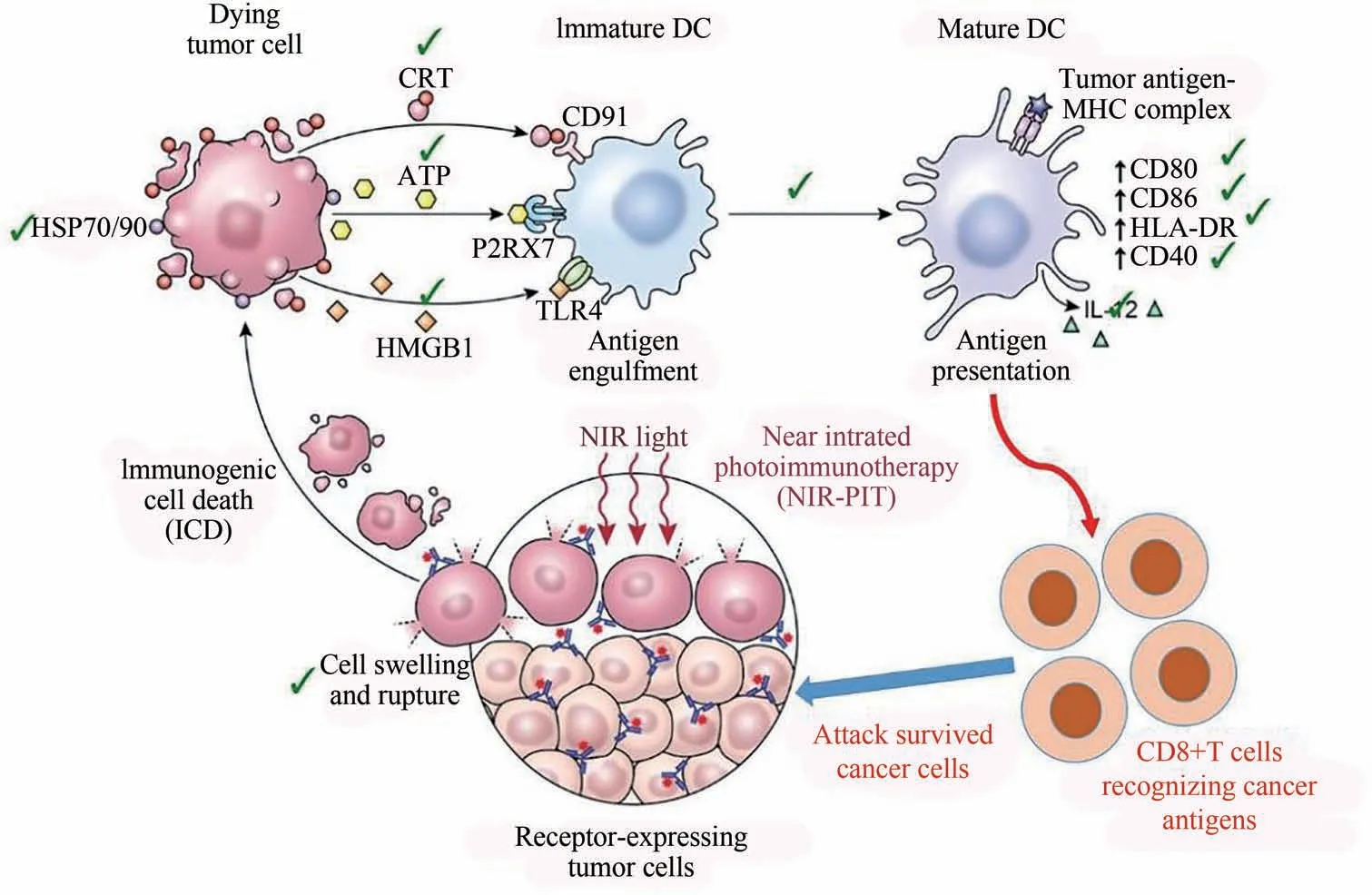
图3 NIR-PIT诱导的免疫原性细胞死亡激活免疫反应[35]Fig.3 NIR-PIT induced immunogenic cell death activates the immune response[35]
近红外光免疫治疗已经在靶向于EGFR、HER2、GPC3 等肿瘤治疗方面成功应用[33].NAGAY 等[37]描述了NIR-PIT 的有效性,将靶向表达间皮素的A431/H9 细胞的人源化抗体(hYP218)偶联到光吸收剂IR700上并与细胞共同孵育.体外实验表明hYP218-IR700 有细胞特异性杀伤作用.荷瘤小鼠动物实验结果表明hYP218-IR700 具有较高的肿瘤聚集率和较高的肿瘤背景比(TBR),近红外光照射组的肿瘤生长受到明显的抑制.
1.4 近红外荧光成像协同免疫治疗
如1.2 所述,光敏物质在近红外光照条件下吸收光子变为激发电子态后能够将能量发射为荧光或磷光,这使得近红外成像可以和多种光谱、多种治疗方法联合使用对复杂的免疫系统成像[38].与可见光相比,近红外光特别是第二近红外(NIR-II)具有更高的信号背景比(SBR)、更高的灵敏度以及成像的高分辨率等[39],这些特性赋予近红外光以优异的成像能力.因此采用合适的荧光团标记抗体[40],疫苗[41],免疫细胞(T细胞[42],B细胞[43],巨噬细胞[38],DC 细胞[44],NK 细胞[45])制备成探针,再利用近红外荧光成像可以实现免疫相关生物分子的实时监控[46],可以确定它们的生物分布及表达水平从而评估治疗效果,为治疗过程的安全性提供保障.
WAN 等[47]将荧光团(IR-BGP6)通过共价结合的方式结合到程序性细胞死亡配体-1 单克隆抗体(PD-L1 mAb)上制备成探针(anti-PD-L1-BGP6),分析了不同细胞系内PD-L1 的表达水平,实现了非侵入性的体内分子成像.肿瘤与正常组织信号背景比高达≈9.5,与在组织内非特异性蓄积的NIR-II 荧光团相比,IR-BGP6 标记的PD-L1 显著提高分子成像性能,并且该荧光团能够在肾脏快速排泄(在注射后10 h 内一般91%通过尿排出)不会引起蓄积毒性.
1.5 多种光疗协同免疫的复合疗法
多种光疗协同免疫的复合疗法是当前研究的热点,一方面是复合疗法在发挥疗效的同时也能大大降低对正常组织的伤害,另一方面得益于纳米技术和材料科学的飞速发展,基于纳米材料的光疗可能达到最佳的治疗效果.单一的光照治疗方式可能无法完全杀死肿瘤细胞而导致肿瘤细胞转移,多种光疗协同作用下可以产生足够的抗原物质[48],再辅以免疫治疗可以进一步增强抗肿瘤活性同时防止复发.多种光疗协同治疗可以在完全消融癌细胞的前提下使PTT更温和地升温而避免对正常组织的损伤,降低PDT 光敏剂可能带来的毒副作用,可视化治疗过程控制治疗效果及避免对正常细胞的损害.HAN 等[49]开发了一种超低强度近红外光同步激活的协同Chemo/PTT/PDT 纳米平台,该纳米平台由高发射上转换(UC)核、二氢卟吩e6(Ce6)光敏剂和抗癌药物盐酸阿霉素(DOX)共负载于介孔二氧化硅(MS)壳中组成,聚乙二醇修饰的石墨烯(PGO)作为光热试剂和智能开关促进药物的释放.低于皮肤最大允许照射功率(0.33 W/cm2)的808 nm 超低强度近红外光照射(0.25 W/cm2)下的轻度高热可诱导肿瘤细胞不可逆性死亡,并最大量地促进化疗药物的释放;来自UC 的660 nm 光激活Ce6 产生PDT 的活性氧,540 nm 光可以用于可视化处理过程;动物体内外抗肿瘤实验表明,超低强度近红外光同步激活的Chemo/PTT/PDT 纳米平台具有显著的疗效,并且光损伤最小.
2 近红外光协同免疫疗法在不同肿瘤中的应用研究
近红外光协同免疫疗法是非常有前景的治疗方法,近红外光可以直接及间接激活免疫系统,可同时进行成像监测治疗效果、评估在治疗过程中产生的不良反应,因此在肿瘤治疗方面具有很大的临床应用潜力.近红外光协同免疫治疗的研究中几乎都涉及纳米材料,这些纳米材料虽然表现出强大的功能和有效性,但其长期毒性及体内蓄积目前仍然不是很明确,因此在临床转化方面还有大量的工作需要做,值得鼓励的是目前已有获批临床研究的项目.
采用FDA 批准的Erbitux®(Cetuximab)抗体与光吸收剂IR700 的结合物(RM1929/ ASP1929)构建NIR-PIT 治疗平台用于复发性头颈癌患者的治疗,目前已成功地通过了Ⅰ/Ⅱ期临床试验,为了克服近红外光在组织中有限穿透深度,在肿瘤组织内插入了圆柱形扩散光纤,增强光线在整个肿瘤中的传递.选用RM1929最大可行剂量640 mg/m2,注射给药24 h后用使用690 nm 近红外光50 J/cm2照射表面病变或100 J/cm2照射间位病变.结果显示:治疗有较好的肿瘤抑制效果,尽管在治疗部位周围观察到出血和疼痛,但未观察到剂量限制性毒性或光敏性,是一种安全的治疗方法(NCT02422979).
在肝癌、肺癌、乳腺癌等的临床前研究中,光热或光动联合免疫治疗都表现出令人满意的抗肿瘤效果.HANAOKA 等[50]用光敏剂IR700 偶联抗GPC3人源性重链抗体(HN3)分别在体外和体内对荷瘤小鼠进行光免疫治疗(PIT),结果表明IR700-HN3和IR700-YP7(免疫球蛋白)介导下的NIR-PIT 在体外和体内均可导致肿瘤细胞死亡,而IR700-HN3 表现更强抗肿瘤效果.LI 等[51]构建具有荧光成像能力的近红外/pH 双响应纳米复合物CE7Q/CQ/SV(由两种铯基纳米材料CE7Q 和CQ 混合后负载SV),将分子靶向药物厄洛替尼(Er)、生存素 shRNA 表达质粒(SV)和光热剂七甲基菁染料(Cy7)整合在一个平台上,用于近红外(NIR)荧光成像和对携带表皮生长因子受体(EGFR)突变的非小细胞肺癌(NSCLC)的三联治疗.所得CE7Q/CQ/S 具有良好的光热效应、良好的DNA 结合能力和pH/NIR 双响应释放行为,体内外实验结果表明,生存素基因表达下调和光热效应可与Er协同作用,在Er敏感或Er耐药的EGFR突变的非小细胞肺癌(NSCLC)细胞中均有满意的抗肿瘤效果,该复合治疗纳米平台有望成为治疗非小细胞肺癌的候选药物.
肺转移在肿瘤细胞的生长过程中是较为常见的现象,单一光疗很难达到完全抑制的效果.LI等[52]构建了一种由半导体聚合物纳米颗粒(SPN)核心和由单线态氧(1O2)可切割连接物连接的免疫检查点抑制剂(NLG919)组成的纳米平台(OSPs)用于乳腺癌的治疗.OSPs在近红外激光照射下能够同时产生热量和氧气进行联合光疗,在消融肿瘤的同时产生肿瘤相关抗原;近红外照射可触发1O2-可裂解接头的裂解,触发免疫刺激剂从OSPs远程释放调节免疫抑制的肿瘤微环境,最终导致了小鼠异种移植瘤模型中原发/远处肿瘤的生长和肺转移的抑制.
3 总结与展望
近红外光协同免疫疗法可增强抗肿瘤效果、降低各自单独使用时所引起的不良反应,具有很大的临床应用潜能,但发展过程中还有一些瓶颈问题需要解决.首先,在利用近红外光协同免疫治疗的过程中会构建或使用一些具有高光活性、靶向性、可生物降解等优势的纳米载体,虽被证实有效但多限于体外实验或动物实验数据,况且由于个体差异及体内复杂多变的生物环境使得纳米材料在人体内的作用难以预测,临床转化方面还有大量的工作要做;其次,对于在使用PTT治疗肿瘤时所产生的温度以多少较为合适目前尚没有明确的定论,过低可能无法有效消融肿瘤细胞,过高又可能对正常组织造成伤害,还需要大量的研究去探索适宜的温度范围;再者,与可见光相比近红外光尤其是NIR-II在组织穿透方面有了极大的提高,在浅表层的肿瘤细胞杀伤方面有一定的疗效,但是在深层肿瘤细胞的损害方面依然达不到理想结果,因此近红外光的作用下协同免疫疗法用于临床仍然有很长的路要走.若能将一些先进的技术如抗干扰能力强传输路径远的光纤技术用于增强近红外光的穿透深度,将可能对深层肿瘤达到治愈的效果.
