软锰矿协同铬渣水热回收铬和锰
2024-01-16谢雅骐汪岚玢杜亚光
谢雅骐,汪岚玢,杜亚光
(中南民族大学 a.资源与环境学院;b.资源转化与污染控制国家民委重点实验室,武汉 430070)
无钙焙烧铬渣是无钙焙烧工艺生产铬酸盐和重铬酸盐过程中的副产物.无钙焙烧工艺产渣量少,铬渣/产品排渣量约为0.8 t/1 t[1].铬渣中残留约6%的铬[2],其中Cr(Ⅲ)为51000~59000 mg·kg-1[3],高迁移率、高溶解度、强毒性和致癌性的Cr(Ⅵ)为1130~8500 mg·kg-1[4-5].铬渣中残留的Cr(Ⅲ)主要由于铬铁矿在回转窑中氧化不完全导致,而Cr(Ⅵ)则是由于铬铁矿氧化焙烧后水洗浸出效率的限制所致.铬渣若未经妥善处理,其水溶性Cr(Ⅵ)可随着雨水浸出、渗透进入附近的土壤和地下水,对人类健康和环境安全构成严重威胁[6].同时,我国铬铁矿品位较低,铬铁矿主要进口自南非、澳大利亚等国[7],铬渣中大量残留的Cr(Ⅲ)未经充分利用,造成了铬资源的浪费.
铬渣在安全填埋之前需要进行解毒[8].当前,国内外无钙焙烧铬渣的干法和湿法解毒策略是将Cr(Ⅵ)还原为Cr(Ⅲ).干法解毒技术是在高温环境下利用碳、木屑和秸秆等物质产生的还原性气体将铬渣中Cr(Ⅵ)还原为Cr(Ⅲ)[9];湿法解毒技术则通过酸浸来破坏包埋Cr(Ⅵ)的物相,溶出Cr(Ⅵ)[10],并在液相中被还原剂(如硫化钠、硫酸亚铁和多硫化钙等)还原[11].然而,解毒后的铬渣存在解毒不彻底的环境风险,未解毒的Cr(Ⅵ)组分随着时间的推移可重新释放到环境中,导致已解毒铬渣“返黄”[12].出现这种情况的原因,一方面是解毒过程中铬渣中包埋Cr(Ⅵ)矿物晶体结构未被充分破坏,Cr(Ⅵ)难以被释放与还原剂接触发生氧化还原反应[13],随着时间的推移可能会经风化作用释放;另一方面是解毒后铬渣中的Cr(Ⅲ)可能被MnO2、·OH 重新氧化为Cr(Ⅵ)[14].铬渣的不完全解毒不仅导致了环境风险,还造成了铬资源的浪费.因此,为了消除已解毒铬渣的“返黄”风险,有效利用铬渣中的铬资源,需要改变传统的Cr(Ⅵ)还原解毒策略,将铬渣中的Cr(Ⅲ)氧化为Cr(Ⅵ),同时破坏铬铁矿尖晶石结构,释放出被紧密包埋的Cr(Ⅵ),实现铬的完全回收,永久消除已解毒铬渣的“返黄”环境风险.
锰(Mn)及其化合物具有优良的物理化学特性,在众多领域有着广泛应用.虽然我国锰矿产量和储备量不低,但随着工业不断发展,优质锰矿资源逐渐枯竭.我国锰矿的平均品位在22%左右,受冶金技术限制难以高效还原浸出[15].目前低品位软锰矿的处理技术主要有焙烧还原和湿法还原.焙烧还原技术通常在高温下加入碳质还原剂、气体还原剂或生物质类还原剂[16],将MnO2分步还原成MnO 再溶解到酸中得到Mn(Ⅱ)[17],该过程会消耗大量能源并产生温室气体.与之相比,湿法还原不产生温室气体,环境污染小,但是湿法通常需要将软锰矿和还原剂混合在浓酸性溶液中反应浸出[18],工业生产成本过高.因此亟待寻找一种更加经济的还原剂和更加环保的技术去实现软锰矿还原浸出的工业化生产.
本文以软锰矿中的MnO2作为氧化剂,与硫酸进行水热反应氧化铬渣中Cr(Ⅲ),同时通过Cr(Ⅲ)的氧化破坏主要包埋Cr(Ⅵ)的铬铁尖晶石结构,释放出包埋的Cr(Ⅵ),彻底解决铬渣解毒不充分的问题,实现软锰矿中锰的还原.Cr(Ⅵ)和Mn(Ⅱ)同步浸出能有效减少能源消耗,实现废物的资源化利用.试验系统考察了反应温度、铬渣和软锰矿质量比、反应时间、硫酸浓度等条件对铬渣中Cr(Ⅵ)解毒效率和锰浸出效率的影响,以确定最佳的工艺条件.对反应前后的铬渣和软锰矿进行了X 射线衍射(XRD)、扫描电镜能谱(SEM-EDS)分析,探究软锰矿对铬渣解毒的作用机理,为软锰矿的还原浸出和铬渣解毒与资源化利用提供一定的理论参考.
1 试验
1.1 试验材料、试剂与仪器
软锰矿样品来自中国广西省某锰冶炼厂.铬渣来源于中国湖北省某铬盐厂.试验样品都能通过200 目筛.使用德国Bruker 技术有限公司D8-Advance 型X 射线衍射仪(X-ray Diffraction,XRD)分析样品物相组成.使用Revvity 有限公司Avio 200 型电感耦合等离子体原子发射光谱(Iductively Cupled Pasma,ICP)测量元素含量.日本Hitachi股份有限公司SU8010 型扫描电子显微镜(Scanning Electron Microscope,SEM),与英国Oxford 有限公司X-MAX型能谱仪(Energy Dispersive Spectrometer,EDS)组合对样品进行成分分析.使用荷兰PANalytical 公司Axiosadvanced 型X 射线荧光光谱仪(X-ray Fluorescence Spectrometer,XRF)分析铬渣和软锰矿的化学成分,铬渣的主要化学成分有:Fe2O3、Al2O3、Na2O、SiO2、Cr2O3、CaO、MgO,质量分数分别为:34.52%、9.35%、8.56%、5.14%、6.81%、7.01%、2.05%;软锰矿的主要化学成分有:Fe2O3、Al2O3、MnO、SiO2、CaO、MgO,质量分数分别为:10.73%、6.01%、53.06%、14.64%、0.36%、0.23%.
其他仪器有:高压平行反应器(SLP250,北京世纪森朗反应器实验仪器);pH 计(ST3100/F,奥豪斯仪器);循环水式多用真空泵(SHB-ⅢA,上海卫凯仪器设备);双光束紫外可见分光光度计(UV-6100,上海美谱达);试管旋转摇床(QB-210 型,海门市其林贝尔仪器);磁力搅拌器(524G 数显恒温,上海梅颖浦仪器仪表).
试验中使用的试剂均为分析级.二苯碳酰二肼(C13H14N4O)购自南京化学试剂厂;硫酸(H2SO4)、丙酮(C3H6O)、高锰酸钾(KMnO4)购自成都科隆有限公司;氢氧化钠(NaOH)、高碘酸钾(KIO4)、磷酸(H3PO4)、三水合焦磷酸钾(K4P2O7·3H2O)、三水合乙酸钠(CH3COONa·3H2O)购自国药集团.试验中使用的去离子水是通过Millipore-q系统获得.
1.2 试验流程
将铬渣与软锰矿按照质量比(0.5∶1、0.75∶1、1∶1)称取,按照一定固液比量取一定体积的不同浓度硫酸,混合放入密闭的反应釜中升温反应,冷却至室温后对其进行过滤,得到滤液和滤渣.取少量滤液用分光光度计测量浸出Cr(Ⅵ)和锰含量,在剩余滤液中加入NaOH 固体调至pH=6 过滤除去铝和铁等杂质,再向得到的滤液中加入Na2CO3调至pH=10过滤分离碳酸锰沉淀得到高浓度的含Cr(Ⅵ)溶液,试验流程如图1.同时对解毒前的铬渣以及最佳工艺条件下反应得到的滤渣进行毒性浸出和碱消解.

图1 试验流程图Fig.1 Flow diagram of the experiment
1.3 化学元素分析测试方法
1.3.1 Cr(Ⅵ)含量的测定
采用碱消解法(GB 5085.3—2007)消解解毒前后的铬渣,毒性特征浸出方法(TCLP)浸出铬渣解毒前后的Cr(Ⅵ),二苯碳酰二肼分光光度法(GB/T 15555.4—1995)测定转移至液体中的Cr(Ⅵ)含量.所有测试平行重复3次,并评估相对误差.操作方法如下[19].
碱消解法:取(2.5±0.10)g 铬渣,加50 mL 消化溶液(20 g NaOH 和30 g Na2CO3溶于1 L 容量瓶)、0.4 g MgCl2和0.5 mL 1 mol·L-1磷酸盐缓冲液,90 ℃消解60 min,冷却,过0.45 μm 膜,少量去离子水洗涤3 遍后,再用5 mol·L-1硝酸pH 调至7.5±0.5,如果有絮状沉淀,需要加一次过滤操作.最后将溶液转移到100 mL容量瓶中,用去离子水定容,摇匀.
毒性特征浸出法:将待测样品与提取剂(5.7 mL冰醋酸稀释至1 L)以固液比1∶20混合,震荡(18±2)h,完成后,取上清液通过0.45 μm膜.
测定:在50 mL比色管中加入适量待测液,定容后加0.5 mL 硫酸、0.5 mL 磷酸,2 mL 二苯碳酰二肼显色剂,摇匀,放置10 min 显色于波长540 nm 测定Cr(Ⅵ)含量.测量解毒前铬和锰元素含量,解毒后溶液中Cr(Ⅵ)和锰含量(mg/L),计算Cr(Ⅵ)和锰浸出率.
式中:μ为锰或铬的浸出效率,%;ρ0为初始铬渣中的总铬含量或初始软锰矿中的锰含量,mg·L-1;ρ1为浸出液中的Cr(Ⅵ)或锰含量,mg·L-1.
1.3.2 Mn含量的测定
采用高碘酸钾分光光度法(GB 11906—1989)在50 mL比色管中加入适量待测液,定容后加10 mL焦磷酸钾-乙酸钠缓冲液(K4P2O7·3H2O 230 g,CH3COONa·3H2O 136 g 溶于1 L 容量瓶),3 mL 高碘酸钾溶液[2 g 高碘酸钾溶于100 mL 硝酸(1+9)溶液],定容摇匀,放置10 min显色.
2 结果与讨论
2.1 反应参数对Cr(Ⅵ)浸出的影响
2.1.1 反应温度对铬浸出速率的影响
在反应时间1.5 h、H2SO4浓度3 mol·L-1、铬渣与软锰矿的质量比1∶1、固液比1∶20的情况下,考察不同反应温度下(30、60、90、120、150 ℃)Cr(Ⅵ)和Mn(Ⅱ)浸出率的影响,结果见图2.由图2可见:随着温度的升高,Cr(Ⅵ)和Mn(Ⅱ)的浸出率也随之提高,Cr(Ⅵ)的浸出率从30 ℃的13.87%提高到150 ℃的100%,锰的浸出率从30 ℃的11.93%提高到150 ℃的89.12%.30 ℃至90 ℃,Cr(Ⅵ)浸出率仅提高了8.44%,90 ℃至150 ℃ Cr(Ⅵ)浸出急剧提高,120 ℃至150 ℃锰的浸出率急剧升高.温度升高分子运动速度提升,分子碰撞频率增加,铬渣中的矿物相加快分解.考虑耗能,反应温度150 ℃为合适的反应温度.
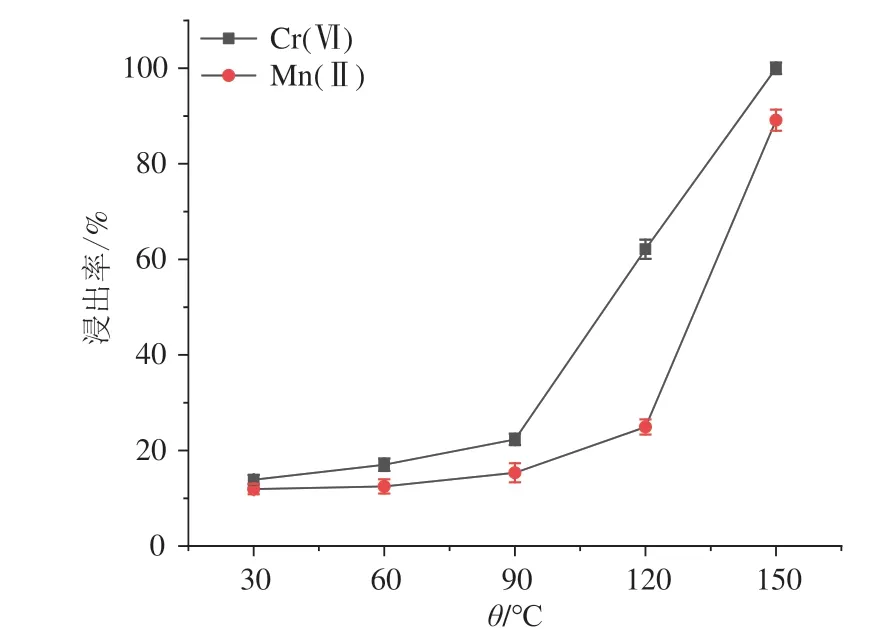
图2 反应温度对Cr(Ⅵ)和Mn(Ⅱ)浸出率的影响Fig.2 Effect of reaction temperature on the leaching rate of Cr(Ⅵ)and Mn(Ⅱ)
2.1.2 铬渣与软锰矿质量比对铬浸出速率的影响
在温度150 ℃、反应时间1.5 h、H2SO4浓度3 mol·L-1、固液比1∶20的情况下,考察铬渣和软锰矿质量比0.5∶1、0.75∶1、1∶1 对浸出率的影响.结果见图3.

图3 铬渣与软锰矿质量比对Cr(Ⅵ)和Mn(Ⅱ)浸出率的影响Fig.3 Effect of mass ratio of COPR to pyrolusite on the leaching rate of Cr(Ⅵ)and Mn(Ⅱ)
由图3 可见:当铬渣和软锰矿质量比为0.5∶1时,Cr(Ⅵ)和Mn(Ⅱ)的浸出率分别为70.2%和65.5%.随着铬渣加入量(铬渣/软锰矿质量比)逐渐增多,Cr(Ⅵ)和Mn(Ⅱ)的浸出率也随之提高,当铬渣和软锰矿的质量比为1∶1 时,Cr(Ⅵ)和Mn(Ⅱ)的浸出率分别达到100%和89.33%.结合XRF结果,锰氧化物质量分数为53.06%,铬氧化物质量分数为6.81%,在实际反应过程中MnO2含量大于Cr(Ⅲ),溶液体系中存在亚铁离子消耗了一部分MnO2.当铬渣软锰矿质量比继续增加,Cr(Ⅵ)浸出效率已经无法再提高,为了高效处理大量铬渣,选择质量比1∶1为最佳条件.
2.1.3 反应时间对铬浸出速率的影响
反应时间也是铬渣解毒中需要考察的一个重要参数,在温度150 ℃,H2SO4浓度3 mol·L-1,铬渣与软锰矿的质量比1∶1,固液比1∶20的情况下,考察反应时间对浸出率的影响规律,结果见图4.

图4 反应时间对Cr(Ⅵ)和Mn(Ⅱ)浸出率的影响Fig.4 Effect of reaction time on the leaching rate of Cr(Ⅵ)and Mn(Ⅱ)
由图4 可见:Cr(Ⅵ)浸出率变化趋势与Mn(Ⅱ)变化一致,这说明反应过程中主要是进行Cr(Ⅲ)和MnO2之间的反应.Cr(Ⅵ)和Mn(Ⅱ)的浸出率随着时间的推移明显增加,铬渣和软锰矿逐渐被硫酸侵蚀,金属离子得以进一步释放,Cr(Ⅵ)浸出率变化趋势与锰变化一致,在1.5 h 时达到最大值,但当时间大于1.5 h,Cr(Ⅵ)和Mn(Ⅱ)的浸出率下降,Mn(Ⅱ)浸出率到4 h 时稳定在55.9%,Cr(Ⅵ)浸出率稳定在约81.6%.分析超过1.5 h Cr(Ⅵ)和Mn(Ⅱ)的浸出率下降的原因,可能是硫酸锰发生分解[20],反应反向进行,Mn(Ⅱ)再次被氧化成MnO2,Cr(Ⅵ)被还原导致.反应过程如下:
2.1.4 硫酸浓度对铬浸出速率的影响
在温度150 ℃、保温时间1.5 h、铬渣与软锰矿的质量比1∶1,固液比1∶20 的情况下,考察不同H2SO4浓度(1、2、3 mol·L-1)对Cr(Ⅵ)和Mn(Ⅱ)浸出率的影响,同时设蒸馏水水热浸出为对照,结果见图5.由图5可见:用蒸馏水处理得到的Cr(Ⅵ)和Mn(Ⅱ)的浸出率仅为11.21%和10.26%,随着硫酸浓度的增加,Cr(Ⅵ)和Mn(Ⅱ)的浸出率也随之增加,在硫酸浓度为3 mol·L-1时Cr(Ⅵ)达到最大浸出率、锰的浸出率为89.15%.在其他条件一致的情况下,加入3 mol·L-1硫酸反应得到的Cr(Ⅵ)浸出率约为加入蒸馏水反应得到Cr(Ⅵ)浸出率的10倍.硫酸浓度的增大显著提高了Cr(Ⅵ)和Mn(Ⅱ)的浸出效率.这说明酸性环境有助于包埋Cr(Ⅵ)的铬铁尖晶石的溶解.在硫酸浓度为1 mol·L-1时出现锰浸出率明显高于Cr(Ⅵ)浸出率的异常现象,这可能是由于在硫酸浓度较低时,包埋Cr(Ⅵ)的铬铁尖晶石结构耐酸难以分解,Cr(Ⅵ)浸出浓度下降,MnO2除与Cr(Ⅲ)反应外还有相当一部分与亚铁离子发生反应,锰浸出浓度增加.

图5 硫酸浓度对Cr(Ⅵ)和Mn(Ⅱ)浸出率的影响Fig.5 Effect of sulfuric acid concentration on the leaching rate of Cr(Ⅵ)and Mn(Ⅱ)
2.1.5 固液比对铬浸出速率的影响
在温度150 ℃、反应时间1.5 h、H2SO4浓度3 mol·L-1、铬渣与软锰矿的质量比1∶1 的情况下,考查固液比1∶5、1∶10、1∶15、1∶20对浸出率的影响,结果见图6.
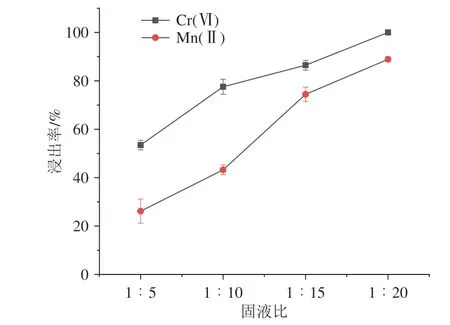
图6 固液比对Cr(Ⅵ)和Mn(Ⅱ)浸出率的影响Fig.6 Effect of solid-liquid ratio on the leaching rate of Cr(Ⅵ)and Mn(Ⅱ)
由图6 可见:随着反应物中硫酸体积的增加,Cr(Ⅵ)和Mn(Ⅱ)的浸出率均逐渐增高,当固液比达到1∶20 时Cr(Ⅵ)的浸出率提高到100%,锰的浸出率提高到88.92%.这表明在浸出过程中硫酸溶液量的增多,可以增加矿物与硫酸溶液的接触面积,提高反应过程中的传质效应,促进矿物溶解,提高浸出效率.反应物硫酸体积继续增加,对Cr(Ⅵ)和Mn(Ⅱ)的浸出率无明显提高,考虑硫酸的经济成本,选择固液比1∶20为最佳参数.
2.2 解毒铬渣化学特性
铬渣解毒前Cr(Ⅵ)总量是5758.14 mg·kg-1,Cr(Ⅵ)浸出质量浓度是277.23 mg·L-1,总铬浸出质量浓度是280.25 mg·L-1.在反应温度为150 ℃,反应时间1.5 h,铬渣与软锰矿质量比为1∶1,固液比1∶20,3 mol·L-1硫酸下解毒后的铬渣经过碱消解后Cr(Ⅵ)总量是0.32 mg·L-1,且解毒后铬渣中Cr(Ⅵ)浸出质量浓度和总铬浸出质量浓度均低于检出限.用软锰矿水热处理后的铬渣的浸出总铬和Cr(Ⅵ)浓度低于国家标准(GB 5085.3—2007)中规定的15 mg·L-1和5 mg·L-1.该试验结果表明Cr(Ⅵ)完全浸出,软锰矿辅助铬渣解毒效果显著.解毒后渣的化学主要成分为:MnO、SiO2、Fe2O3、Al2O3、Cr2O3、K2O、MgO,质量分数分别为55.47%、36.39%、2.87%、0.913%、0.65%、0.567%、0.471%.
2.3 金属回收
酸性条件下水热得到的固体不溶物和溶液体系中的金属离子成分复杂,溶液体系中含有浸出的Cr(Ⅵ)、Fe3+、Mg2+、Al3+.XRF 的数据显示解毒铬渣中Fe2O3的质量分数是34.52%,与贫铁矿含铁质量分数为30%~40%的品位相当,是一种潜在铁矿资源.为实现对解毒渣和浸出液的资源化利用,对浸出液中的有价金属进行回收处理,对解毒渣处理后用作混凝土掺合料.NaOH 调节浸出液的pH=6 去除其中的铁、铝等杂质,可进一步处理回收Fe.Na2CO3调节pH=10,过滤得到碳酸锰沉淀[21],对Mn(Ⅱ)进行回收.MnCO3在过滤操作中损失,pH=6 时溶液中形成的胶体Al(OH)3、Fe(OH)3带走了一部分锰离子.剩余的滤液中含有高浓度Cr(Ⅵ),将滤液返回无钙焙烧铬铁矿工艺流程中处理,得到铬酸盐产品.
2.4 铬渣解毒前后的表征
2.4.1 样品的物相组成分析
取在最佳条件解毒后的渣、原铬渣和软锰矿三种样品,进行XRD分析,结果见图7.

图7 原铬渣、解毒后渣以及软锰矿的XRD图谱Fig.7 XRD patterns of raw COPR,detoxified slag and pyrolusite
由图7 可知:原铬渣在2θ=36°左右,出现最强衍射峰,其主要物相是铬铁矿,以及少量镁铁尖晶石镁铬矿、镁铁矿.与未经处理的铬渣相比,在最佳反应条件下处理后,渣中的矿物结构发生了很大变化,Cr 宿主相铬铁矿的衍射峰消失,出现Fe2O3、SiO2和MnO2的衍射峰,Fe2O3相和SiO2相是反应后暴露,而MnO2衍射峰相比原软锰矿变强,是由于软锰矿中锰的浸出率只有89.15%,剩余MnO2残留在固相中.从反应后渣的物相的相对强度可以看出锰的品位有提高,这意味着解毒后的渣可以用于钢铁材料的生产,为解毒后渣的再利用提供了方向.
2.4.2 样品中的特征形态和元素分布分析
根据图8 铬渣的元素分析和原子比分析,晶体是含有Mg 的尖晶石相.在反应后的元素中几乎没有Cr和Mg,这与XRD 的结果一致.说明在最佳条件下水热反应,铬渣中稳定致密的尖晶石结构被完全破坏,Cr(Ⅵ)几乎全部向溶液中转移.为了揭示微观结构与元素之间的关系,确定Cr 与Fe、O、Mg、Si 的分布和相关性,更加准确地了解铬渣中Cr的赋存形态,结合图9 铬渣在最佳条件下处理后的特征形态和元素分布图,可见解毒后渣的颗粒尺寸明显地减小,有许多裂痕和不平整的边缘.在酸性条件下H+破坏尖晶石之间的结合力,形成许多裂痕[22].晶体内部的Fe(Ⅱ)在MnO2的作用下被氧化为Fe(Ⅲ),破坏晶体内部分较强的化学键,进一步破坏物相结构[23].Si 元素与O、Fe、Mn 有很强的相关性,结合XRD 和EDS 映射,Si 的衍射峰增强且均匀分布在解毒后渣中,表明Cr(Ⅵ)的浸出,可能是Si的取代所致.
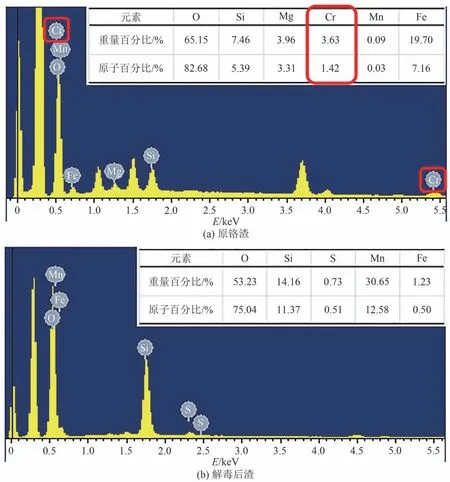
图8 EDS图谱和元素组成Fig.8 EDS mapping and elemental composition
2.4.3 铬渣酸浸解毒机制
根据Cr(Ⅵ)的浸出结果和表征分析可知:铬渣中大部分被包埋的Cr(Ⅵ)存在于镁铁矿、铬铁矿等基质中,用硫酸处理铬渣,H+可以溶解镁铁矿、铬铁矿等,促进Cr(Ⅵ)释放,同时SO42+可与CrO42-进行阴离子交换进一步增强Cr(Ⅵ)的释放[10].MnO2氧化性位于Cr(Ⅲ)和Cr(Ⅵ)之间,在水热解毒过程中,酸性条件破坏软锰矿结构浸出MnO2与铬渣中Cr(Ⅲ)反应生成Cr(Ⅵ)、Mn(Ⅱ),进一步加剧铬尖晶石的溶解,提高Cr(Ⅵ)的浸出率.物相结构被破坏,Cr(Ⅵ)从固体基质转移至溶液,Cr(Ⅲ)被氧化成可溶性Cr(Ⅵ)转移至溶液.结合总铬浸出质量浓度低于检出限,可以判断Cr 完全释放到溶液中,最后对铬酸盐和Mn(Ⅱ)进行回收来实现铬渣的解毒与资源化利用.主要反应如下:
3 结论
(1)随着反应温度的升高、软锰矿和铬渣质量比的提高、反应时间的积累、硫酸浓度的增加、硫酸体积的增加,铬渣中Cr(Ⅵ)和锰的浸出效率不断提高.最佳的工艺条件为反应温度150 ℃、反应时间1.5 h、软锰矿和铬渣的质量比1∶1、硫酸浓度3 mol·L-1、固液比1∶20.此条件处理下Cr(Ⅵ)的浸出率为100%,锰的浸出率为89.15%,总铬浸出浓度低于检出限,符合国家排放标准.
(2)铬渣解毒前后的XRF、XRD、SEM-EDS 显示,铬渣中的主要物相组成是铬铁矿、镁铬矿和镁铁矿.反应后铬渣中的铬可以完全转移至溶液中回用,反应过程不产生其他新物质,解毒过程安全.
(3)该试验不仅完成铬渣的完全解毒,解决了铬渣“返黄”的现象,还可以回收铬资源和软锰矿中的锰资源.
