基于多孔金@铂纳米酶的比色型生物传感器用于检测牛乳中鼠伤寒沙门氏菌研究
2024-01-16苑懿黄羽文邢巾张宇
苑懿,黄羽文,邢巾,张宇
(东北农业大学食品学院乳品科学教育部重点实验室,哈尔滨 150030)
0 引 言
鼠伤寒沙门氏菌是一种常见的食源性致病菌,常以肉制品、蛋制品、水产品及乳制品等食品为传播媒介,进入人体消化道释放致病因子[1-3],引起腹痛、腹泻、胃肠炎和发热等症状,严重可导致死亡[4]。在2016年全国共报告的食源性疾病中,有23.9%的暴发事件是由沙门氏菌感染引起,它是造成食源性疾病的第二大致病菌[5],可出现在乳制品加工、运输、储存、销售等各个环节[6]。我国原料奶的质量标准远低于乳业发达国家[7],因此,发展鼠伤寒沙门氏菌快速检测,实现其早期筛查具有重要的现实意义。
目前针对鼠伤寒沙门氏菌检测方法中,培养计数法是金标准方法,灵敏度高,但耗时长[8];ELISA 是很多细菌的推荐检测标准,检测速度较快,但灵敏度偏低[9-10];PCR 也是推荐标准方法,灵敏度较高,检测速度也较快,但依赖于热循环器,不适合进行现场检测[11-12]。以上检测方法均无法实现快速、现场、高灵敏的微生物检测,无法满足实际检测要求。因此亟需开展快速灵敏、低成本和操作简便的比色型生物传感器用于鼠伤寒沙门氏菌的筛查。常用的比色策略是基于天然酶的催化作用[13],但生物酶易失活、不易储存、分离难、提取成本高,难以大规模应用[14-15]。近年来,研究发现成本低、稳定性高的贵金属纳米酶具有类过氧化物酶的催化活性,包括Au、Ru、Pd、Pt 和Os[16-18]。金纳米粒子(Gold nanoparticles,AuNPs)制备简单,生物相容性高[19],向其中引入其它金属来构建多金属纳米结构和核壳结构[20],产生协同效应,有助于提高酶活性[21-22]。LIU A[23]等构建了Ag@Au 核/壳的三角形纳米片作为葡萄糖比色检测的纳米探针,引入金壳不仅提高了银纳米片的稳定性,还赋予材料葡萄糖氧化酶(GOD)和辣根过氧化物酶(HRP)类双重酶催化活性。免疫磁分离技术是一种在外加磁场作用下将目标细菌从样本溶液中分离、富集的方法,通过具有铁磁性的纳米粒子的表面修饰目标细菌抗体的特异性识别来实现[24-26]。
本研究建立了一种基于多孔Au@PtNCs 的比色型生物传感器。将Anti-S. typhimurium-mAb 与Au@Pt-NCs 静电吸附偶联形成Au@PtNCs@mAb,用羧基化磁珠(MNPs-COOH)与Anti-S. typhimurium-pAb 进行共价偶联形成MNPs@pAb。两者与鼠伤寒沙门氏菌溶液充分混合反应形成MNPs@pAb-S. typhimurium-Au@PtNCs@mAb 免疫磁细菌复合物,磁分离及富集。由于Au@PtNCs 优良的类过氧化物酶催化特性,加入H2O2-TMB 进行催化反应,溶液颜色由无色逐渐变为蓝色,最后使用酶标仪测定652 nm 处的吸光度,从而测定计算目标细菌浓度来实现可视化快速检测。
1 材料与方法
1.1 材料与试剂
以鼠伤寒沙门氏菌(ATCC 14028)为研究模型,蜡样芽孢杆菌(CICC 10041)、单核细胞增生李斯特菌(ATCC 13932)和大肠杆菌O157∶H7(ATCC 43888)作为非靶向目标细菌。
Anti-S. typhimurium-mAb(1 g/L),Meridian 公司;Anti-S. typhimurium-pAb(2.8 g/L),Fitzgerald 公司;三水合氯金酸(Ⅲ)、氯铂酸、柠檬酸三钠、抗坏血酸、PVP(10 ku)、脱脂乳和牛血清白蛋白,Sigma Aldrich 公司;PBS 及PB 缓冲液、H2O2-TMB,索莱宝公司;BHI 培养基和LB 培养基,北京奥宝生物技术公司;MNPs-COOH(直径180 nm),上海So-Fe 生物医药公司;EDC,D&B 生物;NHSS,Yanye 生物技术公司;其他试剂均为市售分析纯级,北京国药集团。
1.2 仪器与设备
Millipore 超纯水系统,Millipore 公司;超声波清洗仪,昆山超声波仪器有限公司;全波段酶标仪Infinite M200,北京赛百奥科技有限公司;96 孔透明酶标板,康宁公司;高速冷冻离心机,湖南湘仪有限公司;混匀仪和振荡器,Scientific Industries 公司;恒温培养箱,Benchmark 公司;JEOL JEM-1200EX 透射电子显微镜,JEOL 公司。
1.3 方法
1.3.1 多孔Au@PtNCs 制备
首先采用柠檬酸三钠还原法合成13 nm AuNPs[27],并进行了一些修改。多孔Au@PtNCs 的形成是以AuNPs 为核进行层层生长。具体合成方案如下:取31 μL AuNPs(10 mmol/L)加入969 μL 去离子水中,然后加入20 μL PVP(质量分数10%)在室温下均匀混合5 min。然后加入60 μL 氯铂酸(100 mmol/L)和40 μL 100 g/L抗坏血酸并加热至70 °C,反应15 min,溶液颜色由红变黑,表明成功合成Au@PtNCs。将其冷却至室温,4 ℃下离心(5 500 r/min,10 min)处理2 次去除上清,沉淀用1.0 mL 的去离子水复溶,并于4 °C 储存备用。
1.3.2 免疫Au@PtNCs 探针制备
免疫Au@PtNCs 探针制备具体步骤如下:取500 μL合成的1.3.1 溶液,4 °C 下离心(5 500 r/min,10 min),使用PBS(0.01 mol/L,pH 7.4)清洗1 次,去除多余的PVP,使用500 μL PBS(0.01 mol/L,pH 7.4)复溶,并加入25 μg Anti-S. typhimurium-mAb,室温下静电吸附3.5 h,反应结束加入50 μL BSA 溶液(10%),封闭多余位点,封闭时间为1.5 h,封闭结束之后,4 °C 下离心(5 500 r/min,10 min),使用PBS(0.01 mol/L,pH 7.4)清洗1 次,去除多余未修饰的抗体,沉淀使用500 μL的专用复溶液复溶,并置于4 °C 保存。
专用复溶液:10% 的蔗糖溶液+1% 的脱脂乳+1%的PVP,配置时可用30% 的蔗糖溶液+3% 的脱脂乳+3% 的PVP 等体积混合,溶剂为PB(0.01 mol/L,pH 8.0)。
1.3.3 免疫MNPs 的制备
取1 mg 的直径为180 nm MNPs-COOH,用PB(0.01 mol/L,pH 6.0)清洗2 次,磁富集去除上清液,用1 mL PB(0.01 mol/L,pH 6.0)复溶;再加入EDC、NHSS,控制二者最终浓度为0.1 g/L,于室温下反应30 min 以达到活化羧基,反应结束磁吸用PB(0.01 mol/L,pH 6.0)清洗去除多余的EDC、NHSS;将富集物于1 mL PB(0.01 mol/L,pH 8.0)复溶,加入200 μg Anti-S.typhimurium-pAb 置于室温下反应3 h 偶联抗体,反应结束加入100 μL 脱脂乳,封闭2 h,封闭结束磁富集清洗,于4 °C 下保存备用。
1.3.4 免疫探针合成条件优化
1.3.4.1 标记pH
将20 μL Au@PtNCs 与20 μg Anti-S. typhimurium-mAb 使用HCl(1 mol/L)和NaOH(1 mol/L)分别调节pH 至5、6、7、8、9 的条件下进行偶联,反应结束之后,4 ℃下离心(5 500 r/min,10 min)去除上清,最后将探针与1 mL 复溶液复溶,于4 ℃保存备用。取制备的免疫探针不同偶联pH 条件20 μL Au@PtNC@mAb与20 μL MNPs@pAb 和1 mL 浓度为1.1×103CFU/mL的鼠伤寒沙门氏菌于室温下反应1 h,磁回收洗涤3次后,加入200 μL H2O2-TMB,在37 ℃中孵育10 min后用酶标仪测定OD652nm。
1.3.4.2 抗体偶联时间
将20 μL Au@PtNCs 与20 μg Anti-S. typhimurium-mAb 在最佳pH 条件下进行不同的偶联时间,反应结束之后,4 ℃下离心(5 500 r/min,10 min)去除上清,最后将探针与1 mL 复溶液复溶,于4 ℃保存备用。在不同偶联时间条件下,取制备的免疫探针20 μL Au@PtNC@mAb 与20 μL MNPs@pAb 和1 mL 浓度为1.1× 103CFU/mL 的鼠伤寒沙门氏菌于室温下反应1 h,磁回收洗涤3 次后,加入200 μL H2O2-TMB,在37 ℃中孵育10 min 后用酶标仪测定OD652nm。
1.3.4.3 抗体饱和标记量
基于1.3.4.2 中所优化的检测条件,将20 μL Au@PtNCs 与10、15、20、25、30 μg Anti-S. typhimuriummAb 进行偶联,反应结束之后,4 ℃下离心(5 500 r/min,10 min)去除上清,最后将探针复溶于1 mL 复溶液,于4 ℃保存备用。取制备的免疫探针,即在不同抗体标记量下的20 μL Au@PtNC@mAb 与20 μL MNPs @pAb和1 mL 浓度为1.1× 103CFU/mL 的鼠伤寒沙门氏菌于室温下反应1 h,磁回收洗涤3 次后,加入200 μL H2O2-TMB,在37 ℃中孵育10 min 后用酶标仪测定OD652nm。
1.3.4.4 Au@PtNCs 探针用量
基于1.3.4.3 中所优化的检测条件,将不同用量的免疫探针5、10、20、30、40 μL Au@PtNCs@mAb,与20 μg MNPs@pAb 和1 mL 浓度为1.1× 103CFU/mL 的鼠伤寒沙门氏菌于室温下反应1 h,磁回收洗涤3 次后,加入200 μL H2O2-TMB,在37 ℃中孵育10 min 后用酶标仪测定OD652nm。
1.3.4.5 免疫学反应时间
基于1.3.4.4 中的所优化的检测条件,取30 μL Au@PtNCs@mAb 与20 μg MNPs@pAb 和1 mL 浓度为1.1×103CFU/mL 的鼠伤寒沙门氏菌在室温下反应,将反应时间分别设定为10、20、30、40、50、60 min,磁回收洗涤3 次后,加入200 μL H2O2-TMB,在37 ℃中孵育10 min 后用酶标仪测定OD652nm。
1.3.5 比色传感器性能检测
1.3.5.1 检测标准曲线的构建
在1.3.4 中优化的检测条件下,分别加入0 以及97~ 9.7×106CFU/mL 不同浓度的鼠伤寒沙门氏菌,设定7 个浓度梯度,并根据1.3.4 中的方法以及优化条件,加入一定量的Au@PtNCs 探针和免疫MNPs,在室温下内反应50 min 后,磁回收洗涤3 次,随后加入200 μL H2O2-TMB,用酶标仪测定OD652nm(每个浓度重复3 次),记录相应的平均OD 值。
1.3.5.2 特异性实验
通过检测其它3 株常见的食源性致病菌来评价该比色传感器的特异性。对靶菌(鼠伤寒沙门氏菌)、非靶菌(大肠杆菌O157:H7、单核细胞增生李斯特菌和蜡样芽孢杆菌)以及它们的混合物,根据1.3.4 中的方法以及优化的条件,加入一定量的免疫Au@PtNCs和免疫MNPs,在室温下反应一定时间后,磁回收洗涤3 次,随后加入200 μL H2O2-TMB 并置于37 ℃中孵育10 min,用酶标仪测定OD652nm(每个浓度重复3次),记录相应的平均OD 值。
1.3.5.3 实际样品检测
为确定该比色型生物传感器在真实样品检测中的实用性及可行性,进行实际样品加标回收实验。按照国标方法处理牛乳样本,取上清液与不同浓度的鼠伤寒沙门氏菌混合,采用批内和批间2 种方法。批内实验测定连续1 d,同一天重复3 次,批间实验测定连续3 d,每天1 次,每个浓度均3 次重复。
2 结果与分析
2.1 多孔Au@PtNCs 制备与表征
首先利用柠檬酸三钠还原法合成13 nm AuNPs,呈淡红色,用紫外—可见吸收光谱表征其光学性能,如图1(a)所示,AuNPs 在520 nm 附近出现了很强的光吸收峰,同时通过TEM 对其形貌进行微观表征,如图1(b)所示,结果表明材料制备成功,具有良好的单分散性。基于此,以13 nm AuNPs 为核进行生长,Pt形成多孔Au@ PtNCs,如图1(a)所示,Au@PtNCs 溶液变为棕色,通过紫外—可见吸收光谱进行分析,波长在520 nm 处AuNPs 的吸收峰消失,这是由于Pt 壳沉积在Au@PtNCs 表面上引起的阻尼效应屏蔽了AuNPs 较强的表面等离子体共振,这与先前的研究一致[28],表明Au@PtNCs 已形成核壳结构。随后进一步通过TEM 对其进行微观表征,如图1(c)所示,结果表明合成了粒径均一且分布在100 nm 的Au@PtNCs。综上,本研究成功合成出了粒径均一、分散性较好的Au@PtNCs。
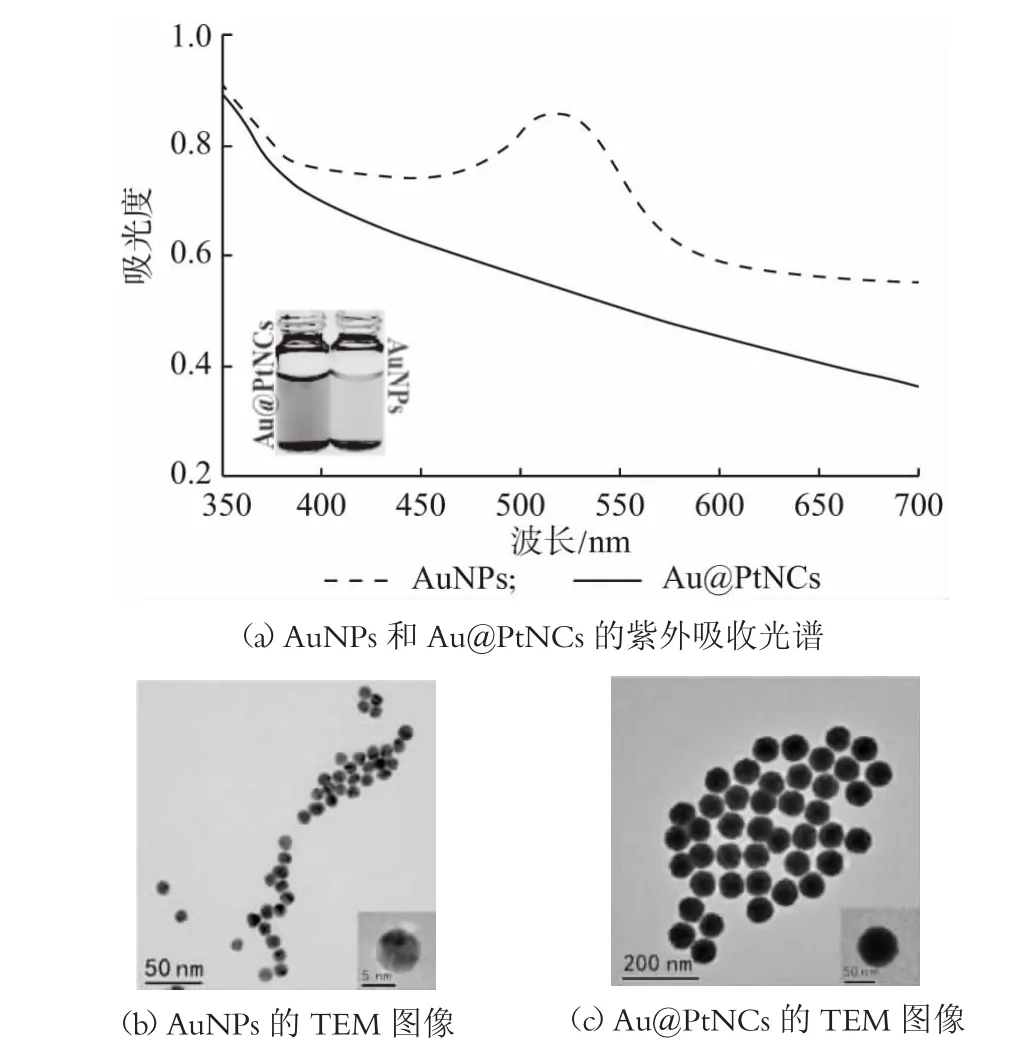
图1 Au@PtNCs 表征
2.2 免疫Au@PtNCs 探针制备及优化
抗体标记pH、抗体偶联时间、抗体饱和标记量、Au@PtNCs 探针用量和免疫反应时间对检测条件的优化息息相关。因此,本实验分别对抗体标记pH、抗体偶联时间、抗体饱和标记量、Au@PtNCs 探针用量及免疫反应时间5 个条件进行优化,使用酶标仪测定OD652nm。pH 会改变蛋白质构象影响抗体结合位点活性,从而使得探针结合效率发生变化。首先用NaOH(0.01 mol/L)对溶液的pH 进行调控,结果如图2(a)所示,当pH 从5.0 增加到6.0 时,吸光度从0.74 增加至1.12;随着pH 增加至9.0 时,吸光度降至0.70,在pH 为6.0 的条件下吸光值最大,这表明较高pH 不利于免疫反应进行,会导致比色信号减弱。抗体偶联时间也会影响探针结合效率,如图2(b)所示,在最佳标记pH 下,随着抗体偶联时间的增加,吸光度逐渐增大,偶联时间3.5 h 吸光度达到最大水平为1.19,之后趋于平缓,3.5 h 为最佳抗体偶联时间。在上述最优的条件下对抗体饱和标记量进行优化,结果表明抗体使用量从10 μg 到25 μg,OD652nm从0.80 迅速变为1.55,随着抗体使用量继续加大,吸光度上升趋势趋于平缓,由此可确定最佳抗体饱和标记量为25 μg,如图2(c);在最佳抗体饱和标记量(25 μg)的基础上,进一步对免疫探针用量优化,结果如图2(d)所示,当探针用量从5 μL 增加至30 μL,吸光度从0.42 迅速增加至1.49,之后信号略有下降,可能是由于空间位阻造成的,由此可确定最佳探针用量为30 μL。在确定了最佳标记pH 为6、抗体标记量25 μg 以及免疫探针用量30 μL 的条件下,进一步优化免疫反应时间。如图2(e)所示,当免疫反应时间由0 min 增加到50 min 时,随着免疫反应时间的增加其吸光值由0.60 增至1.58,至50 min 以后不再呈明显上升趋势,由此可确定最佳免疫反应时间为50 min。
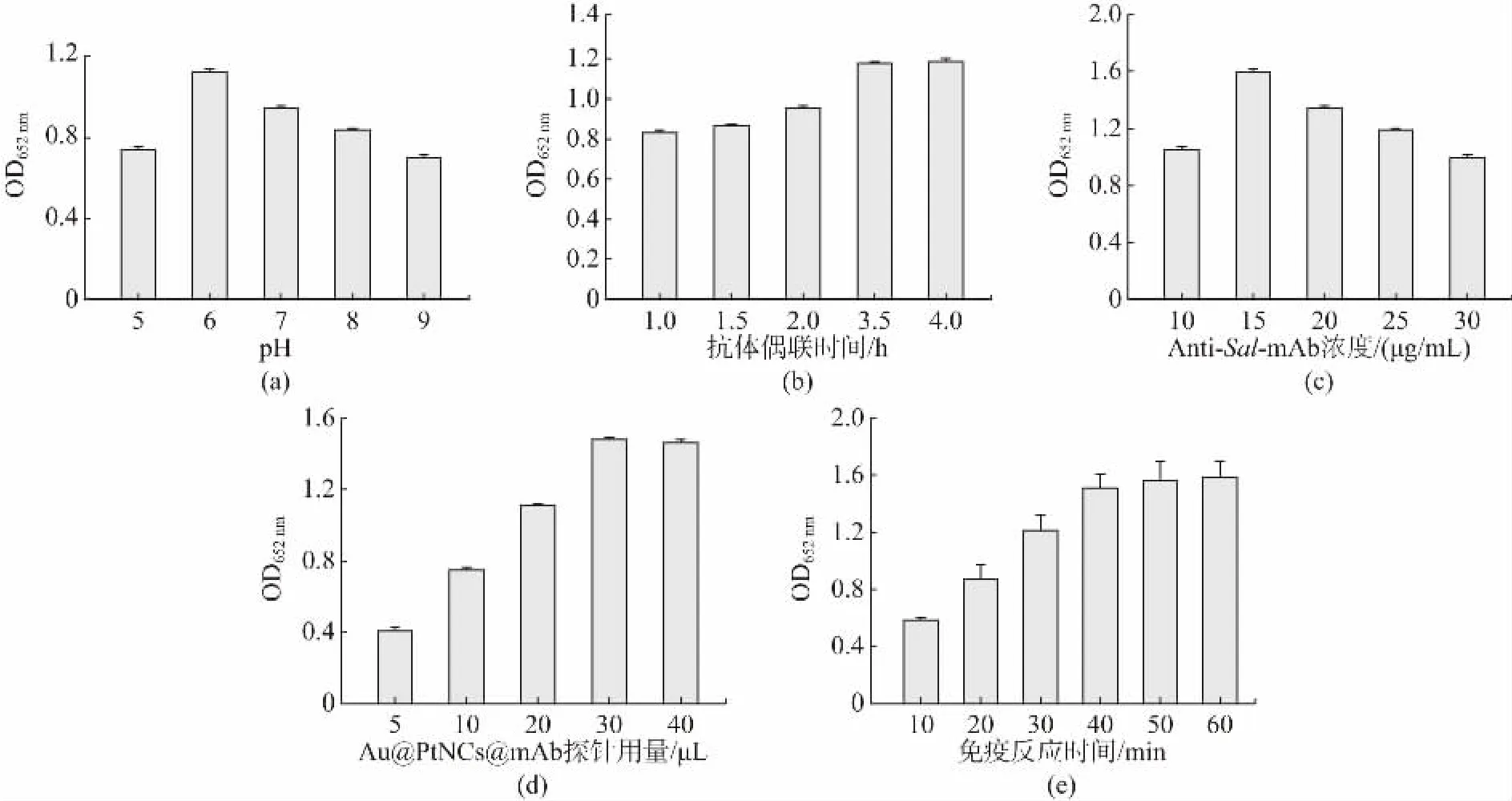
图2 检测条件的优化
2.3 比色传感器对鼠伤寒沙门氏菌的响应性能分析
2.3.1 检测标准曲线的构建
在确认2.2 中优化的检测条件下,设置了一组具有浓度梯度的鼠伤寒沙门氏菌菌液(97~9.7×106CFU/mL)验证该比色传感器的检测性能。如图3 所示,以鼠伤寒沙门氏菌的浓度为横坐标,以OD652nm为纵坐标,绘制标准曲线,OD652nm与目标细菌浓度在97~9.7×105呈现良好线性关系,其线性方程为:y=0.274In(x)-0.8757(R2=0.987),经标准曲线计算获得该生物传感器的最低检测灵敏度为81 CFU/mL。此外,还使用TEM 表征形成的免疫复合物图像,表明已经形成了双抗夹心复合物。
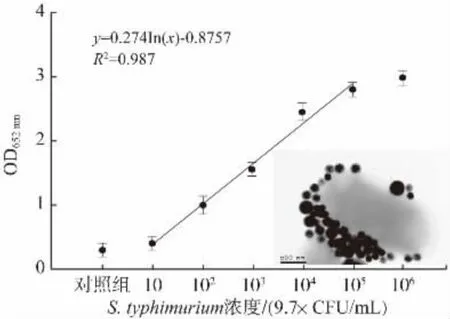
图3 以牛乳样本绘制的标准曲线及免疫复合物TEM 图像
2.3.2 特异性评价
特异性的识别对于评估分析实际样品至关重要。用该比色型传感器检测鼠伤寒沙门氏菌(1.1×103CFU/mL)与其它3 株常见的致病菌:大肠杆菌O157:H7、蜡样芽孢杆菌、单核细胞增生李斯特菌(5×106CFU/mL),验证本方法对鼠伤寒沙门氏菌的检测特异性。如图4 所示,非靶菌的吸光值明显低于0.30。此外,含所有细菌的混合物的吸光度与目标细菌的水平相似,吸光度均达到1.90 以上。这些结果表明,该生物传感器检测鼠伤寒沙门氏菌具有良好的特异性,这归因于合成的成本低、稳定性高的Au@PtNCs 探针具有优异的过氧化物酶模拟催化活性。同时,结合磁分离技术对目标细菌鼠伤寒沙门氏菌进行分离富集,实现了对比色型生物传感器信号的放大。
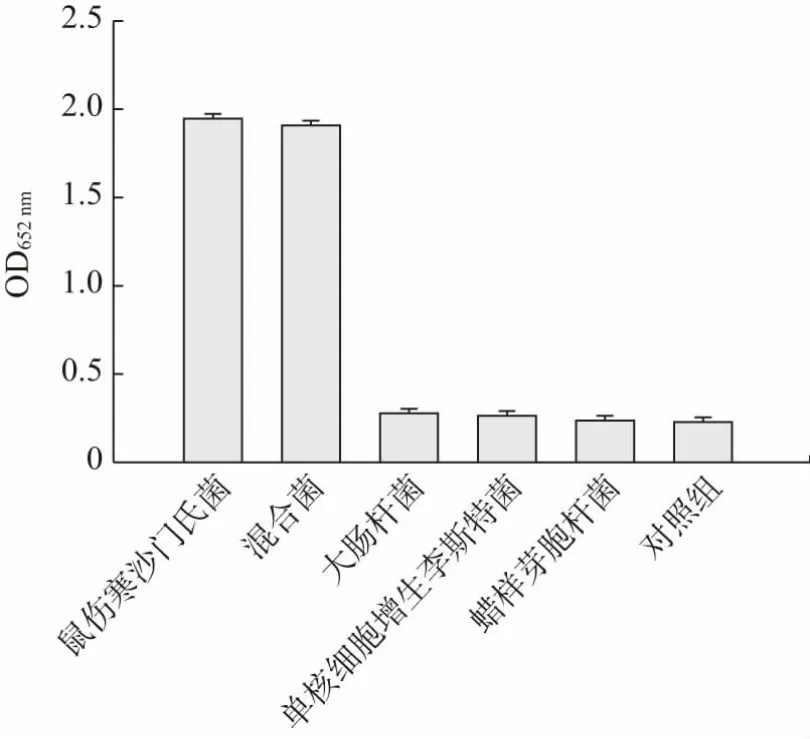
图4 基于Au@PtNCs 的比色型生物传感器特异性评价
2.3.3 实际样本检测性能评价
为确定该比色型生物传感器在真实样品检测中的实用性及可行性,进行牛乳样本的加标回收实验。如表1 所示,根据建立的标准曲线计算出各加标样品批内平均回收率为96.75%~101.75%,CV 为1.10%~5.13%,批间平均回收率为97.25%~101.35%,CV为3.01%~5.00%,以上结果说明该生物传感器对鼠伤寒沙门氏菌的检测具有实用性及可行性。
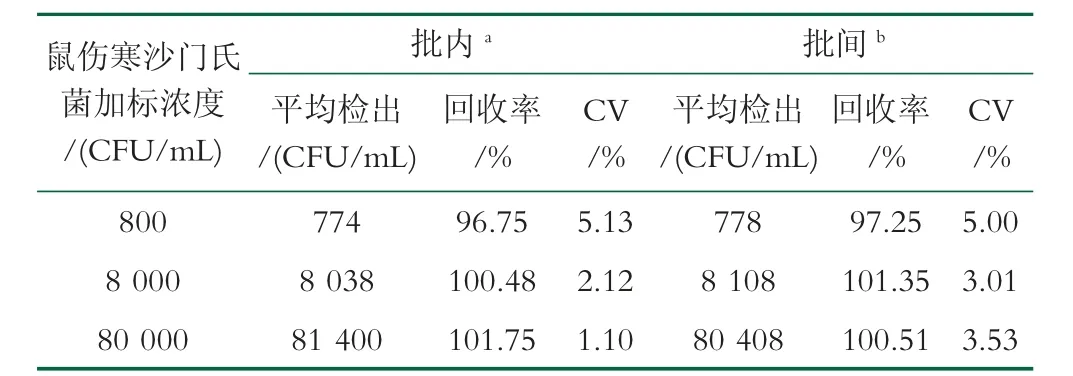
表1 牛乳样本中鼠伤寒沙门氏菌的检测分析
3 结 论
成功建立了一种基于多孔Au@PtNCs 的比色型生物传感器检测牛乳中鼠伤寒沙门氏菌ATCC 14028 的方法。最低检测限为81 CFU/mL,线性范围为97~9.7×105CFU/mL。对常见的3 株食源性致病菌进行检测,均没有出现交叉反应,表明该生物传感器具有较好的特异性和选择性。此外,在实际牛乳样本加标实验中,其加标回收率为96.75%~101.75%,CV 为1.10%~5.13%。由此方法可实现对鼠伤寒沙门氏菌简单、快速、灵敏的检测,且可用于其他的生物分子或化学目标领域。
